Les sarcomes des tissus mous sont des tumeurs malignes rares du tissu conjonctif. Le traitement est multidisciplinaire et doit être déterminé par un centre de sarcome. Les lésions de Whoops sont des excisions non planifiées de sarcomes des tissus mous sans diagnostic ou traitement préalable. l’imagerie. Les lésions de Whoops sont présentes chez 20 à 50 % des patients atteints de sarcomes des tissus mous. Les lésions Whoops sont associées à un taux plus élevé de récidives locales et à un moins bon pronostic. Après des résections non planifiées, il reste du tissu tumoral. Il faut donc procéder à une résection ultérieure étendue, ce qui peut entraîner une morbidité importante, une augmentation des complications, voire la perte du membre. En Suisse, toutes les disciplines du sarcome se sont organisées au niveau national (www.sarcoma.ch) et ont publié des guidelines thérapeutiques afin d’éviter les erreurs de diagnostic et la mauvaise gestion des sarcomes des tissus mous.
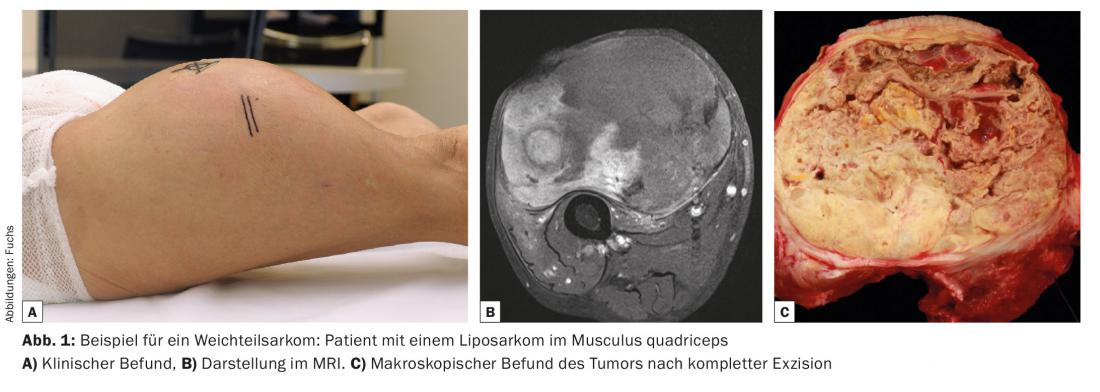
Les sarcomes des tissus mous représentent moins de 1% de toutes les tumeurs malignes chez l’adulte. Les sarcomes des tissus mous peuvent survenir chez des patients de tout âge et sont à peu près aussi fréquents chez les femmes que chez les hommes. Environ 50% des sarcomes des tissus mous sont localisés aux extrémités, le membre inférieur étant plus souvent touché. En principe, cependant, l’apparition est possible dans n’importe quelle localisation. D’un point de vue histologique, les sarcomes des tissus mous constituent un groupe très hétérogène, ce qui explique la complexité de la nomenclature. A l’exception des tumeurs malignes des gaines nerveuses périphériques d’origine neuroectodermique, ils proviennent de cellules mésodermiques et sont regroupés en fonction de leur origine cellulaire présumée : Les liposarcomes proviennent de cellules adipeuses (Fig. 1), les rhabdomyosarcomes de muscles squelettiques striés et les léiomyosarcomes de muscles lisses. Mais il existe aussi des entités, comme le sarcome pléomorphe à cellules fusiformes, dont l’origine des cellules est inconnue. Malgré leur immense diversité, majoritairement structurelle, le comportement biologique de tous les sarcomes des tissus mous est très similaire, c’est pourquoi ils sont souvent considérés comme un groupe homogène lors du diagnostic et de la prise en charge.
Diagnostic des sarcomes des tissus mous
La plupart des patients atteints de sarcome des tissus mous se présentent au cabinet médical avec un gonflement indolore des tissus mous. Il n’existe pas de signes cliniques clairs permettant de distinguer une tumeur maligne d’une tumeur bénigne des tissus mous. Une croissance rapide de la tumeur ou une taille supérieure à 5 cm, en particulier si elle est sous-fasciale, sont suspectes de malignité. Si la masse est inférieure à 5 cm, mais adhère au fascia profond ou aux structures environnantes, on peut également suspecter un événement malin. En raison des résultats souvent peu clairs sur le plan clinique, la poursuite du diagnostic par imagerie et éventuellement par biopsie est déterminante dans la prise en charge des sarcomes des tissus mous. Si l’on soupçonne un sarcome, il faut impérativement procéder à une imagerie complémentaire. L’IRM est considérée comme la procédure de choix. L’administration d’un produit de contraste supplémentaire (gadolinium) augmente alors la précision du diagnostic. Les avantages de l’IRM par rapport à l’échographie sont une meilleure représentation morphologique de la tumeur et une meilleure image de la position anatomique par rapport aux structures neurovasculaires importantes.
Le Swiss National Sarcoma Advisory Board a établi des directives auxquelles le médecin traitant peut se référer (“minimal work-up requirements”). Les directives sont librement accessibles sur le site www.sarcoma.ch et fournissent des indications précieuses sur les situations dans lesquelles une imagerie plus poussée ou une biopsie est appropriée.
Biopsie
En principe, toutes les tumeurs superficielles des tissus mous sous-cutanés de plus de 5 cm et toutes les tumeurs sous-fasciales doivent être biopsiées avant une résection chirurgicale. La biopsie doit obligatoirement être réalisée par un membre de l’équipe qui procédera ensuite à la résection chirurgicale. La plupart du temps, les sarcomes des tissus mous sont biopsiés sous contrôle échographique, mais dans certains cas, une biopsie guidée par scanner est nécessaire. Une ponction à l’aiguille fine donne souvent trop peu de tissu pour pouvoir établir un diagnostic clair sur le plan histologique et de la génétique moléculaire. La biopsie à l’emporte-pièce est donc considérée comme le gold standard. Si la biopsie est simple sur le plan manuel et technique, elle est souvent exigeante sur le plan intellectuel et de la planification. Comme il existe un risque que la biopsie entraîne des cellules tumorales dans les tissus environnants, le tractus de la biopsie doit également être excisé lors de l’opération ultérieure. Pour cette raison, la biopsie doit être en ligne avec l’incision chirurgicale ultérieure de la peau. Le trajet de la biopsie ne doit jamais longer de près des vaisseaux ou des nerfs, ni traverser des compartiments anatomiques non encore atteints. De même, la formation d’un hématome doit être évitée à tout prix afin d’éviter une nouvelle dissémination locale de la tumeur.
Traitement des sarcomes des tissus mous
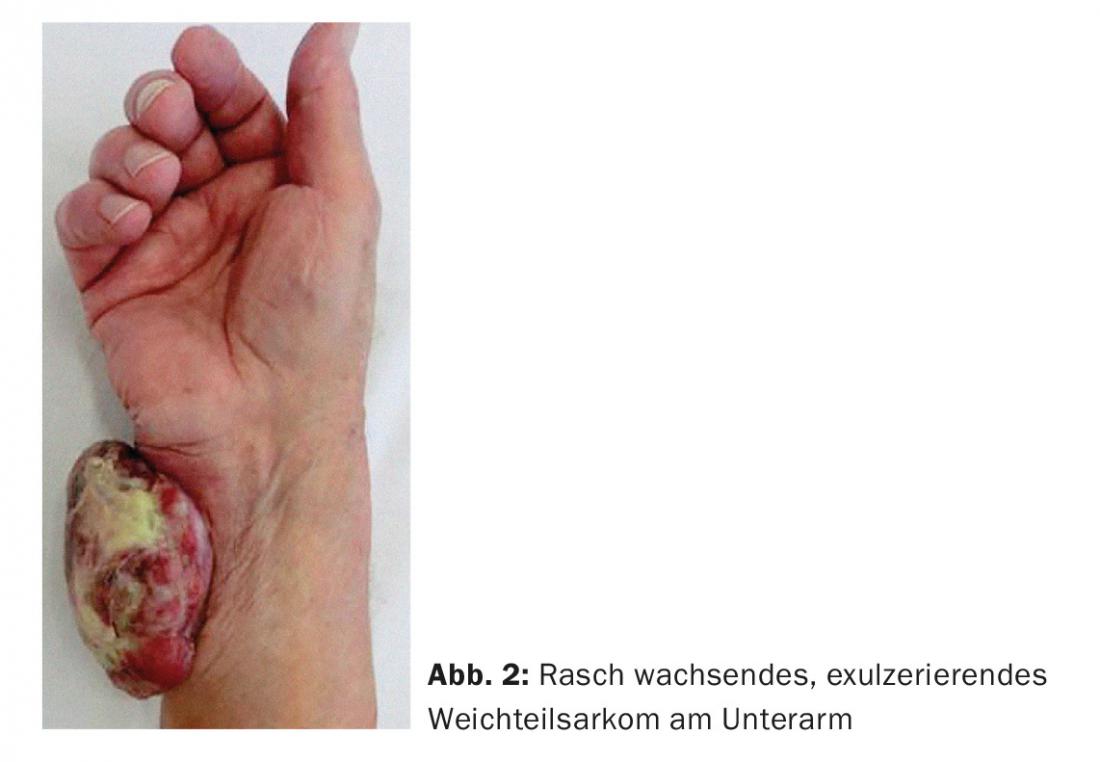
Si, après une suspicion initiale à l’imagerie IRM, le diagnostic de sarcome des tissus mous a été confirmé par biopsie, un plan de traitement est défini lors d’un comité multidisciplinaire sur les sarcomes. Le traitement local se fait généralement par une thérapie combinée, c’est-à-dire une résection chirurgicale associée à une radiothérapie. Qu’il y ait ou non des métastases au moment du diagnostic, les patients atteints de sarcome des tissus mous ont besoin d’un traitement local afin d’éviter les complications locales. Si la tumeur n’est pas traitée, elle peut devenir très grosse, compromettre les structures neurovasculaires et s’ulcérer à travers la peau (Fig. 2) , mettant finalement en danger le membre dans son ensemble.
L’objectif de la résection chirurgicale est de retirer complètement le sarcome en conservant des marges de résection sans tumeur, tout en préservant autant que possible la fonction du membre. Il s’agit souvent d’un exercice d’équilibre qui doit être discuté individuellement avec chaque patient en préopératoire.
Tous les patients sont soumis à une radiothérapie afin de stériliser l’environnement et d’obtenir ainsi un meilleur contrôle local qu’avec la chirurgie seule. La radiothérapie peut être administrée avant ou après l’opération, bien que dans un essai contrôlé randomisé mené au Canada, le traitement préopératoire ait donné des résultats légèrement supérieurs [1]. Mais l’avantage de la radiothérapie préopératoire réside surtout dans le fait que la dose et le volume d’irradiation sont plus faibles que ceux de la radiothérapie postopératoire, ce qui entraîne moins d’effets secondaires à long terme.
La chimiothérapie pour les sarcomes des tissus mous reste non standard, mais optionnelle pour les patients à haut risque. Les méta-analyses montrent un taux de réponse d’environ 5-10% en termes de survie et de métastases. Les bénéfices de cette thérapie sont donc faibles et souvent impossibles à prédire.
La lésion des Whoops
Les lésions de Whoops sont une résection de tumeur sans diagnostic préopératoire préalable et sans que le chirurgien ait pensé à la possibilité d’un sarcome. Souvent, une palpation permet de suspecter une modification bénigne (“lipome”). Le nodule est alors réséqué chirurgicalement et l’analyse anatomopathologique révèle, à la surprise du chirurgien, un résultat malin. Comme les sarcomes des tissus mous sont très rares et que l’on ne pense donc pas à ce diagnostic, la littérature fait état d’un traitement insuffisant et inapproprié par les chirurgiens dans jusqu’à 20-50% des cas.
Examens après une lésion de Whoops
Après une résection non planifiée d’un sarcome des tissus mous, le traitement ultérieur doit impérativement être poursuivi dans un centre de sarcome. La première étape consiste en un traitement complet de tous les résultats, rapports et images existants. Les échantillons de tissus disponibles doivent être réévalués par un pathologiste de référence pour contrôle afin d’éviter toute erreur de diagnostic. Le patient est soumis à un examen clinique, avec une attention particulière portée à l’emplacement et au tracé de la cicatrice chirurgicale, à la présence d’hématomes, aux éventuelles sorties de drains et au type de fermeture de la plaie. Tous ces facteurs peuvent entraîner un déplacement des cellules tumorales vers des compartiments anatomiques non affectés à l’origine et doivent donc être pris en compte dans la suite du traitement.
L’étape suivante consiste à réaliser un staging complet afin de visualiser l’atteinte tumorale locale et systémique. Le staging local est réalisé à l’aide d’une IRM et d’un produit de contraste afin de rechercher les tissus tumoraux restants dans la zone opérée et d’évaluer la contamination éventuelle due à la résection non planifiée précédente. La difficulté réside souvent dans le fait que les modifications cicatricielles postopératoires normales ne peuvent pas toujours être clairement distinguées du tissu tumoral résiduel. Ainsi, après une résection non planifiée, la sensibilité de l’IRM n’est plus que de 64%. Le staging systémique comprend dans tous les cas un scanner thoracique et un scanner abdominal et pelvien si le diagnostic de liposarcome myxoïde ou de léiomyosarcome est posé.
Traitement d’une lésion Whoops
Dans la grande majorité des cas, une résection ultérieure de la zone opérée est effectuée. L’objectif est de retirer le sarcome restant et les tissus potentiellement contaminés avec des marges de résection suffisantes. La justification d’une résection ultérieure repose sur l’observation qu’après une résection non planifiée, on trouve presque toujours du tissu tumoral résiduel, du moins au microscope (24-60%). Ce fait peut influencer le pronostic ultérieur du patient. La résection ultérieure est souvent difficile, en raison du tissu cicatriciel, des couches anatomiques modifiées et de l’absence de masse pouvant servir de guide. Les cicatrices mal situées et les fuites de drains antérieurs compliquent encore la situation.
Contrairement aux résections primaires planifiées des sarcomes des tissus mous, pour lesquelles la radiothérapie fait partie intégrante du traitement, le rôle de la radiothérapie dans le traitement des lésions de Whoops reste moins clair et doit être discuté individuellement au sein du Sarkomboard. La radiothérapie seule n’est utilisée que lorsque la résection ultérieure serait trop mutilante pour le patient. Les données actuelles montrent un pronostic légèrement meilleur lorsque l’on associe la chirurgie à la radiothérapie [2].
La chimiothérapie fait l’objet de controverses dans le traitement des lésions de Whoops. Les données disponibles sont peu nombreuses et souvent de qualité insuffisante. Toutefois, si des métastases sont déjà présentes lors du premier staging avant la résection, la chimiothérapie doit certainement être discutée au moins avec le patient.
Conséquences d’une lésion de Whoops
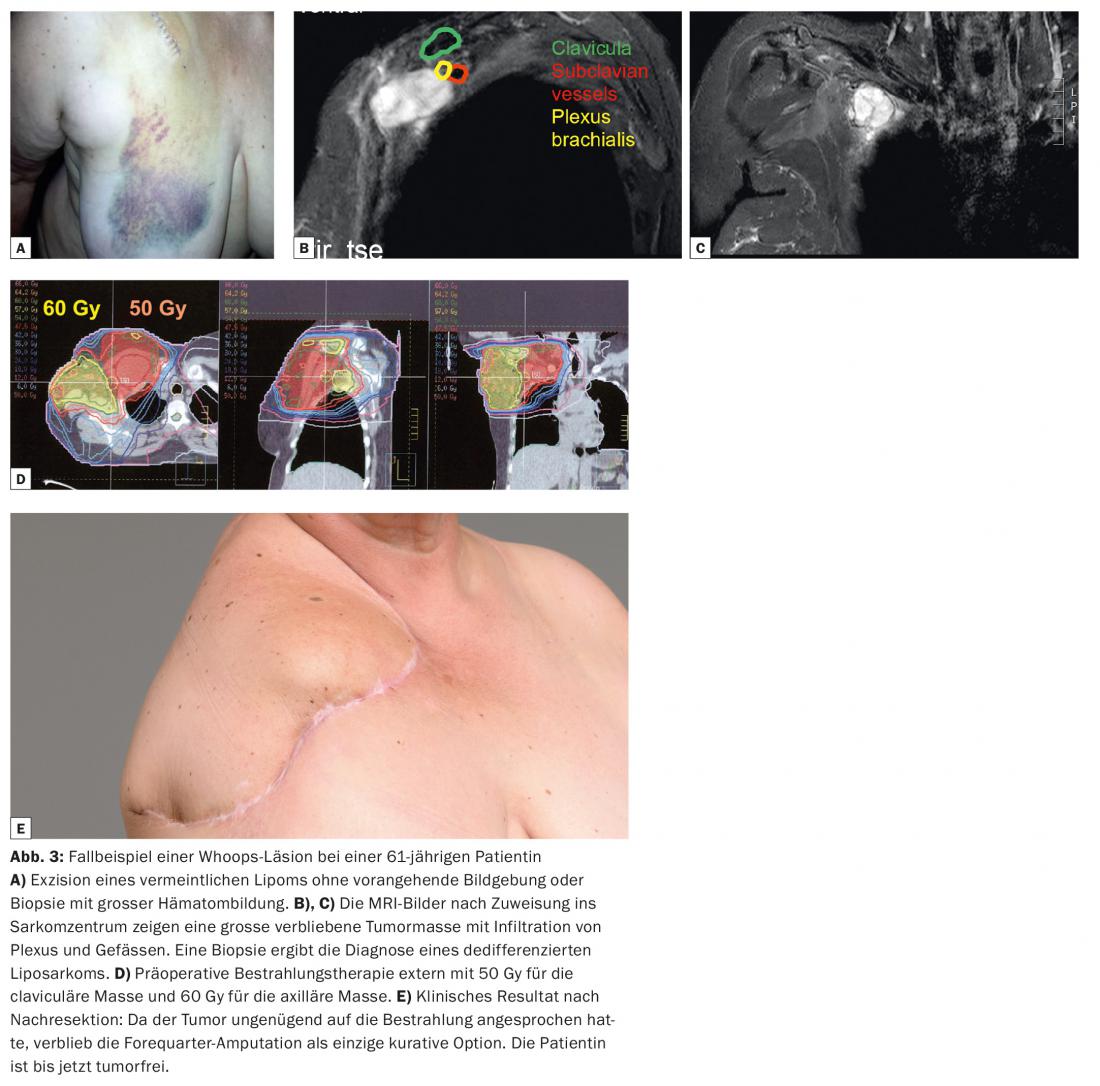
Les excisions non planifiées et incorrectes d’un sarcome des tissus mous ont des conséquences importantes pour le patient concerné. Globalement, le taux de survie à 5 ans est plus faible et le taux de récidive locale plus élevé que chez les patients ayant reçu un traitement interdisciplinaire adéquat [3–5]. La littérature décrit des taux de récidive locale après des lésions de Whoops pouvant atteindre 39%. De plus, la survie spécifique à la maladie à cinq ans (69,8%) est nettement inférieure à celle obtenue avec une résection planifiée (87,5%). La résection ultérieure de l’ancien site chirurgical peut entraîner des défauts importants de la peau et des tissus mous. Il est donc beaucoup plus souvent nécessaire d’utiliser un lambeau de tissus mous ou une greffe de peau (jusqu’à 30% des cas) pour obtenir une couverture suffisante des tissus mous. Cela se traduit par un taux de complications périopératoires plus élevé et des résultats fonctionnels moins bons. Comme le montre notre exemple de cas (Fig. 3), il faut parfois même envisager une amputation qui aurait pu être évitée en premier lieu.
Résumé
Des excisions non planifiées de sarcomes des tissus mous peuvent survenir chez 20 à 50% des patients chez qui un sarcome des tissus mous vient d’être diagnostiqué. Ils devraient donc déjà être adressés en priorité à un centre de sarcome. La résection ultérieure du lit tumoral est généralement recommandée après une résection non planifiée, souvent en combinaison avec la radiothérapie, afin d’éliminer le plus complètement possible le tissu tumoral qui reste souvent. Les ré-excisions sont plus étendues que les opérations primaires, entraînent une plus grande morbidité et nécessitent plus souvent des reconstructions complexes des tissus mous. Après une lésion de Whoops, la radiothérapie seule semble avoir un effet insuffisant, mais elle est utilisée comme traitement adjuvant à la chirurgie lorsqu’une opération trop mutilante doit être envisagée. Les excisions non planifiées de sarcomes des tissus mous sont associées à un taux plus élevé de récidives locales et à un pronostic généralement moins bon. Le Swiss National Sarcoma Advisory Board (www.sarcoma.ch) a donc rédigé des lignes directrices pour éviter les erreurs de diagnostic et la mauvaise gestion.
Littérature :
- O’Sullivan B, et al : Radiothérapie préopératoire versus radiothérapie postopératoire dans le sarcome des tissus mous des membres : un essai randomisé. Lancet 2002 ; 359(9325) : 2235-2241.
- Jones DA, et al. : Gestion de l’excision non planifiée pour le sarcome des tissus mous avec radiothérapie préopératoire suivie d’une résection définitive. Am J Clin Oncol 2014.
- Chandrasekar CR, et al : The effect of an unplanned excision of a soft-tissue sarcoma on prognosis. J Bone Joint Surg Br. 2008 ; 90(2) : 203-208.
- Noria S, et al : Maladie résiduelle suite à l’excision non planifiée d’un sarcome des tissus mous d’une extrémité. J Bone Joint Surg Am 1996 ; 78(5) : 650-655.
- Potter BK, et al : Récurrence locale de la maladie après excision non planifiée de sarcomes des tissus mous de haut grade. Clin Orthop Relat Res 2008 ; 466(12) : 3093-3100.
Littérature complémentaire, Key paper :
- Pretell-Mazzini J, et al : Excision non planifiée de sarcomes des tissus mous : concepts actuels pour la prise en charge et le pronostic. J Bone Joint Surg Am 2015 ; 97(7) : 597-603.
Bibliographie supplémentaire chez l’éditeur
InFo ONKOLOGIE & HÄMATOLOGIE 2015 ; 3(8) : 26-29











