Le syndrome du côlon irritable (en anglais : irritable bowel syndrome) est la maladie fonctionnelle la plus fréquente du tractus gastro-intestinal. Cet article fournit une mise à jour sur la physiopathologie, le diagnostic et le traitement de ce complexe de symptômes aux multiples facettes.
Le syndrome du côlon irritable (SCI) est la maladie fonctionnelle du tractus gastro-intestinal la plus fréquente, avec une prévalence estimée entre 7 et 30 % en Europe [1]. La maladie représente un ensemble de symptômes décrits par les critères de Rome IV (tab. 1) [2]. Trois sous-types sont décrits en fonction de la consistance des selles : RDS de type diarrhée (RDS-D/IBS-D), RDS de type constipation (RDS-O/IBS-C)-RDS de type mixte (RDS-M/IBS-M).

Le diagnostic est généralement posé avant l’âge de 50 ans, les femmes étant plus souvent touchées que les hommes (2:1). Seul un quart des patients consulte un médecin, ce qui laisse un grand nombre de cas non déclarés. Les patients souffrant de RDS ont une qualité de vie nettement réduite par rapport à la population normale, ce qui entraîne des coûts directs (consultations médicales, médicaments, maladies associées) et indirects (arrêts de travail, diminution des performances) considérables. Parmi les comorbidités, les maladies psychiatriques, en particulier la dépression, sont les plus fréquentes chez les patients souffrant de SDR, avec jusqu’à 30% contre 18% dans la population normale [3]. Il existe également une forte association avec des maladies telles que la fibromyalgie, la migraine et le syndrome de fatigue chronique.
Physiopathologie
Le SDR est une maladie multifactorielle complexe qui est encore loin d’être comprise, malgré les nombreuses nouvelles découvertes de ces dernières années (Fig. 1). L’axe intestin-cerveau (en anglais : brain-gut-axis) implique l’interaction des systèmes autonome, neuroendocrinien et neuroimmunologique avec le système nerveux central. Le tractus gastro-intestinal est fortement innervé et un grand nombre de fibres nerveuses afférentes génèrent des informations sur le contenu intestinal et les processus de régulation de la digestion, de l’absorption et de la défense immunitaire [4]. Dans le cas du RDS, il existe des preuves que le traitement central de ces informations ainsi que la réponse aux signaux intestinaux sont perturbés [5]. La caractéristique commune des maladies fonctionnelles du tractus gastro-intestinal est l’hypersensibilité viscérale. Les patients souffrant de RDS présentent un seuil de perception et de douleur plus bas en réponse aux stimuli intestinaux, ce qui peut encore favoriser la sensibilisation du système nerveux central [6]. La cause de cette sensibilisation n’est finalement pas claire. Dans le cas du RDS, de subtils troubles de la motilité gastro-intestinale sont également connus, peut-être en tant qu’effecteur d’une hypersensibilité viscérale, qui peuvent entraîner un temps de transit prolongé ou accéléré, selon leur degré.
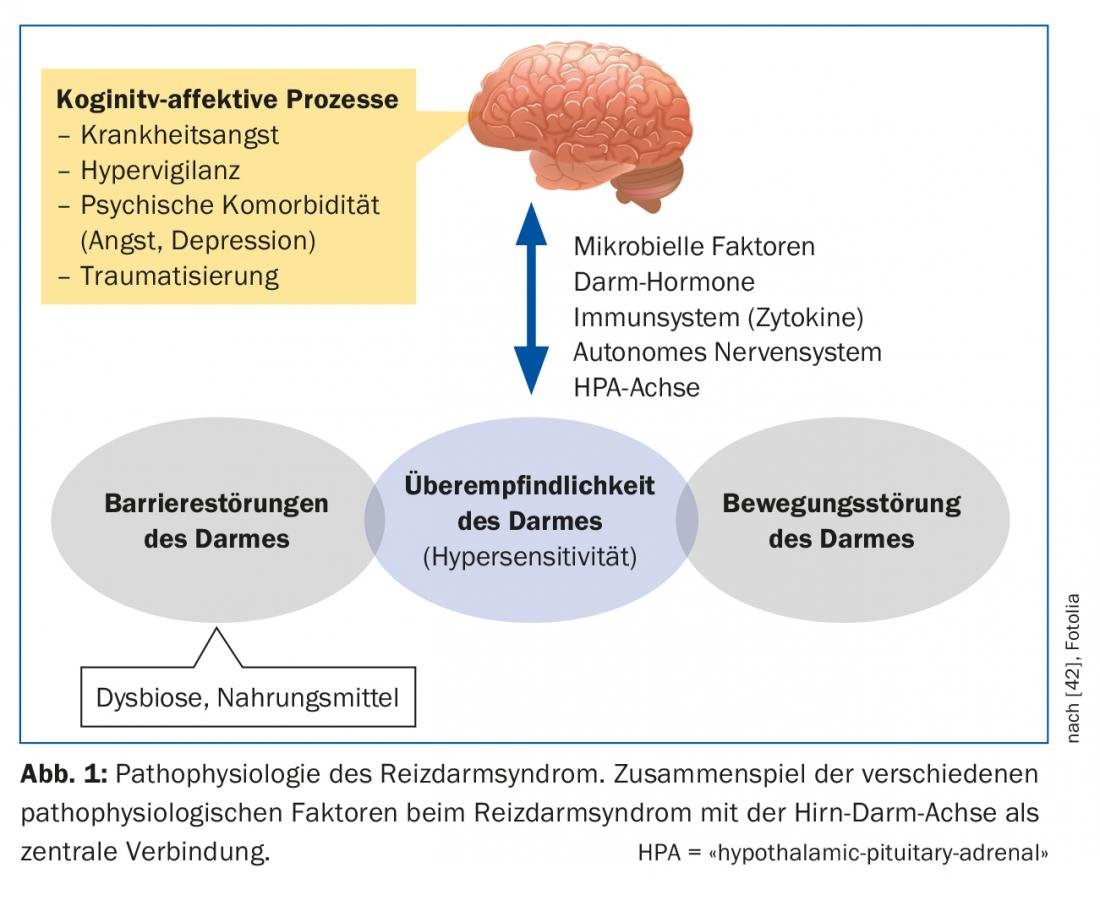
La muqueuse de l’intestin présente une surface énorme avec laquelle nous sommes quotidiennement en contact avec le monde extérieur. Cette interaction peut être modifiée de plusieurs façons chez les patients souffrant de RDS. La barrière intestinale est constituée d’une couche unique de jonctions serrées. S’ils ne fonctionnent pas correctement, ils peuvent augmenter la perméabilité intestinale (“leaky gut”). Les antigènes peuvent ainsi pénétrer dans l’épithélium et déclencher et entretenir des processus immunologiques ou inflammatoires [7]. Le microbiome intestinal joue également un rôle. Il est composé d’un grand nombre d’espèces bactériennes différentes et fait partie intégrante de nombreux processus au niveau de la barrière intestienne. Si l’équilibre naturel est perturbé, il existe une dysbiose intestinale qui peut survenir pour différentes raisons (par exemple, un traitement antibiotique). Il existe des preuves de l’existence d’une dysbiose quantitative et qualitative chez les patients souffrant de RDS, qui peut affecter le fonctionnement de l’axe intestin-cerveau. On discute également de la question de savoir si une inflammation muqueuse persistante et de faible intensité, par exemple après des infections gastro-intestinales aiguës, peut modifier la perméabilité intestinale. Certaines études ont montré une augmentation des cellules inflammatoires dans la muqueuse des patients souffrant de RDS [8].
Le rôle du stress chronique, en particulier après des expériences traumatisantes dans l’enfance, peut favoriser la probabilité d’une réaction interstinale excessive à la douleur à l’âge adulte [9]. Le stress peut également avoir une influence sur l’axe hypothalamique du cortisol et ainsi influencer les processus inflammatoires dans la muqueuse.
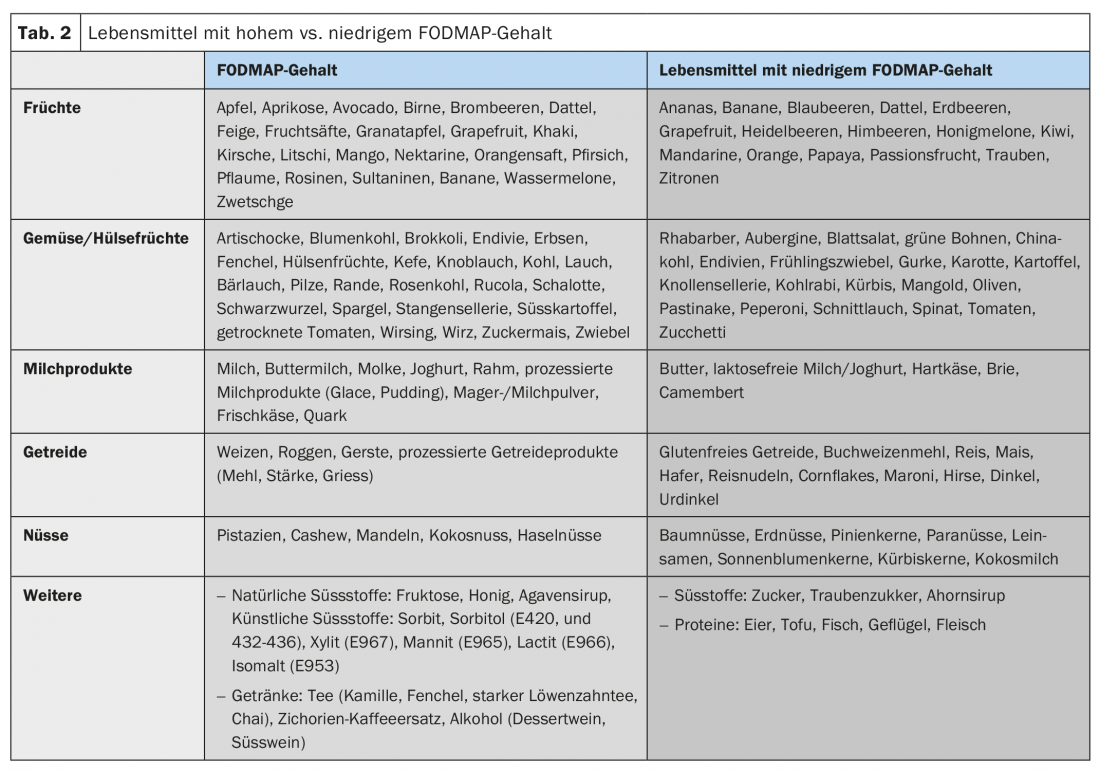
La plupart des patients décrivent une aggravation de leurs symptômes après les repas et la plupart des patients savent quels aliments doivent être évités [10]. En raison de l’effet osmotique et de la fermentation bactérienne, les composants alimentaires mal absorbés, notamment les FODMAP (oligosaccharides, di- et monosaccharides et polyols fermentables), peuvent aggraver les troubles abdominaux liés au RDS (tableau 2). La fermentation de ces FODMAP dépend également de la composition du microbiote intestinal. De plus, des interactions bioactives directes avec la muqueuse et des activations immunitaires par les aliments sont suspectées. Les facteurs cognitifs (l’anticipation de la douleur après les repas) jouent également un rôle dans ce domaine.
Le SDR est plus fréquent dans les familles, ce qui suggère une origine génétique en plus des facteurs sociaux. Les jumeaux monozygotes sont plus susceptibles d’avoir un SDR que les jumeaux dizygotes (33% contre 13%) et les antécédents familiaux positifs sont plus fréquents en cas de SDR que dans la population normale (33% contre 2%) [11].
Diagnostic
Le RDS n’est pas un diagnostic d’exclusion, mais peut être établi à l’aide des critères de Rome IV et d’un nombre limité d’examens. En l’absence de signes d’alerte – âge >50 ans, perte de poids, fièvre, pertes de sang ab ano, dysphagie, vomissements, fièvre, anémie, antécédents familiaux positifs de tumeurs colorectales, de maladies inflammatoires chroniques de l’intestin et de maladie cœliaque – si les critères de Rome sont remplis, le diagnostic de SDR peut être posé avec une bonne certitude [12]. Une maladie organique n’est trouvée que chez 5% des patients souffrant de RDS au cours de l’évolution, mais il est important d’exclure les maladies systémiques pertinentes, en particulier au cours de la première année après le début des symptômes du RDS [13]. Après 50 ans, la probabilité d’un cancer du côlon après un diagnostic (supposé) de SDR est de 1%, ce qui est nettement supérieur à la population normale. Chez les femmes, il faut toujours penser à un cancer de l’ovaire, car des symptômes semblables au SDR apparaissent souvent comme premier symptôme [14].
Chez les patients présentant un RDS-D, il est recommandé d’exclure une maladie cœliaque par une sérologie et de déterminer les anticorps antitransglutaminase IgA et les anticorps anti-IgA totales. La prévalence d’une carence en IgA est nettement plus élevée dans la maladie cœliaque (1,7-3%) que dans la population générale (0,2%). HLA-DQ2 et -DQ8 ne doivent pas être utilisés comme test de recherche.
être.
Jusqu’à 40% des patients souffrant d’une maladie inflammatoire chronique de l’intestin remplissent également les critères d’un SDR, de sorte qu’il convient d’exclure une inflammation intestinale par le dosage non invasif et rentable de la calprotectine dans les selles. Le risque de maladie inflammatoire chronique de l’intestin avec une calprotectine <40 ug/g est inférieur à 1% [15]. L’inconvénient est que la calprotectine est peu spécifique, c’est pourquoi des investigations supplémentaires doivent être menées en cas de valeurs élevées.
En présence de symptômes typiques du SDR sans signes d’alarme, la probabilité d’un cancer du côlon ou d’une maladie inflammatoire chronique de l’intestin est d’environ 1%, de sorte que les directives américaines ne recommandent une coloscopie que chez les patients de plus de 50 ans [16]. Les directives européennes recommandent également une coloscopie avant l’âge de 50 ans en cas de SDR-D, notamment pour exclure une colite microscopique [17].
Dans les cas où le doute persiste, des examens de laboratoire plus approfondis peuvent être utiles : Marqueurs inflammatoires systémiques (CRP, hémogramme différencié), paramètres de malabsorption (statut en fer, vitamine, albumine), TSH, élastase pancréatique dans les selles, test respiratoire au lactose H2, parasitologie des selles).
Une échographie dans l’évaluation initiale des troubles abdominaux pour exclure une pathologie grossière est généralement réalisée car elle est rapidement disponible et peu coûteuse. Il n’existe toutefois aucune preuve positive de son utilité dans le diagnostic du RDS.
En résumé, le diagnostic de RDS repose sur quatre facteurs : l’anamnèse, l’examen physique, un nombre limité d’examens de laboratoire et une endoscopie dans certains cas. Il convient en outre de mentionner l’examen gynécologique chez les femmes.
Thérapie
Dans le traitement du SDR, il est recommandé de procéder par étapes en tenant compte de la sévérité des symptômes décrits (Fig. 2). La plupart des patients peuvent être pris en charge avec succès dans le cadre d’une consultation de médecine générale. Seule une petite partie d’entre eux, dont l’évolution de la maladie est difficile et réfractaire, bénéficient d’une prise en charge par une consultation spécialisée en gastroentérologie.
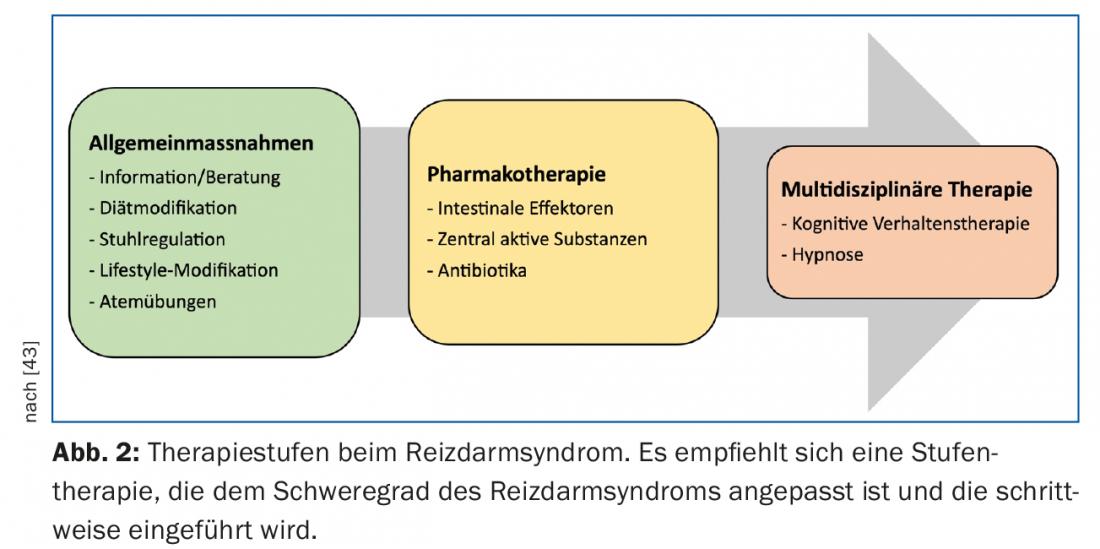
Un élément central dans le traitement du SDR est une relation médecin-patient stable et intacte. Les patients souffrant de RDS se plaignent souvent d’un manque d’empathie et de compréhension pour les symptômes qu’ils décrivent, ce qui entraîne, outre des plaintes persistantes, des consultations répétées, des demandes d’examens complémentaires et, bien souvent, des changements réguliers de médecin. Le traitement de base consiste en une transmission détaillée du diagnostic avec des explications compréhensibles et adaptées au patient sur la physiopathologie et les possibilités thérapeutiques, sans utiliser de termes médicaux. L’authenticité des plaintes doit être crédible pour le patient et les craintes doivent absolument être prises au sérieux. Il est notamment important de s’enquérir de la compréhension de la maladie et des attentes, mais il faut en même temps fixer des objectifs réalistes (“il n’est pas possible d’être sûr à 100% du diagnostic”). Les patients doivent être impliqués dans les décisions thérapeutiques, c’est ainsi que la satisfaction/qualité de vie et l’évolution de la maladie peuvent être influencées positivement.
Modification du régime alimentaire : lors de la première consultation, la plupart des patients font déjà état d’essais personnels de régimes d’exclusion dans le passé, mais une adaptation structurée du régime est souvent la première étape du traitement des symptômes du SDR. Les composants alimentaires mal absorbés et osmotiquement actifs, en particulier les FODMAP, jouent un rôle. L’efficacité d’un régime pauvre en FODMAP dans le RDS a été démontrée dans plusieurs études (environ 70% de réponse clinique), c’est pourquoi les modifications de régime devraient toujours être l’une des premières étapes thérapeutiques dans le RDS [18]. Les données actuelles ne permettent pas de recommander un régime probatoire sans gluten seul.
Traitement analgésique : les spasmolytiques anticholinergiques sont très souvent utilisés dans le SDR, bien que les preuves de l’efficacité de ces médicaments soient maigres [19]. En Suisse, les principales substances utilisées sont les suivantes : La butylscopalamine (Buscopan®), la mébévérine (Duspatalin®), le bromure de pinavérine (Dicetel®), la trimébutine (Debridat®) et le métixène (Spasmocanulase®). Les effets secondaires possibles sont la sécheresse de la bouche et les troubles de la vision.
Les produits phytothérapeutiques sont bien acceptés par les patients, le plus utilisé en Suisse étant Iberogast®, un mélange à base d’alcool de neuf extraits de plantes. Une étude randomisée et contrôlée par placebo a montré une amélioration significative des douleurs abdominales associées au SDR [20]. Une réduction significative des symptômes du RDS a également été démontrée pour les capsules d’huile de menthe poivrée (Colpermin®), souvent utilisées [21,22]. Ici, l’effet est probablement multifactoriel, notamment par une action antagoniste sur les canaux calciques (relaxation musculaire) et une action agonisante sur les récepteurs opioïdes. Une autre préparation est le concentré d’artichaut Hepa-S®, mais les quelques données disponibles ne montrent pas de bénéfice certain [23].
Les antidépresseurs tels que les inhibiteurs de la recapture de la sérotonine (ISRS) et les antidépresseurs tricycliques ont pour objectif de corriger un déficit sérotoninergique en agissant sur l’axe intestin-cerveau. Dans une revue Cochrane [24], des effets positifs ont été obtenus à la fois sur l’état général et spécifiquement sur les douleurs abdominales (number needed to treat (NNT) = 4 resp. 5). Cependant, les patients souffrant de RDS et n’ayant pas de dépression comme comorbidité ne semblent pas bénéficier d’un traitement par ISRS.
Traitement du RDS avec constipation : l’utilisation d’agents gonflants tels que Sterculia (Colosan®, Normacol®) et les graines de puces/lin (Metamucil®, Mucilar®, Linomed®) ou de laxatifs isoosmotiques à base de polyéthylène glycol (Transipeg®, Movicol®) permet d’améliorer la fréquence et la consistance des selles, mais ces préparations n’ont aucun effet sur les douleurs abdominales ou les ballonnements associés au RDS [19]. Les laxatifs stimulants doivent être évités en raison de leur mauvaise tolérance.
Le linaclotide (Constella®) est un agoniste de la guanylate cyclase agissant localement dans l’intestin, approuvé pour le traitement du SDR avec constipation. L’action locale des récepteurs entraîne l’activation de canaux ioniques dans l’intestin et donc la sécrétion de chlorure, de bicarbonate et d’eau dans la lumière intestinale. De plus, il existe également un effet analgésique sur les nocicepteurs de l’intestin. Le linaclotide augmente significativement le nombre de défécations complètes et réduit le nombre et l’intensité des douleurs abdominales [25,26].
La lubiprostone (Amitiza®) est un activateur des canaux chlorure agissant localement dans l’intestin. Elle est autorisée en Suisse pour le traitement de la constipation idiopathique chronique et de la constipation induite par les opioïdes. A des doses plus faibles, le médicament est également autorisé aux Etats-Unis et au Japon pour le RDS-O où il a montré de bons résultats sur les symptômes du RDS (douleur, ballonnements) [27].
Le prucalopride (Resolor®) est un agoniste sélectif des récepteurs de la sérotonine (5-HT4) à haute affinité, autorisé en Suisse pour le traitement de la constipation idiopathique chronique. Pour l’utilisation dans le RDS-O, il existe des données qui ont montré un effet positif sur les symptômes du RDS [28].
Traitement du RDS avec diarrhée : le lopéramide (Imodium®) est souvent utilisé dans le RDS-D pour réguler les selles, mais n’a aucun effet sur les symptômes douloureux. En combinaison avec un agent gonflant, l’effet anti-diarrhéique peut être amélioré. Pour le traitement de la diarrhée, la cholestyramine (Quantalan®), un chélateur des acides biliaires, peut également être utilisée à titre probatoire, étant donné qu’environ 25% des patients souffrant de RDS-D présentent des signes d’un syndrome de perte d’acides biliaires [29]. Des études non randomisées ont démontré que la cholestyramine réduisait la fréquence des selles et les douleurs abdominales [30].
L’eluxadoline (Truberzi®) est un agoniste des récepteurs opioïdes μ et κ et un antagoniste des récepteurs opioïdes δ agissant localement dans l’intestin, ce qui lui confère des propriétés anti-diarrhéiques et analgésiques. En février 2018, le médicament a été autorisé par Swissmedic pour le traitement du RDS-D, mais il n’est pas encore disponible en Suisse. Dans une étude randomisée, Truberzi a montré un meilleur contrôle de la douleur et de la diarrhée que le placebo après 12 semaines de traitement sur la période suivante d’un an [31]. C’était également le cas pour les patients qui avaient déjà été traités au préalable par le lopéramide, un μ-récepteur opioïde [32].
L‘ondansétron (Zofran®) est un antagoniste des récepteurs de la sérotonine (5-HT3) autorisé en Suisse pour le traitement des nausées associées à la chimiothérapie. Chez les patients atteints de RDS-D, on a également observé un ralentissement du péristaltisme intestinal et une réduction de l’hypersensibilité viscérale ou des douleurs abdominales [33]. D’autres études sont prévues pour confirmer ces résultats prometteurs.
La rifaximine (Xifaxan®) est un antibiotique à spectre large spécifique de l’intestin, autorisé en Suisse pour la prévention des récidives d’encéphalopathie hépatique. Aux États-Unis, ce médicament peut également être utilisé dans le traitement du RDS-D. Il est également utilisé dans le traitement de l’asthme. Pour la rifaximine, il a été démontré qu’après deux semaines de traitement, il y avait un effet positif sur les symptômes du RDS pour les dix semaines suivantes (8-10% de plus que le placebo) [34]. Le traitement antibiotique semble entraîner une modification positive du microbiote intestinal, mais les mécanismes exacts ne sont pas clairs. Si nécessaire, le cycle de traitement peut être répété à volonté. Les craintes initiales concernant le développement d’une résistance n’ont pas été confirmées et le profil d’effets secondaires est faible.
Pour l’utilisation des probiotiques dans le SDR, les preuves ne sont pas concluantes, les études sont hétérogènes, avec des résultats positifs dans une majorité d’études de petite taille. Les meilleurs résultats semblent être obtenus avec Lactobacillus spec., Bifidobacterius spec. et Saccharomyces boulardii. Dans une récente revue systématique, les probiotiques ont été reconnus comme efficaces chez certains patients souffrant de syndrome du côlon irritable. [35].
Les thérapies non pharmacologiques : La thérapie cognitivo-comportementale et l’hypnose semblent présenter un certain avantage dans le traitement du SDR, mais il n’est pas clair si l’amélioration des symptômes du SDR est liée à une réduction effective de la douleur viscérale ou si elle reflète simplement une meilleure gestion de la douleur. En 2009, deux analyses Cochrane ont évalué avec réserve l’effet de ces thérapies [36,37]. Une récente revue systématique a évalué positivement l’effet de ces thérapies, mais la forme de contact, la durée du traitement et le type de communication ne sont toujours pas clairement définis [38].
Traitement du SDR avec gêne liée aux ballonnements : Les ballonnements, avec ou sans augmentation visible du volume de l’abdomen, sont une caractéristique de diverses maladies fonctionnelles du tractus gastro-intestinal et sont souvent perçus comme très gênants par les patients. En dehors des modifications du régime alimentaire (régime pauvre en FODMAP) et de l’utilisation de la rifaximine, il existe peu de possibilités thérapeutiques. Il n’existe aucune preuve de l’utilisation de substances antimousses telles que la siméthicone (Flatulex®) ou la diméthicone (Spasmocanulase®) dans les troubles fonctionnels liés aux ballonnements. Leur utilité est souvent décevante. Un certain nombre d’études élégantes ont montré que les flatulences chez les patients souffrant de RDS ne sont pas causées par une augmentation de la quantité de gaz intestinal, mais par des déplacements caudo-ventraux du contenu intra-abdominal. Par un réflexe viscéro-somatique, il y a plutôt une réaction musculaire anormale du diaphragme (contraction) et des muscles abdominaux inférieurs (relaxation), ce qui entraîne la protrusion de l’abdomen [39]. Le même groupe de recherche a ensuite pu obtenir une réduction significative des symptômes et du volume abdominal chez des patients RDS souffrant de ballonnements aigus à l’aide d’une thérapie respiratoire spécifique assistée par biofeedback [40]. Dans une étude randomisée ultérieure, les symptômes de ballonnement ont diminué progressivement avec un entraînement régulier sur une période d’observation de six mois [41].
Résumé
Le syndrome du côlon irritable reste un ensemble de symptômes qui n’est encore que partiellement compris et les possibilités de traitement sont toujours limitées. Au fur et à mesure que la physiopathologie sera mieux comprise, il sera probablement possible de caractériser d’autres sous-types dans le pot commun aujourd’hui très hétérogène des maladies fonctionnelles de l’intestin. Non pas sur la base de la symptomatologie clinique, comme tentent de le faire aujourd’hui les critères de Rome IV, mais à l’aide de biomarqueurs qui permettront éventuellement à l’avenir un diagnostic positif de cette pathologie. Une meilleure compréhension de la physiopathologie permettrait inévitablement de développer de nouvelles approches thérapeutiques qui iraient au-delà du traitement actuel axé uniquement sur les symptômes.
Messages Take-Home
- Le syndrome du côlon irritable n’est pas un diagnostic d’exclusion, mais peut être posé à l’aide des critères de Rome IV et d’un nombre limité d’examens.
- Le traitement du syndrome du côlon irritable repose sur une approche progressive tenant compte de la gravité.
- Les modifications de régime, en particulier les FODMAP (oligo-, di- et monosaccharides fermentescibles), et un régime pauvre en polyols devraient être l’une des premières étapes thérapeutiques.
- Les troubles fonctionnels liés aux ballonnements peuvent être soulagés par la physiothérapie et la kinésithérapie respiratoire.
Littérature :
- Saha L : Syndrome de l’intestin irritable : pathogenèse, diagnostic, traitement, et médecine fondée sur les preuves. World J Gastroenterol 2014 ; 20(22) : 6759-6773.
- Lacy BE, et al : Troubles de l’intestin grêle. Gastroenterology 2016 ; 150(6) : 1393-1407e5.
- Grundmann O, Yoon SL : Irritable bowel syndrome : Epidemiology, diagnosis and treatment : An update for health-care practitioners. J Gastroenterol Hepatol 2010 ; 25(4) : 691-699.
- Brookes SJH, Spencer NJ, Costa M, Zagorodnyuk VP : Signalisation des afférents primaires extrinsèques dans le gut. Nat Rev Gastroenterol Hepatol 2013 ; 10(5) : 286-296.
- Lee YJ, Park KS : Syndrome de l’intestin irritable : paradigme émergent en physiopathologie. World J Gastroenterol 2014 ; 20(10) : 2456-2469.
- Soares RLS : Irritable bowel syndrome : A clinical review. World J Gastroenterol 2014 ; 20(34) : 12144-12160.
- Matricon J, et al : Article de revue : Associations entre l’activation immunitaire, la perméabilité intestinale et le syndrome de l’intestin irritable. Aliment Pharmacol Ther 2012 ; 36(11-12) : 1009-1031.
- Katiraei P, Bultron G : Nécessité d’une approche médicale globale de la neuro-immuno-gastro-entérologie du syndrome de l’intestin irritable. World J Gastroenterol 2011 ; 17(23) : 2791-27800.
- Larauche M, Mulak A, Taché Y : Altérations de la sensation viscérale liées au stress : modèles animaux pour l’étude du syndrome de l’intestin irritable. J Neurogastroenterol Motil 2011 ; 17(3) : 213-234.
- Heizer WD, Southern S, McGovern S : The Role of Diet in Symptoms of Irritable Bowel Syndrome in Adults : A Narrative Review. J Am Diet Assoc 2009 ; 109(7) : 1204-1214.
- El-Salhy M : Syndrome de l’intestin irritable : diagnostic et pathogenèse. World J Gastroenterol 2012 ; 18(37) : 5151-5163.
- Whitehead WE, Palsson OS, Simrén M : Syndrome du côlon irritable : que signifient les nouvelles directives de diagnostic Rome IV pour la prise en charge des patients ? Expert Rev Gastroenterol Hepatol 2017 ; 11(4) : 281-283.
- El-Serag HB, Pilgrim P, Schoenfeld P : Revue systématique : Histoire naturelle du syndrome de l’intestin irritable. Aliment Pharmacol Ther 2004 ; 19(8) : 861-870.
- Hamilton W, Peters TJ, Bankhead C, Sharp D : Risk of ovarian cancer in women with symptoms in primary care : Population based case-control study. BMJ 2009 ; 339(7721) : 616.
- Menees SB, et al : A meta-analysis of the utility of C-reactive protein, erythrocyte sedimentation rate, fecal calprotectin, and fecal lactoferrin to exclude inflammatory bowel disease in adults with IBS. Am J Gastroenterol 2015 ; 110(3) : 444-454.
- AGA : American Gastroenterological Association Medical Position Statement : Syndrome de l’intestin irritable. Gastroenerology 2002 ; 123(6) : 2105-2107.
- Layer P, et al. : S3-Leitlinie Reizdarmsyndrom : Definition, Pathophysiologie, Diagnostik und Therapie. Ligne directrice conjointe de la Société allemande des maladies digestives et métaboliques (DGVS) et de la Société allemande de neurogastroentérologie et de motilité. Journal de gastroentérologie 2011 ; 49(2) : 237-293.
- Halmos EP, et al : A Diet Low in FODMAPs Reduces Symptoms of Irritable Bowel Syndrome. Gastroenterology 2014 ; 146(1) : 67-75.
- Ruepert L, et al : Bulking agents, antispasmodic and antidepressant medication for the treatment of irritable bowel syndrome. Cochrane Database Syst Rev 2011 ; (8) : CD003460.
- Madisch A, Holtmann G, Plein K, Hotz J : Traitement du syndrome de l’intestin irritable avec des préparations à base de plantes : résultats d’un essai clinique multicentrique, randomisé, en double aveugle et contrôlé par placebo. Aliment Pharmacol Ther 2004 ; 19(3) : 271-279.
- Merat S, et al : L’effet de l’huile de menthe poivrée entérique à libération prolongée sur le syndrome de l’intestin irritable. Dig Dis Sci 2010 ; 55(5) : 1385-1390.
- Khanna R, MacDonald JK, Levesque BG : Peppermint oil for the treatment of irritable bowel syndrome : A systematic review and meta-analysis. J Clin Gastroenterol 2014 ; 48(6) : 505-512.
- Liu J, et al : Herbal medicines for treatment of irritable bowel syndrome (Review). Cochrane Database Syst Rev 2006 ; (1) : CD004116.
- Kaminski A, et al : Antidepressants for the treatment of abdominal pain-related functional gastrointestinal disorders in children and adolescents. Cochrane Database Syst Rev 2011 ; (7) : CD008013.
- Chey WD, et al : Linaclotide for Irritable Bowel Syndrome with Constipation : A 26-week, randomized, double-blind, placebo-controlled trial to evaluate efficacy and safety. Am J Gastroenterol 2012 ; 107(11) : 1702-1712.
- Rao S, et al : A 12-week, randomized, controlled trial with a 4-week randomized withdrawal period to evaluate the efficacy and safety of linaclotide in irritable bowel syndrome with constipation. Am J Gastroenterol 2012 ; 107(11) : 1714-1724.
- Drossman DA, et al : Clinical trial : Lubiprostone in patients with constipation-associated irritable bowel syndrome – Results of two randomized, placebo-controlled studies. Aliment Pharmacol Ther 2009 ; 29(3) : 329-341.
- Malagelada C, et al. : Effet du prucalopride sur la tolérance intestinale aux gaz chez les patients souffrant de troubles fonctionnels de l’intestin et de constipation. J Gastroenterol Hepatol 2017 ; 32(8) : 1457-1462.
- Wedlake L, et al : Systematic review : The prevalence of idiopathic bile acid malabsorption as diagnosed by SeHCAT scanning in patients with diarrhea-predominant irritable bowel syndrome. Aliment Pharmacol Ther 2009 ; 30(7) : 707-717.
- Camilleri M : Options de gestion du syndrome de l’intestin irritable. Mayo Clin Proc 2018 ; 93(12) : 1858-1872.
- Lembo AJ, et al : Eluxadoline pour le syndrome de l’intestin irritable avec diarrhée. N Engl J Med 2016 ; 374(3) : 242-253.
- Lacy BE, et al : Eluxadoline Efficacy in IBS-D Patients Who Report Prior Loperamide Use. Am J Gastroenterol 2017 ; 112(6) : 924-932.
- Garsed K, et al : A randomised trial of ondansetron for the treatment of irritable bowel syndrome with diarrhoea. Gut 2014 ; 63(10) : 1617-1625.
- Pimentel M, et al : Rifaximin Therapy for Patients with Irritable Bowel Syndrome without Constipation. N Engl J Med 2011 ; 364(1) : 22-32.
- Hungin APS, et al : Systematic review : probiotics in the management of lower gastrointestinal symptoms in clinical practice — an evidence-based international guide. Aliment Pharmacol Ther 2013 ; 38(8) : 864-886.
- Webb AN, Kukuruzovic RH, Catto-Smith AG, Sawyer SM : Hypnothérapie pour le traitement du syndrome de l’intestin irritable. Cochrane database Syst Rev 2007 ; (4) : CD005110.
- Zijdenbos IL, et al : Traitements psychologiques pour la prise en charge du syndrome de l’intestin irritable. Cochrane Database Syst Rev 2009 ; (1) : CD006442.
- Radziwon CD, Lackner JM : Cognitive Behavioral Therapy for IBS : How Useful, How Often, and How Does It Work ? Curr Gastroenterol 2017 ; 19(10) : 49.
- Accarino A, et al : Abdominal Distention Results From Caudo-ventral Redistribution of Contents. Gastroenterology 2009 ; 136(5) : 1544-1551.
- Barba E, et al. : Mécanismes abdominothoraciques de la distension abdominale fonctionnelle et correction par biofeedback. Gastroenterology 2015 ; 148(4) : 732-739.
- Barba E, Accarino A, Azpiroz F : Correction de la distension abdominale par contrôle guidé par biofeedback de l’activité musculaire abdomino-thoracique dans un essai randomisé contrôlé par placebo. Clin Gastroenterol Hepatol 2017 ; 15(12) : 1922-1929.
- Van Oudenhove LV, et al : Biopsychoscial aspects of functional gastrointestinal disorders : how central and environmental processes contribute to the development and expression of functional gastrointestinal disorders. Gastroenterology 2016 ; 150(6) : 1355-1367.e2.
- Jaynk GS, Gyawali CP : Syndrome du côlon irritable : concepts modernes et options de gestion. The American journal of Medicine 2015 ; 128(8) : 817-827.
PRATIQUE DU MÉDECIN DE FAMILLE 2019 ; 14(1) : 11-18











