Un enfant présentant une cytopénie inexpliquée et des symptômes supplémentaires tels que fièvre, lymphadénopathie ou hépatosplénomégalie doit être adressé généreusement et rapidement à un centre. L’hyperleucocytose, le syndrome de lyse tumorale et la tumeur médiastinale sont des complications qui mettent en jeu le pronostic vital lors de la phase initiale d’évaluation et de traitement. Le taux de survie est de plus de 80% pour la leucémie lymphoïde aiguë (LLA) et de 60% pour la leucémie myéloïde aiguë (LMA). Dans ce cas, la réponse précoce au traitement et la cytogénétique des blastes sont déterminantes pour le pronostic – dans le cas de la LAL, l’âge, le nombre de leucocytes et l’immunophénotype sont également déterminants. Les survivants à long terme d’une leucémie infantile présentent un risque nettement plus élevé de séquelles neuropsychologiques, endocrinologiques, métaboliques et cardiaques, ainsi que de deuxième tumeur.
La leucémie aiguë de l’enfant est un exemple impressionnant de la réussite de l’hématologie et de l’oncologie pédiatriques au cours des 40 dernières années. Ainsi, la leucémie aiguë infantile est passée d’une maladie presque toujours létale dans les années 1960 à une maladie souvent curable de nos jours, avec une survie à long terme de plus de 80%. L’histoire du traitement de la leucémie montre l’importance des essais cliniques randomisés, qui constituent une base pour l’amélioration continue du traitement de la leucémie. A l’avenir, de nouvelles connaissances sur la biologie des cellules leucémiques permettront de mettre en place un traitement plus ciblé et adapté au risque [1].
Épidémiologie
En Suisse, entre 50 et 60 enfants (de 0 à 14 ans) sont atteints chaque année d’une leucémie aiguë (incidence de 5/100 000 habitants) [2]. La leucémie aiguë est la maladie maligne la plus fréquente chez l’enfant (30%) et se répartit en 80% de leucémie aiguë lymphoblastique (LAL) avec la LAL à cellules B et T et 20% de leucémie aiguë myéloïde (LAM). Les patients atteints de LAL ont une chance de survie à long terme de 80% et les patients atteints de LAM de 55 à 60%. Les garçons sont légèrement plus touchés que les filles. La répartition par âge montre un pic de fréquence entre la deuxième et la cinquième année de vie pour la LAL et entre la première et la deuxième année de vie ainsi qu’à partir de l’adolescence pour la LAM [1].
Présentation clinique
Dans la leucémie aiguë, l’expansion clonale de cellules progénitrices hématopoïétiques immatures dans la moelle osseuse entraîne un déplacement de l’hématopoïèse normale. Cette insuffisance de la moelle osseuse entraîne une anémie, une neutropénie et une thrombocytopénie dont les symptômes sont énumérés ci-dessous (tableau 1). En outre, l’infiltration leucémique de la moelle osseuse peut se traduire par une hyperleucocytose et une coagulopathie mettant en jeu le pronostic vital. De plus, différents organes peuvent être infiltrés, comme le foie, la rate, les ganglions lymphatiques, le thymus, les testicules, la peau/les muqueuses et le SNC (tableau 1) [3]. La plupart du temps, les symptômes durent de quelques jours à quelques semaines.
Diagnostic et classification
En cas de suspicion clinique de leucémie aiguë (voir Symptômes Tab. 1) une analyse de sang doit être effectuée par un pédiatre ou un médecin généraliste. Si l’hémogramme révèle une mono-, bi- ou tricytopénie et/ou une leucocytose, l’enfant doit être adressé généreusement et rapidement, si possible, à une clinique pédiatrique spécialisée.

Ici, après un diagnostic initial pour la détection précoce d’un syndrome de lyse tumorale ou d’une masse médiastinale (hémogramme différentiel avec différenciation microscopique, bilan hépatique, bilan rénal, électrolytes, acide urique, LDH, coagulation et radiographie du thorax), les examens suivants spécifiques à la leucémie sont initiés dans la moelle osseuse (aspiration de la moelle osseuse et biopsie).
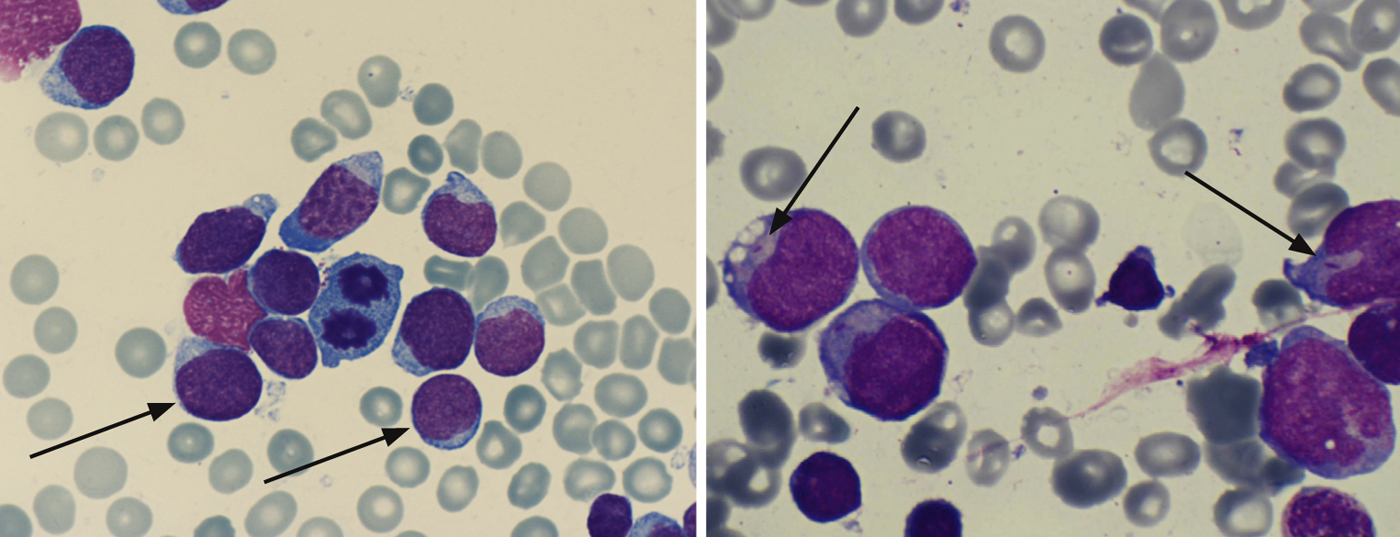
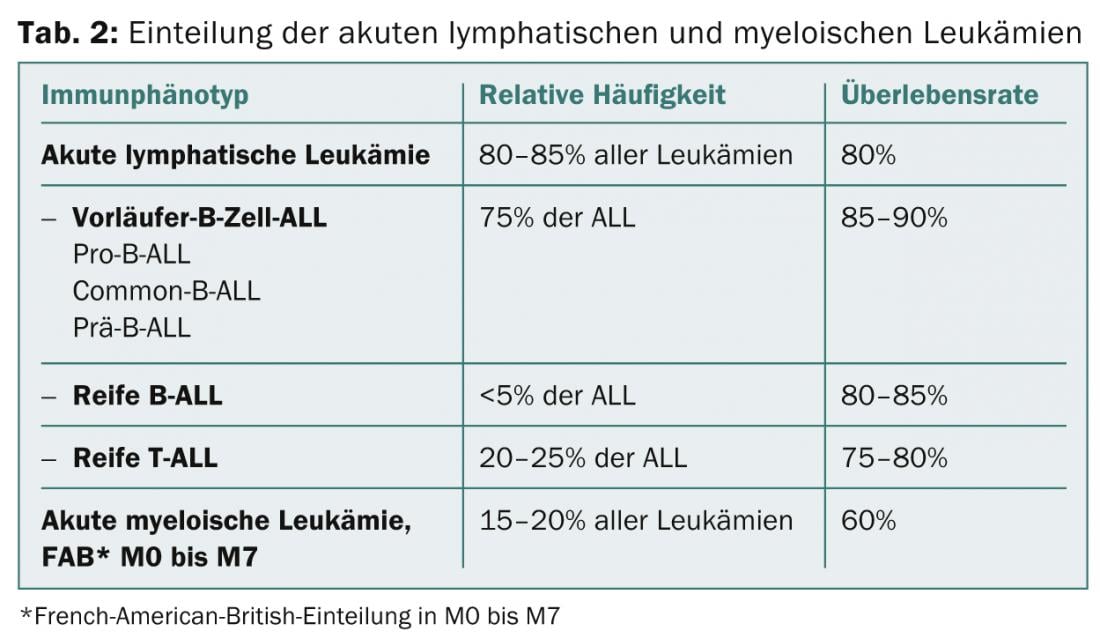
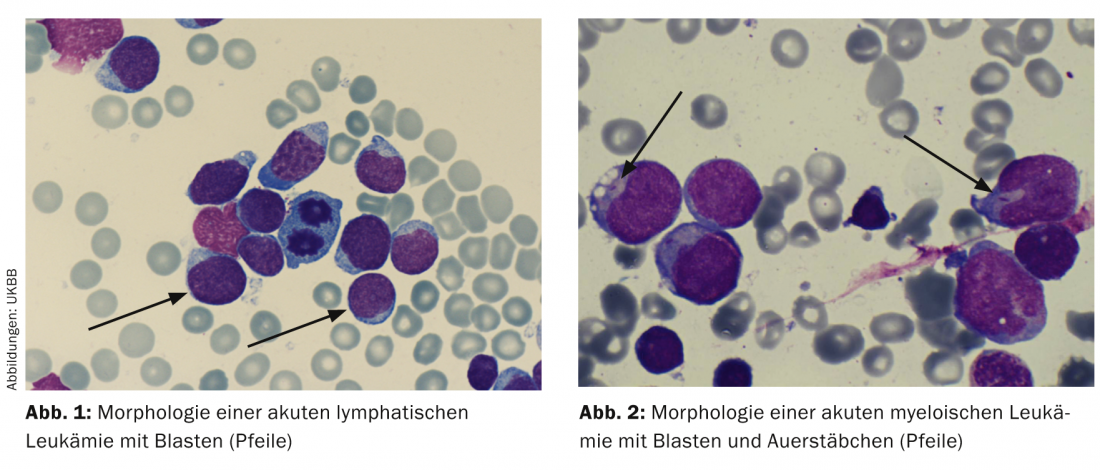
Cytologie/morphologie : il s’agit d’une évaluation de la morphologie de la moelle osseuse au microscope optique. Par définition, une LAL présente ≥ 25 blastes dans la moelle osseuse et une LAM ≥ 30%. Des colorations cytochimiques supplémentaires (myéloperoxydase, phosphatase acide, etc.) peuvent donner une première indication sur les types de leucémie (tableau 2 ; figures 1 et 2).
Les bâtonnets d’Auer sont la preuve d’une LAM et sont l’expression du trouble de la maturation de la cellule leucémique (Fig. 2).
Immunophénotypage : à l’aide de marqueurs de surface spécifiques des blastes leucémiques, l’immunophénotypage par cytométrie de flux permet de caractériser les cellules leucémiques en termes de maturité et d’appartenance à la série des cellules B ou T ou à la série myéloïde (tableau 2).
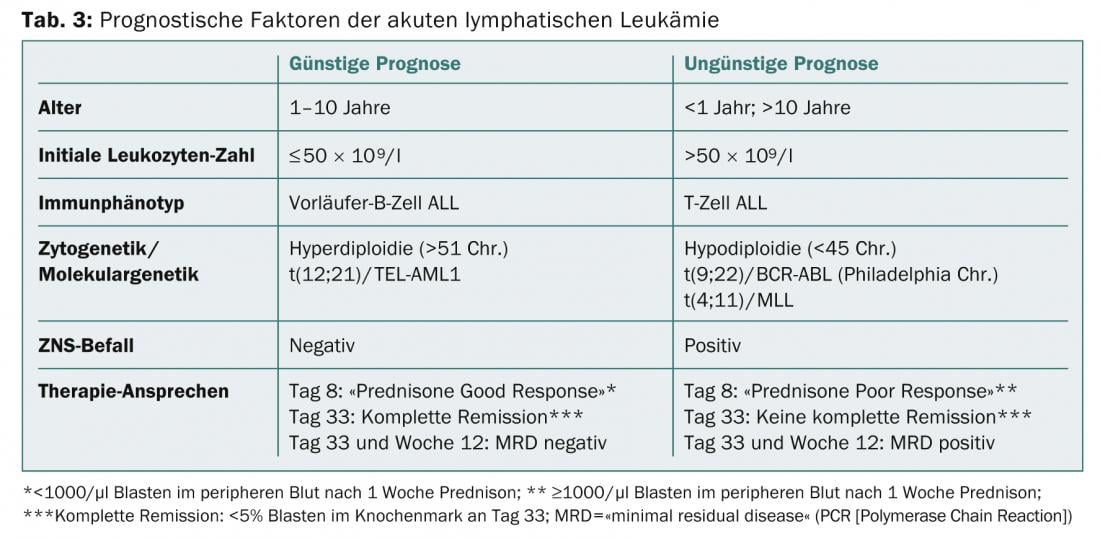
Cytogénétique et génétique moléculaire : en outre, les leucémies aiguës peuvent être caractérisées par des aberrations chromosomiques des blastes et classées en différents groupes de risque. Les facteurs pronostiques favorables dans la B-ALL sont par exemple une hyperdiploïdie ainsi que la translocation t(12;21)(p13;q21) avec le gène de transfusion TEL-AML1 ; les facteurs pronostiques défavorables sont une hypodiploïdie et la translocation t(9;22)(q34;q11) (= chromosome de Philadelphie) avec le gène de transfusion BCR-ABL (tab. 3).
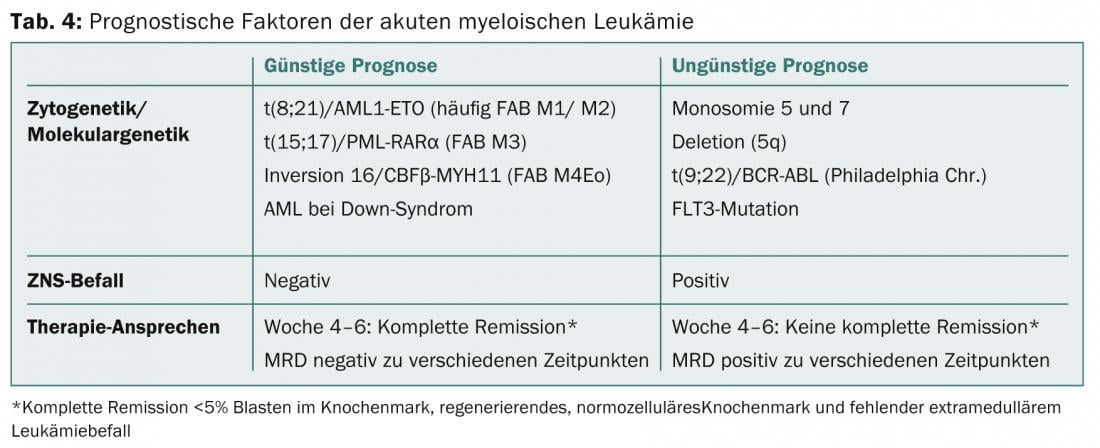
Lors du diagnostic d’une LAM, la détection des translocations t(8;21) et t(15;17) ou la détection d’une inversion 16 est synonyme de pronostic plus favorable, tandis que la détection d’une monosomie 5 ou 7 est associée à un mauvais pronostic (tableau 4) [1,4,5].
Thérapie
Comme nous l’avons déjà mentionné, le pronostic de la leucémie aiguë infantile s’est amélioré de manière impressionnante au cours des 40 dernières années. D’une part, le système nerveux central a été identifié comme un site de départ fréquent de la récidive et un traitement prophylactique du SNC a été initié. D’autre part, des protocoles de chimiothérapie complexes et adaptés aux risques ont été développés. En outre, le traitement de soutien s’est nettement amélioré, de sorte que la morbidité et la mortalité associées au traitement ont diminué [1].
Aujourd’hui, le traitement de la LAL de l’enfant consiste en une polychimiothérapie qui comprend, outre les stéroïdes, différents autres agents chimiothérapeutiques (méthotrexate, vincristine, asparaginase, cytarabine, cyclophosphamide, anthracyclines, 6-mercaptopurine). Un enfant dont la LAL vient d’être diagnostiquée commence par une chimiothérapie d’induction, qui consiste à administrer pendant cinq semaines une combinaison de cinq à six agents chimiothérapeutiques dont l’objectif est de minimiser la charge des cellules leucémiques à un niveau non détectable cliniquement et hématologiquement. L’induction est suivie d’une chimiothérapie de consolidation pour le traitement du compartiment extramédullaire (SNC et testicules). Elle consiste en l’administration intrathécale et systémique à haute dose de méthotrexate, qui vise à prévenir les récidives du SNC et remplace l’irradiation préventive du SNC qui était autrefois pratiquée en routine. La chimiothérapie de réinduction conclut alors la phase de traitement initial intensif après environ six mois. Une grande partie des phases de chimiothérapie intensive peut être réalisée en ambulatoire. Ensuite, une chimiothérapie d’entretien ambulatoire à base de 6-mercaptopurine et de méthotrexate est administrée pendant 18 mois supplémentaires.
La transplantation de cellules souches hématopoïétiques (TCSH) est utilisée chez les patients pédiatriques présentant un profil à haut risque (mauvaise réponse au traitement, génétique moléculaire de mauvais pronostic, récidive) et un donneur approprié. L’irradiation du SNC est indiquée en cas de détection initiale de cellules leucémiques dans le LCR [5].
Le paramètre pronostique le plus important dans le traitement de la leucémie infantile est la réponse au traitement. Une réduction des blastes dans le sang périphérique à <1000/µl après une semaine de traitement par stéroïdes (jour 8), une rémission hématologique complète avec <5% de blastes sur le frottis de moelle osseuse à la fin de l’induction (jour 33) et une valeur négative de MRD (“minimal residual disease” par PCR) au jour 33 et à la semaine 12 sont les plus forts prédicteurs d’une survie sans récidive (tableau 3) [5].
Le traitement de la LAM de l’enfant nécessite une polychimiothérapie très intensive composée de courts blocs de chimiothérapie avec des anthracyclines, de la cytarabine, de l’étoposide, de la 6-thioguanine et éventuellement de l’ATRA (“all-trans-retinoid acid”) [3]. La chimiothérapie commence par une induction, suivie d’une consolidation et d’une intensification, et se termine par une chimiothérapie d’entretien d’environ un an à base de 6-thioguanine et de cytarabine. De plus, un traitement extramédullaire par méthotrexate intrathécal, cytarabine et prednisone est administré à intervalles réguliers [6].
Selon l’état actuel des études internationales, on renonce aujourd’hui à une irradiation préventive du crâne [6,7]. Les patients qui se qualifient pour une TCSH sont ceux qui ont une cytogénétique défavorable, une mauvaise réponse au traitement ou une récidive [6].
Comme pour la LAL, la réponse au traitement est un facteur pronostique décisif pour la LAM. La rémission de la LAM est définie par<5% de blastes dans la moelle osseuse, une moelle osseuse normocellulaire en régénération et l’absence de preuve d’atteinte leucémique extramédullaire. Celle-ci est généralement atteinte après quatre à six semaines de traitement d’induction [4].
Complications
La myélotoxicité induite par la chimiothérapie, avec pancytopénie, est un effet secondaire important et fréquent du traitement de la leucémie. Elle entraîne, via une neutropénie, une tendance accrue aux infections avec fièvre en neutropénie, des infections bactériennes, fongiques et virales qui nécessitent souvent une hospitalisation. En outre, il existe un risque accru d’infections opportunistes (Pneumocystis jirovecii), raison pour laquelle une prophylaxie antibiotique par triméthoprime-sulfaméthoxazole est administrée. De plus, une anémie et une thrombocytopénie apparaissent, ce qui peut nécessiter des transfusions régulières. Outre la moelle osseuse, d’autres séries de cellules présentant un taux de division élevé sont également endommagées. En conséquence, on observe une mucosite buccale et gastro-intestinale due à l’atteinte des muqueuses et une alopécie due à l’atteinte des follicules pileux. Les nausées et les vomissements sont également des effets secondaires fréquents, qui sont généralement bien traités par des antiémétiques. En outre, il existe de nombreux effets secondaires spécifiques aux médicaments, mais ils sont plus rares.
Conséquences tardives
Avec l’augmentation du taux de survie des enfants atteints de leucémie aiguë, le nombre d’anciens patients atteints de cancer pédiatrique présentant des séquelles liées à la maladie et au traitement augmente également [1]. Il s’agit notamment de problèmes neurologiques, endocrinologiques, métaboliques et cardiaques, ainsi que de tumeurs secondaires.
Parmi les séquelles neurologiques, on compte les déficits neuropsychologiques, qui sont principalement la conséquence d’une irradiation du crâne. Il a été démontré que le remplacement d’une irradiation prophylactique du crâne par une chimiothérapie intrathécale entraînait une réduction des séquelles neuropsychologiques [8]. Les problèmes neuropsychologiques comprennent des difficultés en calcul, en mémoire verbale à court terme, dans les fonctions exécutives, l’attention et la concentration.
Les séquelles endocrinologiques et métaboliques affectent principalement les enfants ayant subi une irradiation crânienne et comprennent un déficit en hormone de croissance, un dysfonctionnement de la thyroïde, un retard de puberté ou pubertas praecox et un syndrome métabolique. Les troubles de la fertilité sont presque exclusivement observés chez les patients transplantés.
En raison des doses cumulées relativement élevées d’anthracycline, en particulier dans le traitement de la LAM, une cardiomyopathie dilatée peut survenir après des années ou des décennies en tant que conséquence cardiaque tardive.
L’irradiation du crâne augmente le risque de développer des tumeurs cérébrales secondaires bénignes et malignes (méningiomes, gliomes) ainsi que des adénomes ou des carcinomes thyroïdiens. Les patients ayant subi une chimiothérapie exclusive présentent un risque accru de syndrome myélodysplasique ou de LAM secondaire, expression d’une dégénérescence prémaligne ou maligne de la moelle osseuse induite par la chimiothérapie [1].
Dr. med. Christina Schindera
Littérature :
- Orkin S, et al : Leucémie lymphoblastique aiguë et leucémie myéloïde, myélodysplasie, et maladie myéloproliférative chez l’enfant. Oncology of Infancy and Childhood 2009 ; 297-402. Saunders Elevier.
- Kuehni C : Registre suisse du cancer de l’enfant, Rapport annuel 2011/2012. 2013 www.kinderkrebsregister.ch/fileadmin/KKR08/uploads/pdf/AnnualReport_SCCR_2011_2012_FINAL.pdf.
- Bailey S, Skinner R : Oxford Specialist Handbooks in Paediatrics : Paediatric Haematology and Oncology. 2010. Oxford Medical Publications, Oxford, Royaume-Uni.
- Creutzig U, Reinhardt D : Étude multicentrique d’optimisation du traitement AML-BFM 2004. 2010.
- Schrappe M, AIEOP-BFM ALL 2009 : International collaborative treatment protocol for children and adolescents with acute lymphoblastic leukemia. 2013.
- Creutzig U, Dworzak M, Reinhardt D : Leucémie myéloïde aiguë chez l’enfant. 2013. %C3%
- Pui CH, Howard SC : Gestion actuelle et défis des maladies malignes du SNC dans la leucémie pédiatrique. Lancet Oncol 2008 ; 9(3) : 257-268.
- Von der Weid N, et al : Résultat intellectuel chez les enfants et adolescents atteints de leucémie lymphoblastique aiguë traitée par chimiothérapie seule : différences liées à l’âge et au sexe. Eur J Cancer 2003 ; 39(3) : 359-365.
InFo Oncologie & Hématologie 2014 ; 2(5) : 4-7