Le diabète sucré progressif de type 2 se caractérise par une diminution continue de la sécrétion d’insuline endogène. L’insuline reste un antidiabétique éprouvé et très efficace. Le choix de l’insulinothérapie est guidé par différents facteurs tels que le stade du diabète, le contrôle métabolique et les ressources du patient. Initialement, la grande majorité des diabétiques de type 2 peuvent être traités par une insulinothérapie basale. Elle présente le plus faible risque d’hypoglycémie et de prise de poids par rapport aux autres régimes d’insuline (insulinothérapie prandiale, insulinothérapie mixte). Dans la pratique clinique quotidienne, la combinaison d’insuline et d’analogues du GLP 1 s’impose de plus en plus.
Du point de vue pathogénique, le diabète sucré de type 2 se caractérise par une résistance à l’insuline et une restriction progressive de la sécrétion d’insuline. En conséquence, on trouve typiquement des taux élevés de glycémie à jeun et des pics de glycémie postprandiale. Pour maintenir un contrôle métabolique adéquat, la plupart des patients ont donc besoin d’une insulinothérapie au cours de leur maladie. Le traitement à l’insuline est encore souvent commencé ou envisagé trop tard. Les raisons sont multiples et comprennent, outre la peur des effets secondaires (prise de poids, hypoglycémie), de nombreux autres facteurs (par exemple, inhibition avant l’auto-injection, peur de nuire à la qualité de vie, etc.) [1,2].
D’un point de vue purement thérapeutique, l’insuline présente de nombreux avantages : L’insuline est l’antidiabétique le plus efficace sur le plan thérapeutique, elle est facile à contrôler, n’a pas de potentiel d’interaction pertinent avec d’autres médicaments, n’est pas contre-indiquée même en cas d’insuffisance cardiaque, rénale ou hépatique très sévère et a en outre un effet positif sur les lipides plasmatiques [3]. Les effets secondaires tels que l’hypoglycémie et la prise de poids peuvent souvent être bien contrôlés ou largement évités grâce à une formation adéquate et à l’adaptation de la dose ou au choix du régime thérapeutique approprié (par exemple, association avec des agonistes des récepteurs du GLP 1). L’insulinothérapie moderne reste donc une option thérapeutique très efficace et moderne dans le concept de traitement multimodal des diabétiques de type 2.
Le présent article a pour but de fournir un aperçu actuel et pratique de l’insulinothérapie chez les personnes atteintes de diabète sucré de type 2.
Valeurs cibles de l’HbA1c et algorithmes thérapeutiques
La détermination de la plage cible d’HbA1c est effectuée individuellement pour chaque patient. Plusieurs facteurs sont pris en compte, tels que l’âge ou l’espérance de vie, les comorbidités et le risque d’hypoglycémie [4]. L’importance d’un bon contrôle métabolique dans le développement et la progression des maladies microvasculaires secondaires telles que la rétinopathie diabétique ou la néphropathie n’est plus à démontrer. En revanche, l’influence d’un bon contrôle glycémique sur les complications macrovasculaires n’a pas encore été définitivement établie. Certes, l’étude UKPDS a montré un certain avantage d’un contrôle précoce et de qualité de la glycémie sur les résultats cardiovasculaires après plusieurs années [5]. Cependant, dans les études suivantes (ADVANCE, ACCORD, VADT), menées principalement chez des patients souffrant de diabète de longue durée, le contrôle intensif de la glycémie visant à atteindre des taux d’HbA1c inférieurs à 7% n’a pas permis de réduire la mortalité cardiovasculaire [6–8]. En général, la plupart des sociétés savantes indiquent une HbA1c autour ou en dessous de 7%, mais avec une option de valeurs cibles d’HbA1c plus élevées (par ex. patients âgés avec comorbidités) ou plus basses (par ex. patients plus jeunes avec une courte durée de diabète et un faible risque d’hypoglycémie).
Dans les recommandations actuelles de l’ADA/EASD sur le traitement de l’hyperglycémie chez les patients atteints de diabète de type 2, le traitement par insuline de base est considéré comme l’option thérapeutique ayant le plus grand potentiel thérapeutique, au même niveau que les antidiabétiques oraux. Étant donné que l’insulinothérapie a des effets secondaires potentiels, mais qu’elle implique également un effort en termes d’éducation et d’administration de médicaments, il est judicieux, dans la pratique, d’évaluer l’indication d’une insulinothérapie par rapport aux autres possibilités de traitement antidiabétique en tenant compte de la puissance d’action et des effets secondaires.
Indications de l’insulinothérapie
Outre les indications métaboliquement dépendantes (détérioration du contrôle métabolique sous double ou triple association avec des antidiabétiques oraux avec augmentation de l’HbA1c-), il existe un certain nombre de situations indépendantes du métabolisme dans lesquelles l’insulinothérapie a un sens. (tableau 1). Souvent, en situation aiguë d’hyperglycémie marquée (“glucotoxicité”), outre les symptômes correspondants de polyurie et de polydipsie, on observe une sorte de “rigidité sécrétoire” de la sécrétion d’insuline et une diminution de l’action de l’insuline. Dans ce cas, l’insulinothérapie – qui n’est souvent nécessaire que temporairement – aide à réduire rapidement et efficacement la glycémie afin d’améliorer à nouveau la fonction des cellules bêta et la résistance à l’insuline. En outre, il a été démontré que chez les patients dont le diabète sucré de type 2 venait d’être diagnostiqué, l’insulinothérapie précoce et intensive (par rapport aux antidiabétiques oraux) permettait une bien meilleure récupération de la fonction des cellules bêta et une rémission glycémique plus longue [9]. Chez une proportion considérable de patients, le diabète sucré de type 1 ne se manifeste qu’après l’âge de 35 ans [10], et jusqu’à 14% de tous les patients qui se présentent phénotypiquement comme des diabétiques de type 2 ont des auto-anticorps anti-cellules d’îlots de Langerhans détectables comme expression d’une pathogenèse auto-immune du diabète [11]. S’il existe donc des indices d’une carence absolue en insuline ou d’un diabète sucré de type 1, l’instauration d’une insulinothérapie est également indiquée dans cette situation.

Les différents types d’insuline
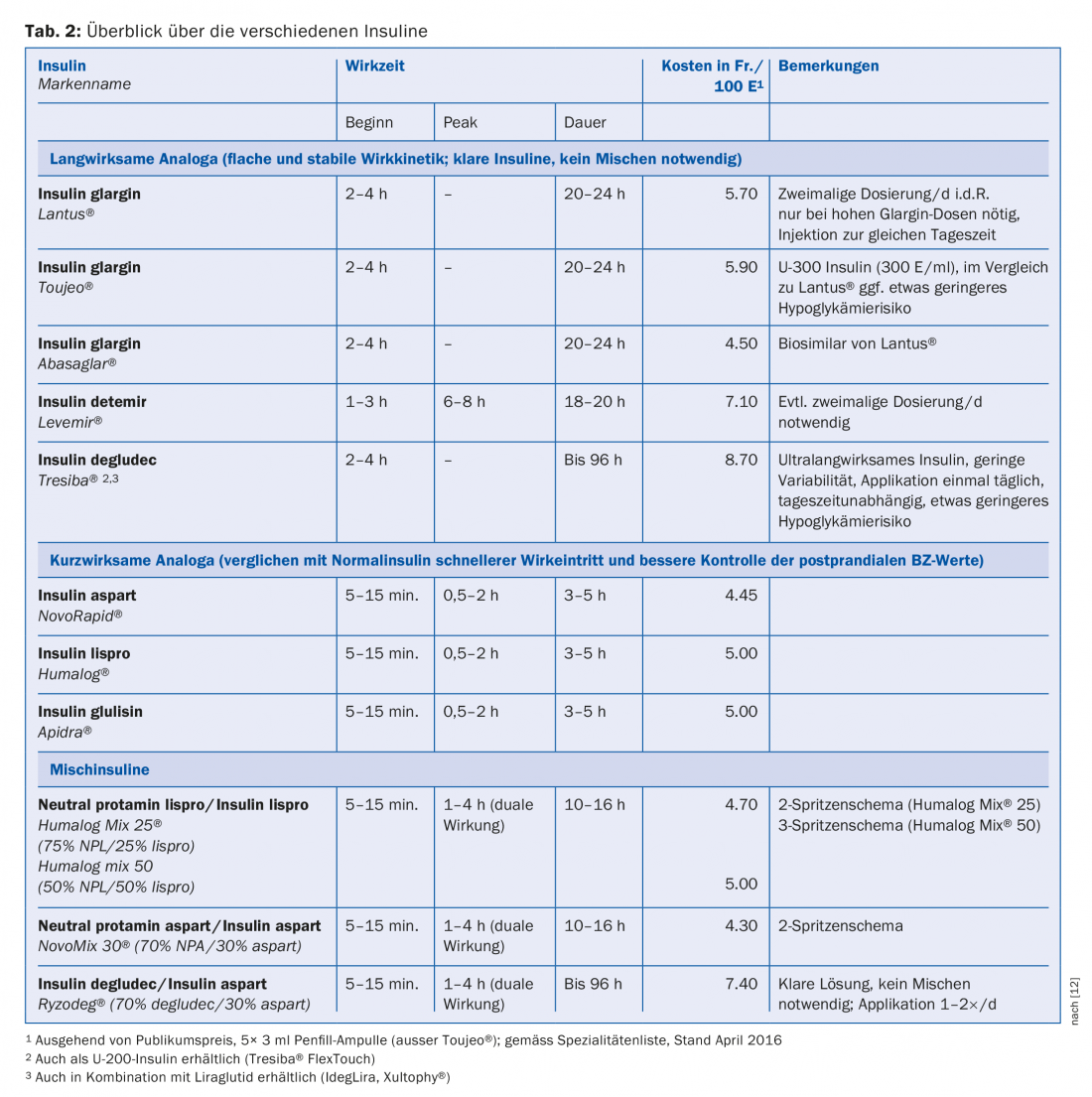
En fonction de leur durée d’action, les insulines sont divisées en insulines à action rapide (prandiales), insulines à action prolongée (basales) et insulines mixtes [12]. En comparaison directe, il n’y a pas de différence entre les analogues de l’insuline et les insulines normales ou NPH en termes de réduction de l’HbA1c. Cependant, dans la vie quotidienne et en raison d’aspects pratiques (application, intervalle plus court entre l’injection et le repas, meilleur contrôle des glycémies postprandiales, risque d’hypoglycémie plus faible), les analogues de l’insuline se sont imposés aussi bien pour le traitement basal que pour le traitement prandial. Les analogues se distinguent de l’insuline humaine par une structure moléculaire modifiée. Le remplacement de certains acides aminés ou l’ajout d’acides gras modifient les propriétés pharmacodynamiques et cinétiques telles que la durée d’action ou le début d’action. Le tableau 2 présente une vue d’ensemble des analogues de l’insuline (y compris les insulines mixtes) couramment utilisés aujourd’hui.
Généralités sur la mise en œuvre pratique de l’insulinothérapie
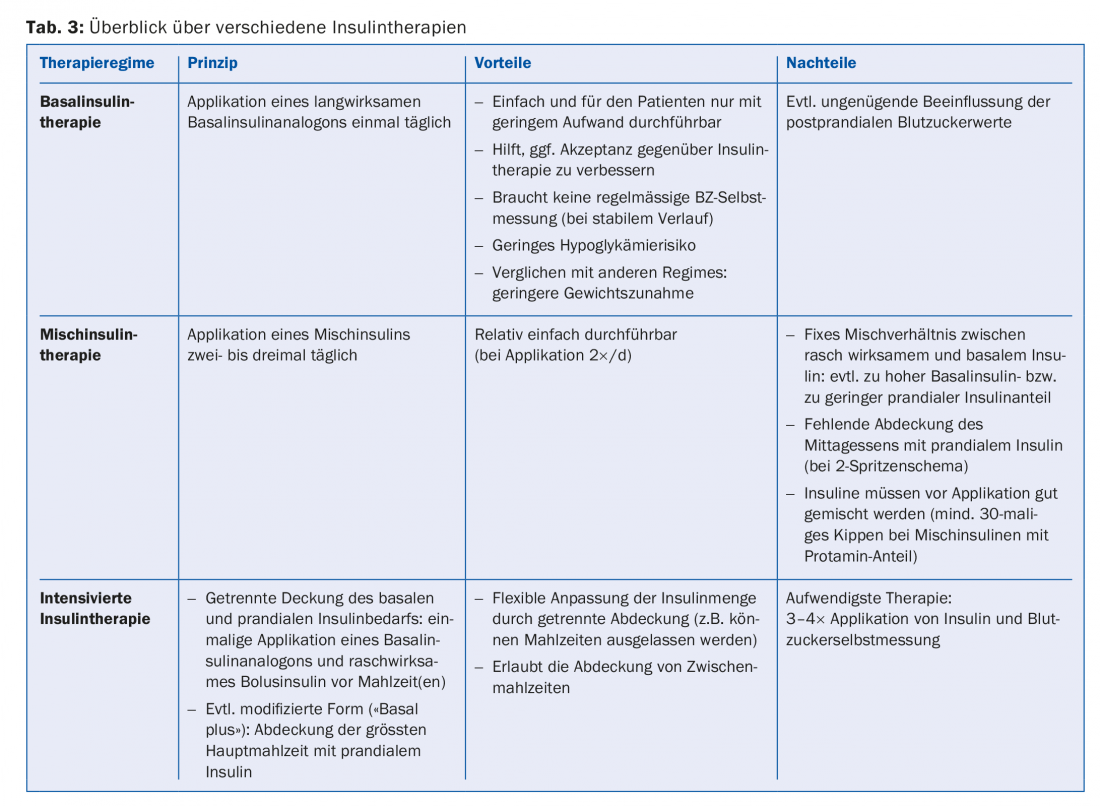
L’insulinothérapie idéale normalise les glycémies pré- et postprandiales sans provoquer d’hypoglycémies ni de prise de poids. Les régimes d’insuline connus (tableau 3) se distinguent par leur complexité et leur coût pour le patient.
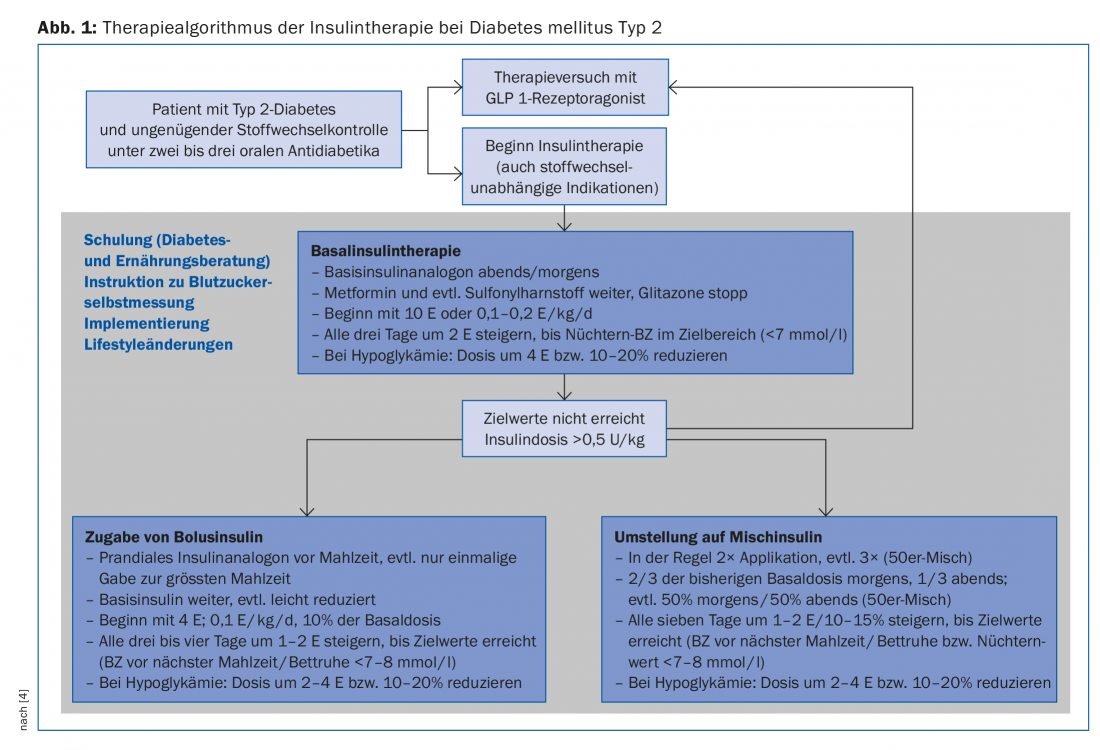
Dans un premier temps, on optera donc généralement pour une insulinothérapie basale, qui ne sera intensifiée que si les valeurs cibles ne sont pas atteintes ou si l’insulinothérapie se détériore à nouveau (figure 1).
La motivation ou l’adhésion au traitement pour les traitements injectables contre le diabète est essentielle pour la réussite du traitement. L’insulinothérapie implique souvent un changement radical du concept de traitement pour le patient ; le traitement doit s’adapter aux ressources propres au patient et nécessite un effort d’éducation considérable de la part d’une équipe interdisciplinaire.
Les effets secondaires peuvent détériorer considérablement l’adhérence et doivent être évités autant que possible dès le début et discutés avec le patient avant même le début du traitement. Le risque d’hypoglycémie peut être réduit de manière décisive par l’adaptation de la dose et l’éducation (par exemple, prévention des situations à risque, réduction de la dose d’insuline après un effort physique, titration lente de la dose). La prise de poids reflète d’une part l’amélioration du contrôle métabolique (glucosurie réduite), mais peut également avoir d’autres causes, comme la prise de collations entre les repas pour prévenir les hypoglycémies. Dans la pratique clinique quotidienne, cet effet secondaire est probablement l’une des raisons les plus fréquentes d’échec de l’insulinothérapie ou l’un des principaux facteurs de refus ou de début tardif de l’insulinothérapie. Les thérapies combinées avec des traitements antidiabétiques plus récents peuvent – en plus de souligner l’importance des mesures de changement de style de vie dans cette situation – avoir un effet de soutien supplémentaire.
Thérapie à l’insuline basale
Le traitement de loin le plus simple à mettre en œuvre est l’insulinothérapie basale (figure 2), qui est un traitement complémentaire au traitement existant par antidiabétiques oraux. Les antidiabétiques oraux, à l’exception des glitazones, sont généralement relayés, en particulier l’association avec la metformine a un effet d’épargne insulinique [13]. Les sulfonylurées aident à contrôler la glycémie postprandiale, mais elles peuvent augmenter le risque d’hypoglycémie lorsqu’elles sont associées à l’insuline. En outre, ils deviennent de moins en moins efficaces au fur et à mesure que la durée du diabète augmente et que la fonction des cellules bêta diminue.
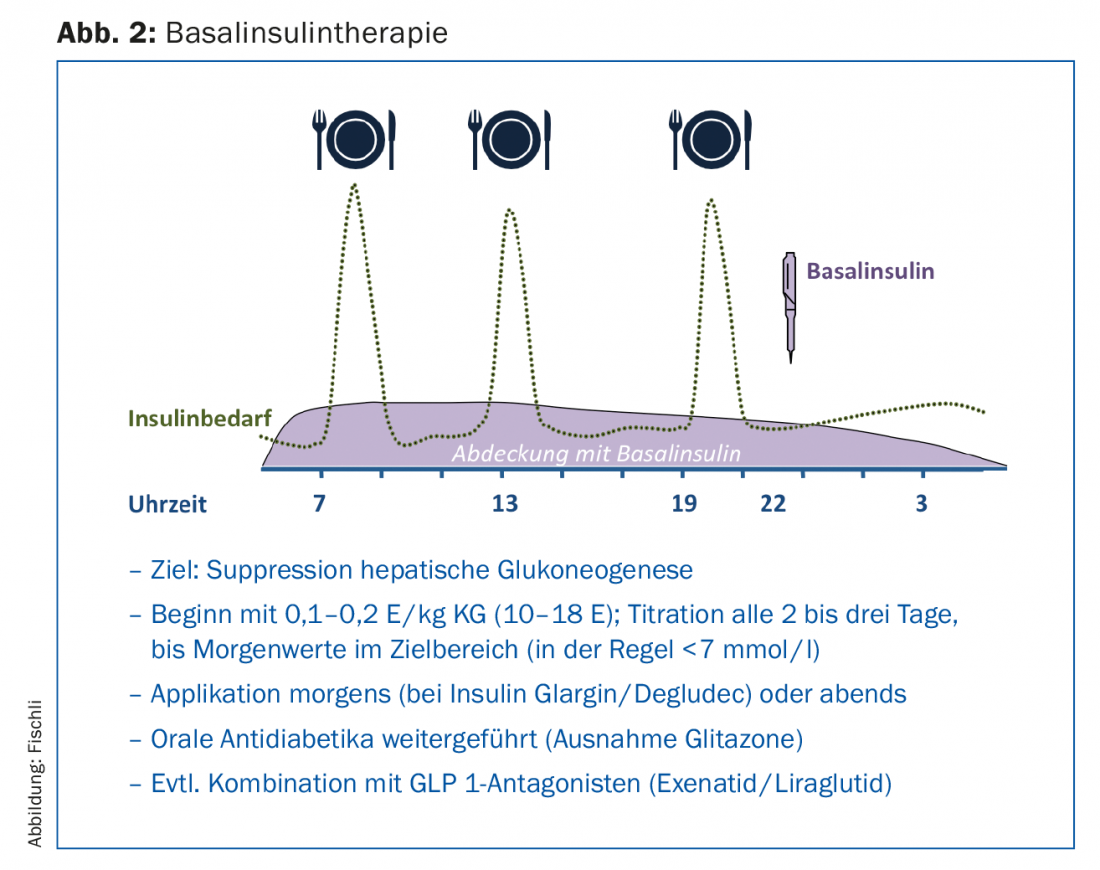
L’administration d’un analogue de l’insuline basale à longue durée d’action inhibe en premier lieu la gluconéogenèse hépatique et réduit ainsi les taux élevés de glycémie à jeun ainsi que les taux en phase post-absorptive. Lorsque le taux d’HbA1c est supérieur à 8,5%, ce sont surtout les taux élevés de glycémie à jeun qui influencent le métabolisme [14], c’est pourquoi l’insulinothérapie basale améliore de manière décisive le contrôle de la glycémie dans ces situations également. Dans les études, la glargine [15] ou l’insuline detemir [16] en combinaison avec la metformine ont permis d’obtenir un taux d’HbA1c inférieur à 7% chez environ deux tiers des patients. En ce qui concerne le dosage, il convient de noter que l’insuline est augmentée progressivement jusqu’à ce que les valeurs cibles soient atteintes (stratégie “treat to target”). Cette augmentation peut être effectuée par le patient lui-même s’il est bien formé (Fig. 1).
L’insulinothérapie de base présente les avantages d’une prise de poids réduite et d’un risque d’hypoglycémie minimal par rapport à l’insulinothérapie prandiale ou mixte [17]. Ce dernier point est particulièrement crucial pour les conducteurs de véhicules à moteur. En 2015, un groupe de travail interdisciplinaire a révisé les directives concernant l’aptitude à la conduite et la capacité de conduire en cas de diabète sucré [18]. Les personnes sans facteurs de risque (c’est-à-dire sans trouble de la perception de l’hypoglycémie ni antécédents d’hypoglycémie sévère) et traitées exclusivement par un analogue de l’insuline basale (par ex. insuline glargine ou detemir) présentent un risque d’hypoglycémie globalement faible, raison pour laquelle il n’est désormais plus nécessaire de mesurer systématiquement la glycémie avant chaque trajet en voiture.
Association avec d’autres antidiabétiques
L’association de l’insulinothérapie avec les inhibiteurs de la DPP IV ou les agonistes des récepteurs du GLP 1 est possible et présente plusieurs avantages [19]. L’association d’insuline et d’un analogue du GLP 1 est de plus en plus répandue. La séquence, c’est-à-dire la classe de substances qui est donnée en premier, n’a pas vraiment d’importance. L’administration de l’insuline basale peut être commencée en premier, ou l’insuline peut être associée à des agonistes des récepteurs GLP 1 en tant que traitement d’appoint.
Sur le plan pharmacologique, les deux substances agissent par différents mécanismes pour faire baisser la glycémie et agissent en synergie [20]. Cependant, l’influence de l’agoniste du récepteur GLP 1 sur la régulation centrale de l’appétit et de la satiété contribue à prévenir la prise de poids sous insulinothérapie. De plus en plus de données démontrent désormais l’intérêt d’un tel traitement combiné en termes d’évolution du poids, de contrôle métabolique et de risque d’hypoglycémie [21].
En Suisse, l’exénatide (Byetta®) et le liraglutide (Victoza®) sont autorisés en association avec l’insuline de base. Le liraglutide est également disponible en association fixe avec l’insuline dégludec (Xultophy®). Le dulaglutide (Trulicity®), plus récent et administré une fois par semaine, est autorisé en association avec l’insuline prandiale. Le dernier groupe d’antidiabétiques, les inhibiteurs de SGLT 2, a également un effet d’économie d’insuline ou de réduction du poids en combinaison avec l’insuline [22].
Intensification de l’insulinothérapie
Une intensification ou une modification de l’insulinothérapie doit être envisagée si le contrôle métabolique continue de se détériorer ou si des effets secondaires (hypoglycémies, prise de poids) compliquent le traitement (Fig. 1). Avant d’ajouter une insuline prandiale ou de passer à une insuline mixte, il vaut la peine d’essayer un agoniste du récepteur GLP 1 en combinaison avec l’insuline de base.
L’intensification de l’insulinothérapie se fait soit par l’ajout d’un analogue de l’insuline à action rapide avant le repas comme régime de bolus de base classique, soit par le passage à une insulinothérapie mixte. Cette dernière présente toutefois quelques inconvénients (tab. 3) et, en comparaison directe avec l’insuline de base en bolus, les insulines mixtes obtiennent de moins bons résultats en termes de contrôle métabolique [23].
Littérature :
- Polonsky WH, et al. : Résistance psychologique à l’insuline chez les patients atteints de diabète de type 2 : l’étendue du problème. Diabetes Care 2005 ; 28(10) : 2543-2545.
- Nakar S, et al : Transition vers l’insuline dans le diabète de type 2 : la méconnaissance par les médecins de famille des craintes des patients contribue aux barrières existantes. J Diabetes Complications 2007 ; 21(4) : 220-226.
- Romano G, et al. : Insuline et traitement par sulfonylurées chez les patients atteints de NIDDM. Les effets sur le métabolisme des lipoprotéines sont-ils différents, même avec un contrôle du glucose sanguin similaire ? Diabète 1997 ; 46(10) : 1601-1606.
- Inzucchi SE, et al : Management of hyperglycemia in type 2 diabetes, 2015 : a patient-centered approach : update to a position statement of the American Diabetes Association and the European Association for the Study of Diabetes. Diabetes Care 2015 ; 38(1) : 140-149.
- Holman RR, et al : 10-year follow-up of intensive glucose control in type 2 diabetes. N Engl J Med 2008 ; 359(15) : 1577-1589.
- Gerstein HC, et al : Effects of intensive glucose lowering in type 2 diabetes. N Engl J Med 2008 ; 358(24) : 2545-2559.
- Patel A, et al : Intensive blood glucose control and vascular outcomes in patients with type 2 diabetes. N Engl J Med 2008 ; 358(24) : 2560-2572.
- Duckworth W, et al : Glucose control and vascular complications in veterans with type 2 diabetes. N Engl J Med 2009 ; 360(2) : 129-139.
- Weng J, et al : Effet de l’insulinothérapie intensive sur la fonction des cellules bêta et le contrôle glycémique chez les patients atteints de diabète de type 2 nouvellement diagnostiqué : un essai multicentrique randomisé en groupes parallèles. Lancet 2008 ; 371(9626) : 1753-1760.
- Harris MI, Robbins DC : Prevalence of adult-onset IDDM in the U.S. population. Diabetes Care 1994 ; 17(11) : 1337-1340.
- Laugesen E, et al : Diabète auto-immun latent de l’adulte : connaissances actuelles et incertitudes. Diabet Med J Br Diabet Assoc 2015 ; 32(7) : 843-852.
- Wallia A, Molitch ME : Insulin therapy for type 2 diabetes mellitus. JAMA 2014 ; 311(22) : 2315-2325.
- Hemmingsen B, et al : Comparaison de la metformine et de l’insuline versus l’insuline seule pour le diabète de type 2 : revue systématique des essais cliniques randomisés avec méta-analyses et analyses séquentielles des essais. BMJ 2012 ; 344 : e1771.
- Monnier L, et al : Contributions des augmentations du glucose plasmatique à jeun et postprandial à l’hyperglycémie diurne globale des patients diabétiques de type 2 Variations avec des niveaux croissants d’HbA1c. Diabetes Care 2003 ; 26(3) : 881-885.
- Riddle MC, et al : The treat-to-target trial : randomized addition of glargine or human NPH insulin to oral therapy of type 2 diabetic patients. Diabetes Care 2003 ; 26(11) : 3080-3086.
- Hermansen K, et al. : A 26-week, randomized, parallel, treat-to-target trial comparing insulin detemir with NPH insulin as add-on therapy to oral glucose-lowering drugs in insulin-naive people with type 2 diabetes. Diabetes Care 2006 ; 29(6) : 1269-1274.
- Holman RR, et al : Three-year efficacy of complex insulin regimes in type 2 diabetes. N Engl J Med 2009 ; 361(18) : 1736-1747.
- http://sgedssed.ch/fileadmin/files/6_empfehlungen_fachpersonen/61_richtlinien_fachaerzte/Neue-Auto-Richtlinien_SGED_15-11-24_DE-DEFkorr.pdf
- Yki-Järvinen H, et al : Effets de l’ajout de linagliptine aux régimes d’insuline basale pour les diabètes de type 2 insuffisamment contrôlés. Diabetes Care 2013 ; 36(12) : 3875-3881.
- Del Prato S : Combinaison à taux fixe d’insuline basale et d’agoniste du récepteur GLP-1 : deux valent-ils mieux qu’un ? Lancet Diabetes Endocrinol 2014 ; 2(11) : 856-858.
- Eng C, et al : Glucagon-like peptide-1 receptor agonist and basal insulin combination treatment for the management of type 2 diabetes : a systematic review and meta-analysis. Lancet 2014 ; 384(9961) : 2228-2234.
- Nauck MA : Update on developments with SGLT2 inhibitors in the management of type 2 diabetes. Drug Des Devel Ther 2014 ; 8 : 1335-1380.
- Giugliano D, et al. : Efficacité des analogues de l’insuline pour atteindre l’objectif d’hémoglobineA1c de <7% dans le diabète de type 2 : méta-analyse des essais contrôlés randomisés. Diabetes Care 2011 ; 34(2) : 510-517.
PRATIQUE DU MÉDECIN DE FAMILLE 2016 ; 11(5) : 8-14