Le taux plasmatique de lévodopa, la référence absolue en matière de traitement de la maladie de Parkinson, est optimisé en utilisant simultanément un inhibiteur de la catéchol-O-méthyltransférase, comme l’opicapone (Ongentys®), et un inhibiteur de la dopa-décarboxylase. Des études ont montré que cela améliorait aussi bien les fluctuations motrices que non motrices. À l’appui de cas pratiques, il a en outre été démontré lors du symposium de Bial en marge du Congrès de l’Académie européenne de neurologie (EAN) combien l’administration d’opicapone au quotidien pouvait contribuer à mieux adapter le traitement aux besoins des personnes concernées.
«La lévodopa est la référence absolue en matière de traitement médicamenteux de la maladie de Parkinson», a indiqué le Prof. Angelo Antonini (Padoue/I) en préambule du symposium. L’efficacité et la tolérance favorables de la lévodopa sont bien documentées par des études randomisées et des décennies d’utilisation clinique1, 2. «Toutefois, des variations des taux plasmatiques de lévodopa entraînent des complications au cours de la maladie, qui se manifestent par des fluctuations motrices et des dyskinésies», a-t-il expliqué. La principale cause de ces complications tiendrait à la dégénérescence croissante des neurones dopaminergiques, qui fait chuter la capacité de stockage de la dopamine. Le Prof. Antonini a néanmoins aussi indiqué que la lévodopa présentait quelques inconvénients, malgré sa grande importance. «Il s’agit notamment de sa courte demi-vie de 1,4 à 1,6 heure seulement.» Par ailleurs, les deux enzymes (la dopa-décarboxylase [DDC] et la catéchol-O-méthyltransférase [COMT]) réduisent la quantité de lévodopa dans le système périphérique, avant même qu’elle n’atteigne la barrière hémato-encéphalique3. «Pour cette raison, nous utilisons également un inhibiteur de DCC en association avec la lévodopa depuis de nombreuses années», a précisé l’intervenant. Dans ces conditions, la lévodopa arrive toutefois en bien plus grande quantité dans la voie de dégradation de la COMT, ce qui augmente les taux plasmatiques et cérébraux de 3-O-méthyldopa (3-OMD)3 -5. Cependant, la 3-OMD inhibe potentiellement le transport de la lévodopa à travers la barrière hémato-encéphalique de manière compétitive et ne peut plus être elle-même métabolisée en dopamine6, 7. «Optimiser la biodisponibilité et la pulsatilité du taux de lévodopa dans le sang et, indirectement, dans le cerveau, en inhibant aussi la COMT, avec de l’opicapone, par exemple, représente donc une stratégie de traitement importante», selon le Prof. Antonini5, 8.
De meilleurs résultats et un traitement simplifié
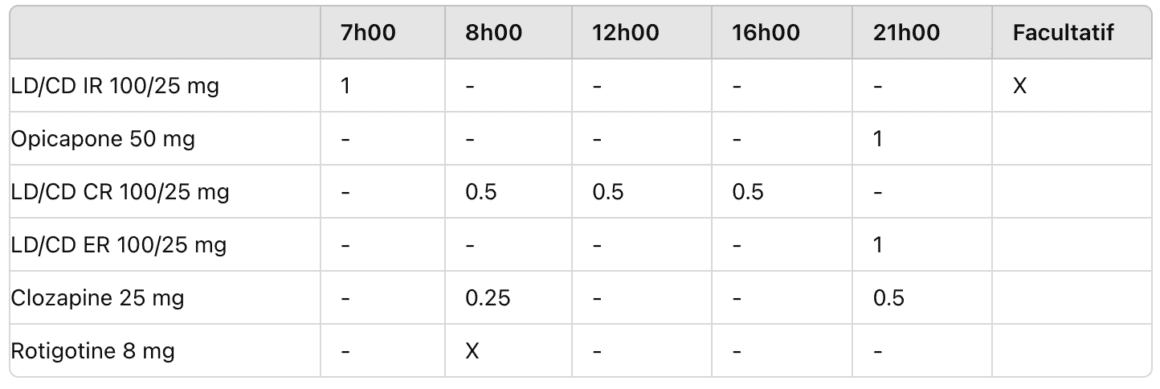
Le Prof. Lars Tönges (Bochum/A) a présenté le cas d’un homme de 63 ans à qui l’on avait diagnostiqué la maladie de Parkinson à l’âge de 59 ans et qui était traité par lévodopa/inhibiteur de DDC (3 fois par jours) et inhibiteur de monoamine oxydase (MAO) B. «Actuellement, il se plaint d’un léger wearing-off avec hypokinésie», selon le Prof. Tönges. «Pour améliorer la situation, nous pouvons envisager plusieurs options, notamment l’augmentation de la dose de lévodopa ou l’administration supplémentaire d’un inhibiteur de COMT, comme l’opicapone», a-t-il ajouté, expliquant que sa décision d’utiliser l’opicapone reposait sur les résultats de l’étude ADOPTION. Cette étude de phase IV randomisée, prospective, menée auprès de personnes atteintes de la maladie de Parkinson présentant leurs premières fluctuations motrices avait démontré que l’administration supplémentaire de 50 mg d’a par jour entraînait une réduction significative du temps OFF de 45 minutes et une augmentation significative du temps ON de près de 35 minutes par rapport à la stratégie courante, qui consiste à augmenter la dose de lévodopa de 100 mg9. De plus, l’administration d’opicapone produisait une amélioration numérique de la qualité de vie, établie à l’aide du questionnaire sur la maladie de Parkinson PDQ-8 (Parkinson’s Disease Questionnaire 8). Le traitement s’est également avéré bien toléré. Par rapport à l’augmentation de la lévodopa de 100 mg, le groupe Opicapone a certes présenté légèrement plus d’effets indésirables dopaminergiques, comme des vertiges ou une dyskinésie, mais le faible taux d’interruption du traitement était comparable dans les deux groupes6. Cela signifie que les avantages liés à l’utilisation de l’opicapone au début des fluctuations motrices semblaient prévaloir pour les patients. En se basant sur l’exemple d’une patiente malade depuis dix ans et présentant des fluctuations motrices, le Prof. Tönges a ensuite montré combien l’opicapone simplifiait le traitement médicamenteux, ce qui correspondait également au souhait de la patiente [ENCADRÉ 1 et ENCADRÉ 2]. Il a en outre émis la suggestion suivante: «Simplifiez au maximum le traitement, avec le moins de médicaments et le moins de prises possible.»
[ENCADRÉ 1] Plan de traitement avant le changement

[ENCADRÉ 2] Plan de traitement après l’intégration de 50 mg d’opicapone/jour
L’opicapone améliore les fluctuations non motrices
Lors de son intervention, le Dr Raúl Martínez Fernández (Madrid/E) s’est penché sur les fluctuations non motrices. «Presque tous les patients atteints de la maladie de Parkinson rapportent au moins un symptôme non moteur, notamment des troubles du sommeil fréquents, et des symptômes neuropsychiatriques», a-t-il précisé. Les fluctuations non motrices représentent une cause majeure de dégradation de la qualité de vie10. «La physiopathologie de ces symptômes est à la fois complexe et hétérogène. Le plus souvent, leur survenue est directement ou indirectement liée aux variations de la stimulation dopaminergique», a expliqué l’intervenant, précisant ensuite les principales étapes de prise en charge de ces fluctuations: «Tout d’abord, assurez-vous que les symptômes ne correspondent pas à un effet indésirable du traitement médicamenteux actuel.» Dans un deuxième temps, il a recommandé d’assurer une stimulation dopaminergique continue en optimisant le plan de traitement. «Pour ce faire, on peut utiliser l’opicapone», selon le Dr Martínez Fernández. Il a indiqué que, dans l’étude OPTIPARK menée en conditions réelles, l’administration d’opicapone améliorait non seulement les fluctuations motrices, mais entraînait aussi une amélioration significative des symptômes non moteurs par rapport à la valeur de référence (-6,8 points sur l’échelle NMSS [Non-motor Symptom Scale], p < 0,0001)11. Une analyse post hoc des études BIPARK-I et II ainsi que de l’étude OASIS (OpicApone in Sleep dISorders) a en outre démontré un effet positif de l’opicapone sur les troubles du sommeil12, 13. Après un traitement de 6 semaines par opicapone dans le cadre de l’étude OASIS, le score PDSS (Parkinson’s Disease Sleep Scale) 2 s’est amélioré de 7,9 points par rapport à la valeur de référence. «Une amélioration de 3,44 points est considérée comme une différence cliniquement pertinente minimale. Or, l’opicapone a permis d’atteindre plus du double», a souligné le Dr Martínez Fernández. «Pour moi, une optimisation de la stimulation dopaminergique continue à l’aide d’opicapone constitue la clé du traitement des fluctuations motrices et non motrices, y compris le sommeil», a-t-il conclu.
Messages à retenir
- La lévodopa représente toujours la référence absolue en matière de traitement de la maladie de Parkinson.
- Outre les fluctuations motrices, des complications non motrices, comme les troubles du sommeil, par exemple, peuvent se développer au cours de la maladie. Celles-ci nuisent considérablement à la qualité de vie des personnes concernées10.
- L’optimisation de la biodisponibilité et de la pulsatilité périphérique du taux de lévodopa en administrant l’inhibiteur de COMT opicapone a entraîné une amélioration des fluctuations motrices (plus de temps ON, moins de temps OFF) dans l’étude ADOPTION3- 6, 8.
- Des études ont montré que l’administration d’opicapone dans le cadre du traitement par lévodopa/inhibiteur de DCC permettait également d’améliorer les symptômes non moteurs, notamment les troubles du sommeil11-13.
Bibliographie
- Poewe W, et al.: Levodopa in the treatment of Parkinson’s disease: an old drug still going strong. Clin Interv Aging 2010; 5: 229-238.
- Goetz C, et al.: Management of Parkinson’s disease: an evidence-based review Mov Disord 2002; 17 (suppl 4): S1-166.
- Jenner P, et al.: Redefining the strategy for the use of COMT inhibitors in Parkinson’s disease: the role of opicapone. Exp Rev Neurother 2021; 21: 1019-1033.
- Loewen G, et al.: Pharmacokinetics of opicapone and effect on COMT and levodopa pharmacokinetics in patients with Parkinson’s disease. J Mov Disord 2019; 34: S7.
- Ferreira JJ, et al.: Effect of opicapone on levodopa pharmacokinetics in patients with fluctuating Parkinson’s disease. Mov Disord 2022; 37: 2272-2283.
- Lee ES, et al.: The role of 3-O-methyldopa in the side effects of L-dopa. Neurochem Res 2008; 33: 401-411.
- Duncan, GW, et al.: Health-related quality of life in early Parkinson’s disease: the impact of non-motor symptoms. Mov Disord 2014; 29: 195-202.
- Gershanik OS: Improving L-dopa therapy: the development of enzyme inhibitors. Mov Disord 2015; 30: 103-113.
- LeWitt P, et al.: Opicapone pharmacokinetics and effects on catechol- o -methyltransferase activity and levodopa pharmacokinetics in patients with Parkinson disease receiving carbidopa / levodopa. Clin Neuropharmacol 2023; 46: 43-50.
- Lee JY, et al.: Opicapone to treat early wearing-off in Parkinson’s disease patients: the Korean ADOPTION trial. Mov Disord Clin Pract 2024; 11: 655-665.
- Reichmann H, et al.: Effectiveness and safety of Opicapone in Parkinson’s disease patients with motor fluctuations: the OPTIPARK open-label study. Transl Neurodegener 2020; 9: 9.
- Hauser RA, et al.: OFF-times before, during, and after nighttime sleep periods in Parkinson’s disease patients with motor fluctuations and the effects of Opicapone: A post hoc analysis of diary data from BIPARK-1 and -2. Park Relat Disord 2024; 123: 106971.
- Ferreira JJ, et al.: Opicapone effect on sleep disorders in fluctuating Parkinson’s disease patients: findings from the OASIS trial. Poster présenté au Congrès mondial sur la maladie de Parkinson et les troubles connexes, Lisbonne / Portugal, du 19 au 21 mai 2024.
Mentions légales
Cet article a été financé par Bial S.A., Nyon.
Rapport: Dr Therese Schwender
Rédaction: Séverine Bonini
Source: Symposium satellite «Unlocking levodopa’s potential in Parkinson’s: optimisation through COMT inhibition», 10è Congrès de l’Académie européenne de neurologie (EAN), Helsinki / virtuel, 30 juin 2024. Organisateur: Bial S.A., Nyon.
Information abrégée d’Ongentys®
ON/JUL24/CH/202
Première publication parue dans l’EAN Special 2024, BrainMag 2024; 4: 80-81. © medEdition Verlag GmbH, Hirzel 2024