Les myopathies inflammatoires peuvent être idiopathiques ou induites par des agents pathogènes. On les trouve également en accompagnement des collagénoses, des granulomatoses ainsi que des syndromes malins et paranéoplasiques. Le diagnostic par imagerie se fait principalement par IRM, de même que les contrôles de l’évolution pendant ou après le traitement.
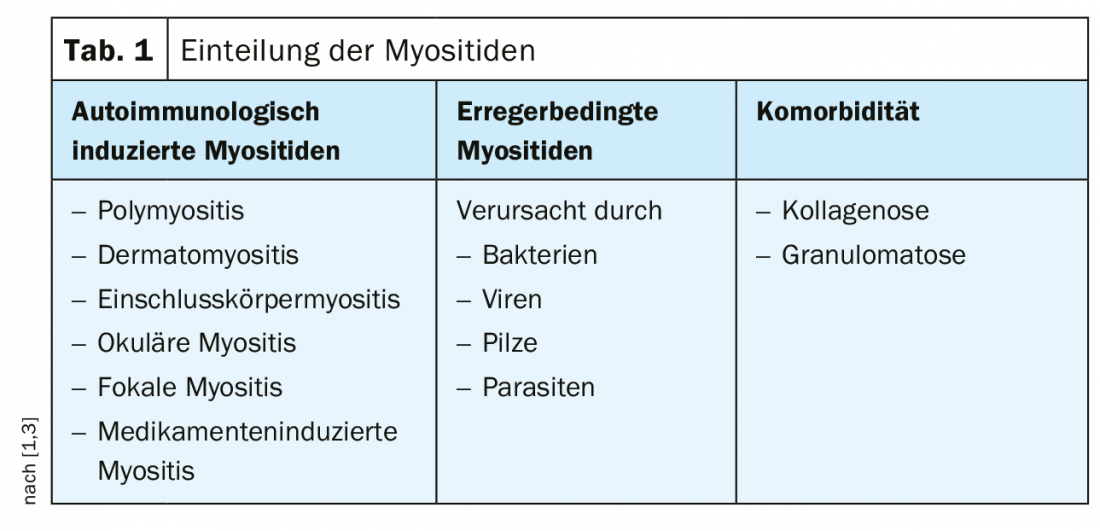
Les myopathies inflammatoires peuvent poser des problèmes en termes de diagnostic précoce, de diagnostic différentiel et de traitement différentiel [1]. Un suivi morphologique est souvent nécessaire, car le manque de spécificité des enzymes sériques musculaires, la graduabilité réduite des paramètres cliniques et la pertinence limitée de la biopsie (petits volumes d’échantillons, spécificité incomplète de l’infiltrat cellulaire) ne permettent pas toujours d’établir un diagnostic immédiat. Les myopathies inflammatoires se divisent pathogéniquement en myosites auto-immunes et en myosites dues à des agents pathogènes, mais elles peuvent également survenir en tant que comorbidité dans le cadre d’autres maladies (tableau 1).
La myosite à corps inclus représente environ 20% des myopathies inflammatoires, avec un pic d’incidence entre 50 et 70 ans environ et une répartition par sexe de 3:1 (hommes:femmes). Atrophies musculaires, parésie, dysphagie, dysphonie et dysarthrie d’évolution lente caractérisent l’aspect clinique. La polymyosite et la dermatomyosite sont relativement rares, avec une incidence annuelle commune d’environ 1/100 000, et peuvent survenir dans tous les groupes d’âge, la polymyosite étant plutôt rare chez l’enfant. Les principaux symptômes cliniques sont la dysphagie (30-50%), les douleurs musculaires (50%) et les arthralgies (20-30%). Les principaux critères de diagnostic différentiel sont résumés dans le tableau 2.

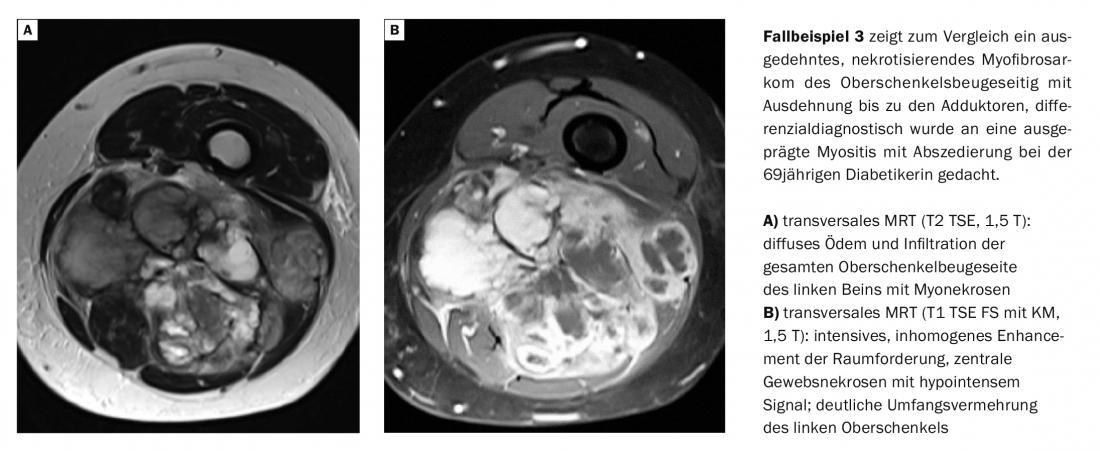
Les myopathies inflammatoires sont observées de manière croissante comme complication de l’infection par le VIH dans jusqu’à 72% des cas [2]. Sur le plan de la morphologie de l’image, il peut être difficile de différencier une myosite abcédée d’un myosarcome avec nécrose tumorale [3].
Les examens tomodensitométriques dans le diagnostic primaire des myopathies inflammatoires, tout comme les radiographies, les ultrasons et les techniques de médecine nucléaire, n’ont qu’une valeur complémentaire [4]. Cependant, la TDM HR a une grande importance dans le contexte du diagnostic pulmonaire des collagénoses ou des granulomatoses [5]. De même, il convient d’exclure les myopathies inflammatoires en tant que comorbidité dans les syndromes malins et paranéoplasiques. Dans ces cas, l’imagerie TEP-TDM est à privilégier [6]. La tomodensitométrie offre des avantages par rapport à l’IRM dans le diagnostic de la myosite ossifiante en permettant de visualiser des calcifications musculaires précoces [7].
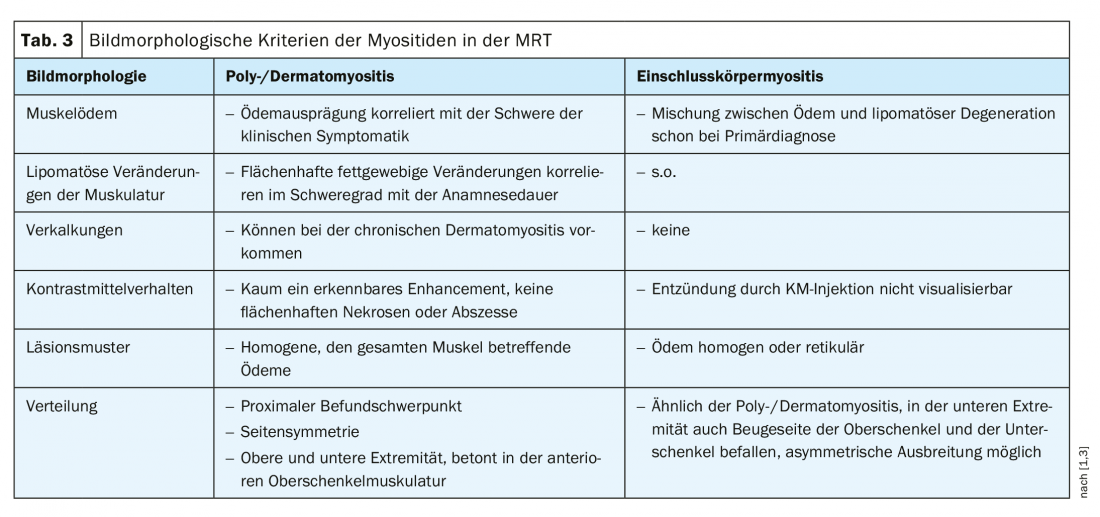
Dans les examens d’imagerie par résonance magnétique (IRM), des critères de morphologie d’image peuvent aider à différencier les myosites [1,8], dont la liste figure dans le tableau 3.
La myosite focale se distingue par le type d’atteinte (un seul muscle ou un compartiment musculaire atteint) et présente un rehaussement de contraste évident sans abcédation ni nécrose tissulaire. Les muscles concernés sont principalement des muscles isolés de la partie inférieure de la jambe. Les calcifications sont fréquentes dans les myosites parasitaires et des réactions intenses au produit de contraste, accompagnées de nécroses tissulaires et d’abcès, sont presque régulièrement observées dans les myosites induites par des agents pathogènes. Les réactions tissulaires œdémateuses nécessitent l’utilisation de séquences supprimant la graisse pour une détection fiable [9]. Cependant, la détection de l’œdème n’est pas seulement l’expression d’une inflammation, comme le montre la vue d’ensemble 1 sur le diagnostic différentiel.
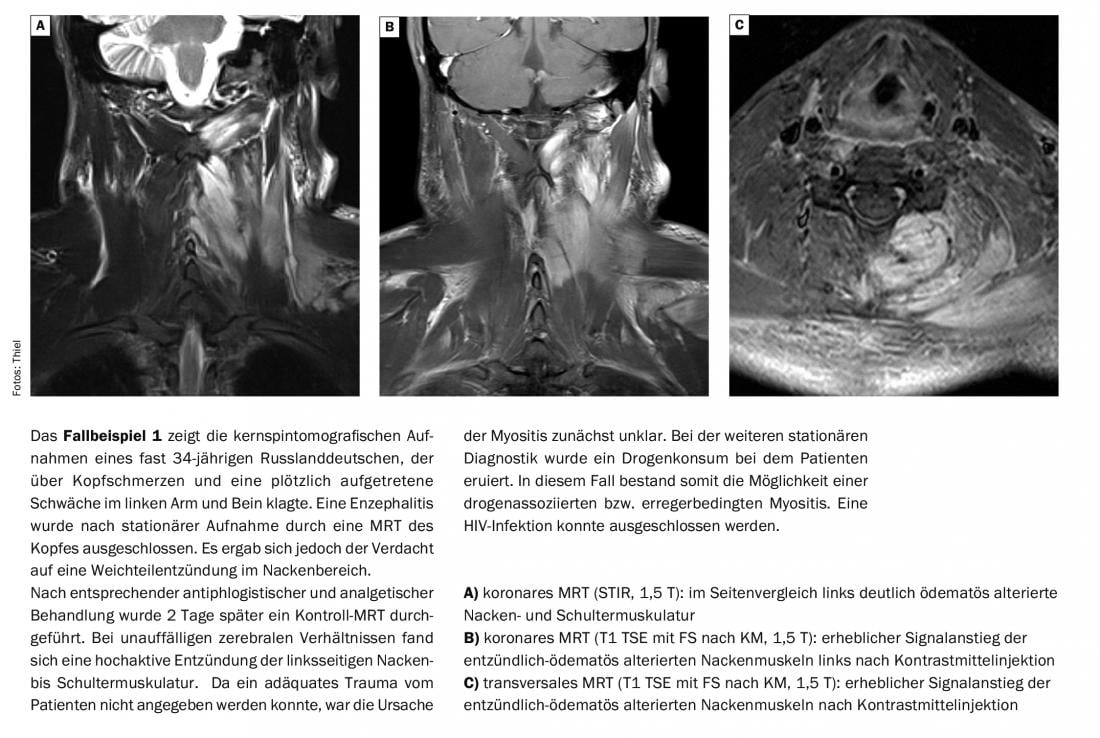
L’IRM permet un diagnostic en temps réel et un traitement adapté aux symptômes. Cela permet de réduire les risques d’erreur de diagnostic et de retard dans le traitement [4]. L’IRM est également un outil important pour la planification des biopsies, elle permet d’obtenir des informations concrètes sur la localisation et l’étendue de l’inflammation musculaire. Un critère important pour l’extension de la biopsie est la constatation par IRM de l’extension de l’inflammation aux fascias musculaires, qui doivent alors être également biopsiés.
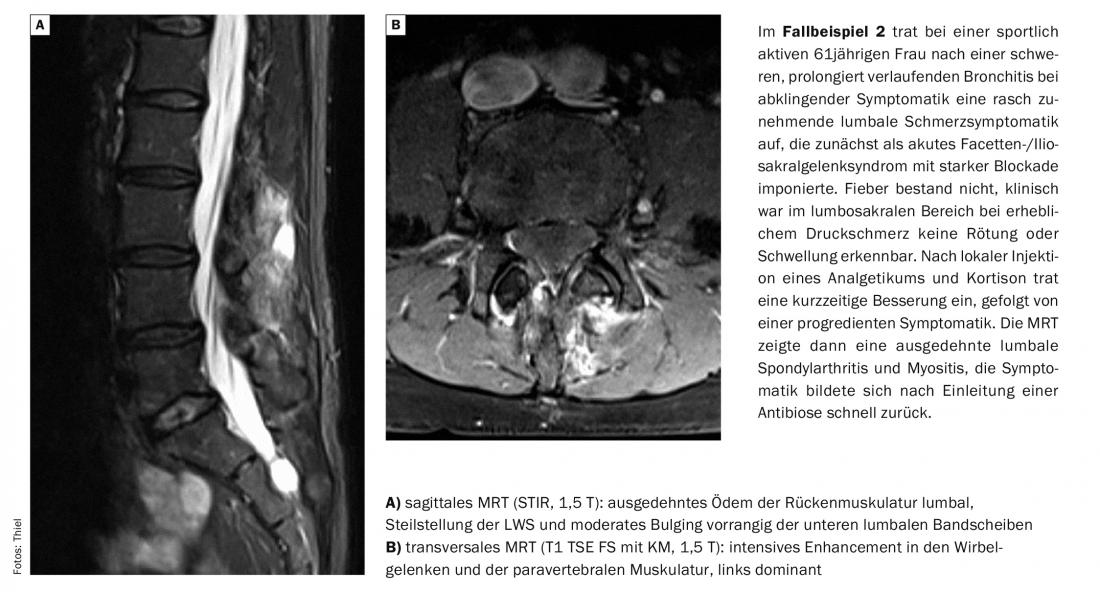
Messages Take-Home
- La myopathie inflammatoire est divisée en étiologie auto-immune vs. induite par un agent pathogène.
- En plus de la détermination des enzymes sériques musculaires, de la biopsie et d’autres paramètres cliniques, les techniques d’imagerie sont des outils de diagnostic importants.
- La tomodensitométrie ou le PET-CT peuvent être utilisés pour clarifier une comorbidité, l’imagerie par résonance magnétique (IRM) dans tous les autres cas.
- L’injection intraveineuse de produit de contraste n’est pas obligatoire pour diagnostiquer une myosite, mais peut être utile pour visualiser un abcès en cas d’inflammation musculaire due à un agent pathogène.
Littérature :
- Beese M, Winkler G : IRM des muscles. Stuttgart, New York : Georg Thieme Verlag 1997 : pp. 129-172.
- Booth TC, Chhaya NC, Bell JR, Holloway BJ : Skeletal Radiol 2012 ; 41(11) : 1349-1363.
- Thiel HJ : MTA Dialog 9/2013 ; 14 : 840-843.
- Turecki MB, et al : Imagerie des infections des tissus mous musculo-squelettiques. Skeletal Radiol 2010 ; 39(10) : 957-971.
- Lundberg IE, Alexanderson H : Technology insight : tools for research, diagnosis and clinical assessment of treatment in idiopathic inflammatory myopathies. Nat Clin Pract Rheumatol 2007 ; 3(5) : 282-290.
- Al-Nahhas A, Jawad AS : PET/CT imaging in inflammatory myopathies. Ann N Y Acad Sci 2011 ; 1228 : 39-45.
- Kim SW, Choi JH : Myosite ossifiante dans le muscle psoas après une fracture de la colonne lombaire. Spine (Phila Pa 1976) 2009 ; 34(10) : E367-370.
- Tomasová Studynková J, Charvát F, Jaradosá K, Vencovsky J : Le rôle de l’IRM dans l’évaluation des polymyosites et des dermatomyosites. Rhumatologie (Oxford) 2007 ; 46(7) : 1174-1179.
- Burgener FA, Meyers SP, Tan RK, Zaunbauer W : Georg Thieme Verlag 2002 : pp. 334.
PRATIQUE DU MÉDECIN DE FAMILLE 2019 ; 14(11) : 31-33