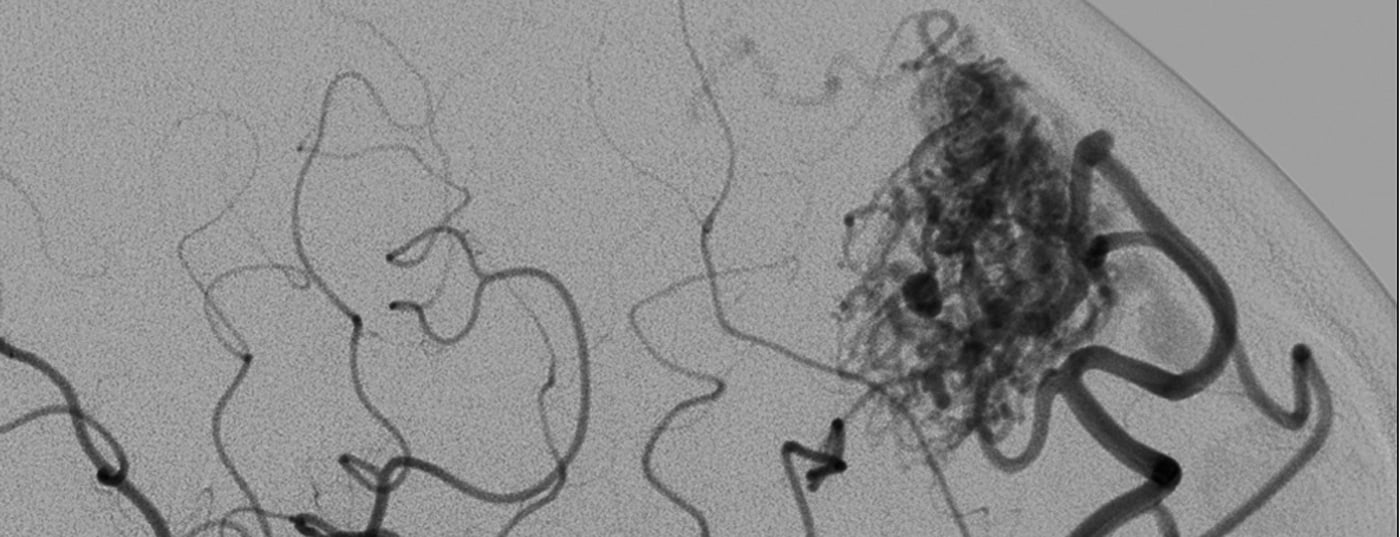
La principale manifestation d’une malformation artério-veineuse (MAV) symptomatique est une hémorragie intracrânienne, typiquement sous-arachnoïdienne ou intracérébrale, consécutive à une rupture dans un contexte de remodelage destructeur localisé de la paroi vasculaire. D’autres symptômes typiques existent soit sous forme d’irritation et se présentent souvent sous forme de céphalées et d’épilepsie, soit sous forme d’une diminution de la circulation dans les zones cérébrales adjacentes et donc de déficits neurologiques focaux d’origine non hémorragique. Pour limiter le risque principal d’hémorragie, l’objectif thérapeutique est d’exclure la MAV, ce qui peut être fait par voie endovasculaire, chirurgicale, radiochirurgicale ou en combinant deux ou trois de ces méthodes, selon les circonstances. En présence d’une symptomatologie non hémorragique comme des céphalées, une épilepsie ou des déficits neurologiques focaux, une occlusion partielle peut être envisagée pour améliorer les symptômes. En cas de symptômes hémorragiques, la fermeture d’une lésion supposée être à l’origine du saignement (anévrisme) peut protéger partiellement contre d’autres saignements de la MAV au même endroit, mais une fermeture complète de la MAV est préférable si elle est possible avec un risque acceptable.
Les malformations artério-veineuses (MAV) sont des maladies vasculaires circonscrites, souvent déjà présentes à la naissance, qui peuvent se manifester au cours de la vie avec les conséquences de multiples courts-circuits entre les systèmes artériel et veineux. Comme pour toutes les maladies neurovasculaires, il existe une possibilité d’interférence avec la circulation cérébrale normale adjacente ou directement avec le cerveau.
Les MAV du SNC sont comparables, en termes de fréquence et de nature, aux MAV d’autres tissus, tout aussi rares, qui sont aujourd’hui généralement traitées uniquement pour leurs symptômes. La différence essentielle réside dans le type de manifestation clinique qui, dans le cas de la MAV cérébrale, comprend une hémorragie et des symptômes de stimulation neurologique (épilepsie, céphalées) ou un dysfonctionnement neurologique, toutes conditions qui réduisent fortement la qualité de vie. Ces risques, qui accompagnent à la fois l’approche observationnelle et l’approche active, rendent la décision de traiter activement ou d’adopter une attitude attentiste en cas de découverte fortuite d’une MAV difficile et souvent controversée.
Formation d’un nidus
Il est probable que les MAV soient déjà en place au niveau foetal et qu’elles deviennent par la suite visibles et proportionnellement plus grandes au cours de la croissance. L’IRM, qui est aujourd’hui de plus en plus souvent pratiquée dès la période foetale ou la petite enfance, met rarement en évidence des formes particulières de MAV, même si ce n’est que par hasard. On peut donc supposer que la plupart des MAV cérébrales, bien que supposées d’origine foetale, ne deviennent visibles qu’au cours de la vie et ne se manifestent que secondairement, selon leur localisation.
Les malformations artério-veineuses impliquent de multiples courts-circuits pathologiques (fistules AV) entre les artères et les veines, c’est-à-dire sans réseau capillaire intermédiaire réduisant la pression et la vitesse du flux sanguin. Le gradient de pression AV qui en résulte entraîne une accélération de la circulation, appelée “shunt AV”. L’aspiration qui en résulte entraîne la formation de nombreux nouveaux vaisseaux répondant aux besoins et attire souvent de manière collatérale les territoires vasculaires artériels et veineux voisins – il en résulte la formation d’un riche réseau vasculaire artério-veineux, un nidus. En fonction de la structure et de la localisation du nidus de la MAV et de sa relation avec les artères et les veines des parties adjacentes du cerveau, il peut être très compact et circonscrit, mais il peut aussi être configuré de manière diffuse, ce qui le rend plus difficile à distinguer du tissu cérébral normal.
Sténoses et ectasies
L’augmentation de la circulation peut entraîner un vieillissement et une usure prématurés du segment vasculaire concerné, ce qui peut entraîner la formation de sténoses et d’ectasies vasculaires. Les deux types de modifications de la paroi sont aujourd’hui associés à un risque accru d’hémorragie, les ectasies artérielles et veineuses étant le lieu de parois vasculaires affaiblies et la sténose obstructive étant l’indicateur d’une pression potentiellement élevée pré-sténotique – des circonstances qui peuvent être évaluées au mieux dans le cadre d’un examen angiographique par cathétérisme. Aujourd’hui encore, les techniques d’imagerie en coupe laissent échapper une grande partie de ces informations décisives pour la décision d’agir.
Saisir à temps les processus destructeurs
Comme dans d’autres maladies neurovasculaires, telles que l’anévrisme, les processus athérothrombotiques adjacents à la paroi vasculaire sont aujourd’hui considérés comme responsables des modifications inflammatoires adjacentes qui affaiblissent la paroi vasculaire [1, 2]. La difficulté consiste à détecter correctement ces processus biologiques destructifs de remodelage de la paroi (“destructive remodeling”), en temps voulu et en raison de leur finesse, afin de pouvoir prévenir un saignement potentiel.
Comme les MAV sont statistiquement rares, que leur pathomorphologie est très variable et que leur comportement biologique varie en outre d’un individu à l’autre, il reste difficile de prévoir de manière fiable le risque de saignement [3–6]. Outre la taille et la localisation, les critères morphologiques des vaisseaux qui influencent le pronostic sont les formations d’anévrismes artériels, les ectasies veineuses et surtout les sténoses associées au drainage veineux (figure 1). Bien que l’on puisse supposer que des processus biologiques sont à l’origine de la tendance aux saignements, il n’existe à ce jour aucun autre marqueur biologique fiable permettant d’évaluer de manière fiable l’état et l’évolution potentielle d’une malformation vasculaire [2].
La découverte fortuite
La qualité actuelle de l’imagerie médicale par résonance magnétique (IRM) et de la tomodensitométrie (TDM) permet souvent d’identifier une MAV sans la rechercher spécifiquement, il en résulte la situation typique d’une MAV asymptomatique trouvée par hasard.
L’ECR multicentrique international ARUBA (“A Randomized Trial of Unruptured Brain AVMs” ; http://avm.ucsf.edu/patient_info/aruba_trial), commencé en 2007, compare l’attitude d’observation avec le traitement actif et argumente, selon les données actuellement connues, contre une approche active en cas de découverte fortuite. Une analyse détaillée des données obtenues est attendue prochainement.
Bien que les malformations artério-veineuses intracrâniennes soient très rares, il faut partir du principe que leur incidence réelle est quelque peu sous-estimée, avec une prévalence actuellement estimée à 15 pour 100000. L’incidence annuelle (présentation symptomatique) des malformations AV est de 1-2/100000 par an. Pour les MAV qui ne se sont pas manifestées par une hémorragie, les différences entre les différentes séries publiées sont relativement faibles, de sorte que l’on peut estimer le risque d’hémorragie entre 2 et 4% par an. Une fois qu’une MAV a saigné, le risque d’autres saignements augmente.
Les associations familiales de malformations AV sont presque exclusivement observées cliniquement dans le cadre du syndrome d’Osler-Weber-Rendue (télangiectasie hémorragique héréditaire, HHT) et apparaissent sporadiquement ailleurs. En règle générale, il n’est donc pas nécessaire d’examiner les membres de la famille en cas d’apparition sporadique d’une MAV.
Dans tous les cas, une malformation AV doit être examinée en détail au moyen d’une angiographie par cathéter, afin de détecter et d’évaluer les facteurs qui représentent un risque accru pour le patient. Les paramètres suivants sont des indicateurs reconnus d’un risque accru de saignement pour les raisons mentionnées ci-dessus et d’après les publications :
- Petite malformation AV (taille du nidus <3 cm)
- Emplacement profond (péri- ou intraventriculaire, ou dans les ganglions de la base)
- Drainage veineux profond et ectasie veineuse associés à une sténose et à des anévrismes juxta- ou intranidaux associés.
Si un saignement a déjà eu lieu, le risque d’un nouveau saignement est nettement plus élevé, en particulier au cours des six premiers mois [7].
Les symptômes initiaux non hémorragiques
Epilepsie: les crises d’épilepsie sont le symptôme initial chez plus d’un tiers des patients. Chez la plupart des patients, les crises sont focales ou focales complexes, les MAV corticales étant plus souvent associées aux crises. De nombreux patients peuvent être relativement bien contrôlés par les médicaments.
Maux de tête: les maux de tête chroniques sont présents chez environ 30% des patients atteints de MAV. L’oblitération endovasculaire d’une éventuelle atteinte artérielle méningée entraîne généralement une réduction significative de ces céphalées, ce qui plaide en faveur d’une irritation méningée. Des mécanismes tels que l’irritation des artères cérébrales à l’origine des maux de tête ont été évoqués, les nerfs vasculaires des segments proximaux des artères cérébrales pourraient éventuellement permettre de percevoir des signaux de douleur.
Déficits neurologiques focaux: des déficits neurologiques focaux sont également présents chez près d’un tiers des patients atteints de MAV. Elles peuvent être progressives, stables ou fluctuantes. Le mécanisme de ces déficits focaux varie. Parfois, ces déficits focaux peuvent cacher un état post-critique, mais il s’agit plus souvent d’un trouble circonscrit de la circulation cérébrale (phénomène de “vol”). Il s’agit parfois d’une hypertension veineuse régionale ou d’un effet de dilatation pulsatile irritant d’une sectasie vasculaire.
Options thérapeutiques
En principe, les malformations AV peuvent être traitées par neurochirurgie, neurointervention ou radiothérapie. L’objectif des trois traitements, pris séparément ou en combinaison de deux ou trois formes de thérapie, devrait être d’obturer complètement la MAV. L’idée parfois répandue selon laquelle une réduction de la taille de la MAV entraîne également une réduction du risque de saignement n’est pas correcte. Au contraire, une modification de l’hémodynamique dans une MAV (conséquence pratiquement inévitable d’une réduction de taille sans fermeture complète) peut tout à fait conduire à une augmentation du risque de saignement et ne doit en aucun cas donner lieu à une fausse sécurité.
En principe, la décision pour ou contre un traitement spécifique d’un angiome AV doit être prise de manière interdisciplinaire. Nous estimons que la thérapie neurochirurgicale et la thérapie interventionnelle, seules ou combinées, jouent un rôle plus important (Fig. 1). Dans le cas de MAV profondes ou de MAV du tronc cérébral alimentées par de multiples artères perforantes, la radiochirurgie est nettement moins risquée. En raison de la latence entre le traitement et la fermeture de la MAV après la radiothérapie, l’exérèse chirurgicale et le traitement endovasculaire doivent être privilégiés, seuls ou en combinaison, afin d’obtenir un effet préventif rapide.
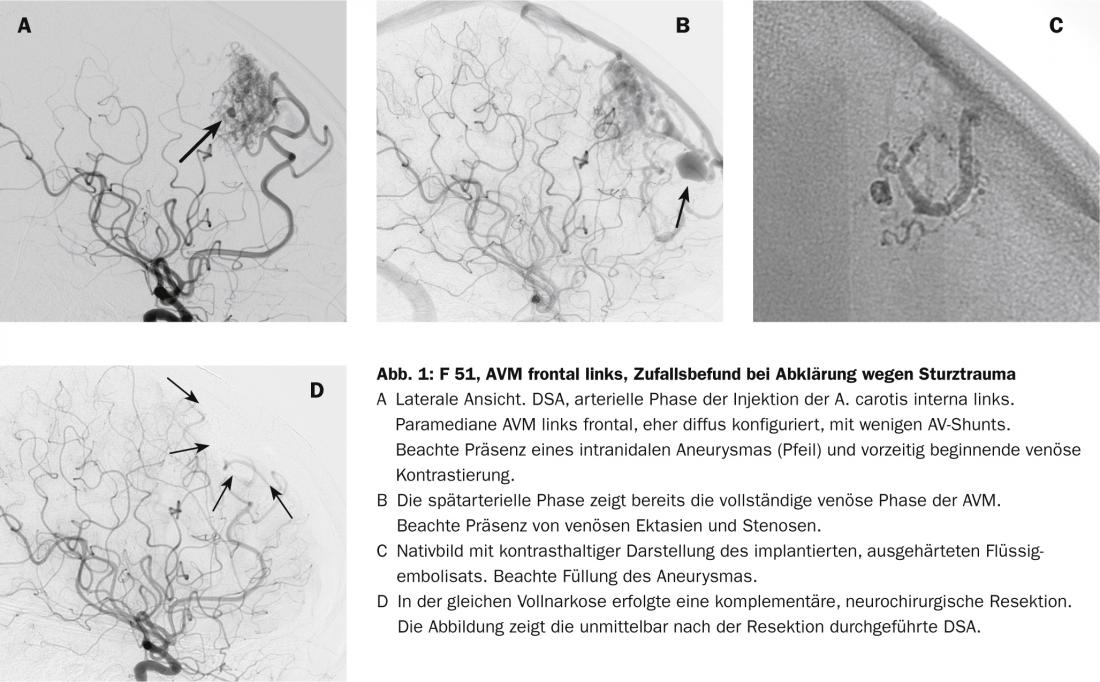
Traitement endovasculaire
L’accès par cathéter endovasculaire supersélectif à une MAV, généralement réalisé sous anesthésie, est aujourd’hui une opération de routine et, tant que les dimensions du vaisseau le permettent, pratiquement toutes les branches du vaisseau peuvent être abordées. L’imagerie super-sélective de la lumière des vaisseaux permet une analyse fine de la morphologie des vaisseaux et du nidus, tout en ouvrant l’option de l’occlusion endovasculaire. Pour ce faire, on utilise généralement des adhésifs liquides polymérisants ou des substances précipitantes, peu ou pas adhésives. Sous contrôle visuel fluoroscopique et biplan, ces substances sont injectées progressivement en évitant l’occlusion des vaisseaux normaux voisins.
Le risque réside dans l’oblitération des vaisseaux normaux et dans le saignement provoqué par l’injection et la manipulation endovasculaire. Ce sont des risques qui ne sont pris que s’ils sont considérés comme proportionnels au risque de saignement spontané estimé. Nous utilisons généralement une substance précipitante. Une fois que l’on a atteint la position intranidale du cathéter, celui-ci est injecté lentement dans le nidus. Il est souvent possible de fermer de grandes parties de la MAV, voire la MAV entière, en plaçant un seul cathéter. Toutefois, en fonction de la compartimentation, il peut naturellement arriver que l’on doive fermer une telle MAV sur deux ou trois positions. Le taux d’occlusion complète a considérablement augmenté depuis l’utilisation de ces substances (Fig. 2) [8].
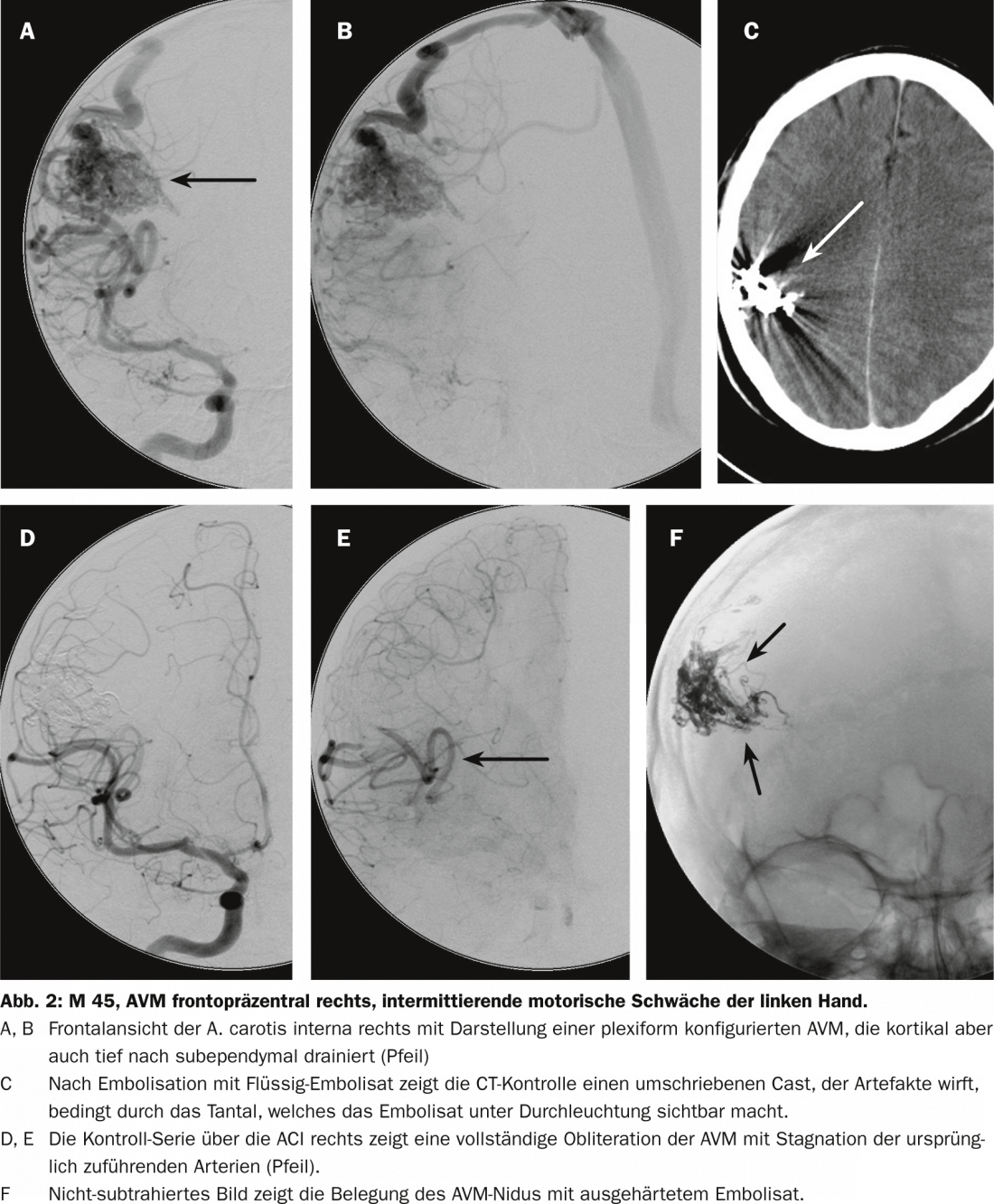
Traitement neurochirurgical
Les malformations AV superficielles et de petite taille peuvent être opérées et complètement retirées avec une mortalité et une morbidité très faibles, tandis que les malformations AV profondes, de grande taille et drainant le parenchyme cérébral peuvent être associées à une morbidité et une mortalité chirurgicales dramatiquement plus élevées, pouvant dépasser 50%. Une grande méta-analyse réalisée en 2000 sur plus de 2400 patients a montré que la mortalité moyenne après une exérèse neurochirurgicale était de 3,3% et la morbidité moyenne de 8,6% (1,5-18,7%) [9].
Le risque de traitement neurochirurgical doit être évalué individuellement à l’aide de la classification de Spetzler et Martin. La graduation de la MAV selon Spetzler-Martin est basée sur la taille, le drainage veineux et l’éloquence du tissu cérébral environnant, en se basant sur l’angiographie par cathéter, le scanner ou l’IRM. La graduation de la lésion est déterminée par la sommation des différents points. Plus le score est élevé, plus le risque chirurgical neurochirurgical de morbidité ou de mortalité est important.
Cette classification ne donne aucun pronostic quant aux risques d’un éventuel traitement endovasculaire associé.
Radiochirurgie stéréotaxique
La radiothérapie stéréotaxique, pratiquée en une seule séance dans le cadre de la radiochirurgie, permet d’éviter l’apparition progressive, jusqu’à un maximum de 10 %, d’un cancer du sein 1 à 2 ans après la fin du traitement. Le succès oblitérant du traitement, observé environ cinq ans après le traitement, dépend de manière décisive de la taille de la MAV et du diamètre des vaisseaux alimentant la MAV. Pour les MAV dont la taille du nidus est inférieure à 15 mm, le taux d’oblitération complet est de 77% ; si le nidus est compris entre 15 et 25 mm, le taux d’oblitération est de 62% et se réduit à 44% si le nidus est supérieur à 25 mm. En présence d’affluents duraux supplémentaires, la probabilité d’une oblitération complète est réduite de moitié. Les complications retardées du traitement par radiothérapie, principalement dues à une nécrose par irradiation des tissus cérébraux adjacents, sont de l’ordre de 5 à 7 %, auxquelles s’ajoute un risque hémorragique persistant de 3 à 4 % par an tant que la MAV n’est pas fermée.
Coopération multidisciplinaire
Le conseil et le traitement des MAV cérébrales sont mieux réalisés de manière multidisciplinaire par une équipe médicale composée de neuroradiologues interventionnels, de neurochirurgiens et de radiothérapeutes, associée à une évaluation critique par des neurologues et, le cas échéant, des neuropsychologues et des psychiatres. Le suivi post-thérapeutique se fait en étroite collaboration avec des neurointenseurs et, si nécessaire, avec un réseau de réadaptation et de réinsertion sociale.
L’exclusion préventive d’une hémorragie par le traitement des MAV asymptomatiques est aujourd’hui remise en question, car les risques d’un traitement invasif sont actuellement considérés comme plus élevés que ceux d’une évolution spontanée. Un suivi à long terme des patients et de leur famille est ainsi nécessaire, notamment en cas de décision d’une procédure non active, et une relation médecin-patient continue est un avantage.
Littérature :
- Chen Y, et al : Evidence of inflammatory cell involvement in brain arteriovenous malformations. Neurosurgery 2008 ; 62(6) : 1340-1349 (discussion 1349-1350).
- Kim H, et al : Considérations génétiques pertinentes pour les hémorragies intracrâniennes et les malformations artérioveineuses cérébrales. Acta Neurochir Suppl 2008 ; 105 : 199-206.
- Laakso A, Hernesniemi J : Malformations artérioveineuses : épidémiologie et présentation clinique. Neurosurg Clin N Am 2012 ; 23(1) : 1-6.
- Laakso A, et al : Risk of hemorrhage in patients with untreated spetzler-martin grade IV and V arteriovenous malformations : A long-term follow-up study in 63 patients. Neurosurgery 2011 ; 68(2) : 372-377 ; (discussion 378).
- Hernesniemi JA, et al : Natural history of brain arteriovenous malformations : A long-term follow-up study of risk of hemorrhage in 238 patients. Neurosurgery 2008 ; 63(5) : 823-829 (discussion 829-831).
- Al-Shahi R, Warlow C : A systematic review of the frequency and prognosis of arteriovenous malformations of the brain in adults. Brain 2001 ; 124 : 1900-1926.
- Stapf C, et al : Predictors of hemorrhage in patients with untreated brain arteriovenous malformation. Neurology 2006 ; 66(9) : 1350-1355.
- Panagiotopoulos V, et al : Embolization of intracranial arteriovenous malformations with ethylene-vinyl alcohol copolymer (onyx). AJNR Am J Neuroradiol 2009 ; 30(1) : 99-106.
- Castel JP, Kantor G : Morbidité et mortalité postopératoires après exclusion microchirurgicale des malformations artérioveineuses cérébrales. Données actuelles et analyse de la littérature récente. Neurochirurgie 2001 ; 47(2-3) : 369-383.