L’utilisation d’oncologues et d’immunothérapeutes ciblés a révolutionné le traitement du cancer noir de la peau au cours des dernières années. Cependant, la séquence thérapeutique optimale reste encore incertaine aujourd’hui. Une analyse d’étude s’est penchée sur la question de savoir si le statut de la mutation BRAF V600E/K avait un impact sur le succès de l’immunothérapie dans le mélanome malin avancé.
Environ 40% des mélanomes métastatiques présentent une mutation BRAF, la mutation activatrice BRAF V600E/K étant de loin la plus fréquente [1]. Cette modification génétique peut être d’une utilité thérapeutique et sert de cible à différents traitements ciblés. Par exemple, le vémurafénib et l’encorafénib sont des inhibiteurs de BRAF spécifiques de la mutation qui ont une place importante dans le traitement du mélanome. L’association avec des inhibiteurs de la MEK comme le tramétinib permet d’augmenter encore l’efficacité de ces substances et de réduire les résistances secondaires. Comme BRAF, MEK fait partie de la voie de signalisation MAPK, importante dans la pathogenèse, dont l’activation incontrôlée entraîne une croissance cellulaire excessive dans le mélanome à mutation BRAF [2]. Outre les agents ciblés pour l’inhibition de BRAF et de MEK, des immunothérapies sont également utilisées dans le traitement du cancer noir de la peau métastatique [3]. Avec la multiplicité des possibilités, se pose également la question de la séquence thérapeutique optimale pour maximiser l’efficacité et la tolérance. Les données disponibles à ce jour suggèrent que la réponse au traitement de première ligne est meilleure que celle à tous les traitements ultérieurs, indépendamment du fait que les inhibiteurs de checkpoint ou de BRAF/MEK soient utilisés en premier lieu [4].
Évaluation de l’immunothérapie après une thérapie ciblée
Une étude récemment publiée dans le JAMA Oncology fournit des informations supplémentaires sur l’interaction potentielle entre les thérapies ciblées et les inhibiteurs de points de contrôle dans le traitement du mélanome malin. Les auteurs ont étudié l’influence du statut mutationnel de BRAF et d’un traitement antérieur d’inhibition de BRAF/MEK sur l’immunothérapie par pembrolizumab, un inhibiteur de PD-1. Pour ce faire, ils ont analysé les données de trois essais cliniques randomisés, KEYNOTE-001, KEYNOTE-002 et KEYNOTE-006. L’évaluation a porté sur 1558 patients adultes atteints de mélanome avancé, dont le statut mutationnel de BRAFV600E/K était connu et qui ont reçu du pembrolizumab. 1124 patients avaient un BRAF de type sauvage (WT) et 434 patients présentaient une mutation du BRAF, qui avait été traitée de manière ciblée dans 271 cas. Les critères d’évaluation primaires de l’analyse rétrospective étaient le taux de réponse objective (ORR) au pembrolizumab, ainsi que les taux de PFS et d’OS à quatre ans sous immunothérapie. (Tab.1). D’une part, les résultats ont été comparés chez les patients atteints de BRAF WT et de BRAF muté, et d’autre part, les auteurs ont également évalué les effets d’un traitement par inhibiteur de BRAF avec ou sans inhibition supplémentaire de MEK au sein du sous-groupe de patients dont la tumeur présentait une mutation de BRAF.
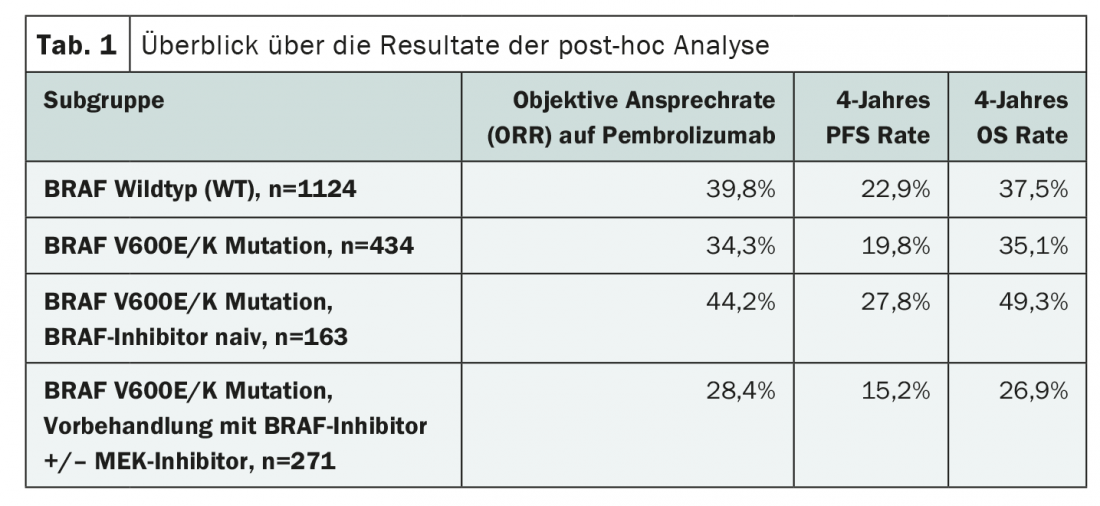
La comparaison entre les tumeurs BRAF WT et les tumeurs BRAF mutées a montré des résultats légèrement meilleurs chez les personnes atteintes sans mutation (tableau 1). Cependant, la majorité des patientes présentant une mutation BRAF avaient reçu au préalable un traitement par inhibiteurs BRAF/MEK. De plus, ils étaient en moyenne plus âgés et avaient plus souvent déjà suivi un traitement par ipilimumab.
La comparaison des sous-groupes avec et sans traitement par inhibiteur de BRAF laissait supposer qu’un traitement préalable approprié constituait une mauvaise condition préalable à l’immunothérapie (tableau 1). Cependant, une étude plus approfondie a révélé que les patients qui avaient été prétraités par une thérapie ciblée étaient généralement moins bien lotis. Par exemple, il y avait parmi eux un plus grand nombre de tumeurs PD-L1 négatives et de métastases cérébrales. Néanmoins, un certain effet a persisté dans diverses analyses de sous-groupes, mais qui, selon les auteurs, pourrait être dû à des faiblesses dans la sélection des patients de l’étude.
En ce qui concerne la sécurité, ni le statut mutationnel ni le traitement préalable par des inhibiteurs de BRAF ne semblaient jouer un rôle. Les effets indésirables des médicaments étaient répartis de manière uniforme sur l’ensemble des patientes. Les auteurs concluent que l’utilisation du pembrolizumab peut apporter un bénéfice clinique dans tous les sous-groupes étudiés et que la sécurité est garantie même en cas de prétraitement. De nombreuses recherches sont encore nécessaires, y compris dans le cadre d’études prospectives, pour confirmer ces affirmations, pour démontrer éventuellement un effet significatif d’un traitement par inhibiteur de BRAF sur les lignes de traitement suivantes, ou même pour pouvoir recommander une séquence de traitement. Bien que beaucoup ait déjà été fait avec le développement de diverses nouvelles substances qui ont déjà amélioré durablement le pronostic du mélanome malin, leur utilisation optimale et un traitement spécifique aux sous-groupes pourraient permettre de franchir de nouvelles étapes dans la gestion du cancer noir de la peau.
Source : Puzanov, et al : Association of BRAF V600E/K Mutation Status and Prior BRAF/MEK Inhibition With Pembrolizumab Outcomes in Advanced Melanoma : Pooled Analysis of 3 Clinical Trials. JAMA Oncol 2020 ; 6(8) : 1256-1264.
Littérature :
- Long GV, et al : Associations pronostiques et clinicopathologiques de BRAF oncogène dans le mélanome métastatique. J Clin Oncol 2011 ; 29(10) : 1239-1246.
- Knispel S, et al : Mélanome malin : options pour les patients à un stade avancé. Dtsch Arztebl International 2018 ; 115(20-21) : 4-9.
- National Comprehensive Cancer Network (Réseau national de cancérologie) : NCCN clinical practice guidelines : cutaneous melanoma (version 4.2020). www.nccn.org/professionals/physician_gls/pdf/cutaneous_melanoma.pdf.
- Johnson DB, et al : Traitement par séquençage dans le mélanome mutant BRAFV600 : anti-PD-1 avant et après l’inhibition de BRAF. J Immunother 2017 ; 40(1) : 31-35.
InFo ONKOLOGIE & HÉMATOLOGIE 2020 ; 8(6) : 30