Les modifications des directives et les nouvelles approches thérapeutiques entraînent des changements d’approche dans le traitement de l’asthme sévère. Dans les cas graves et réfractaires, la préférence est désormais clairement donnée aux produits biologiques plutôt qu’aux stéroïdes.
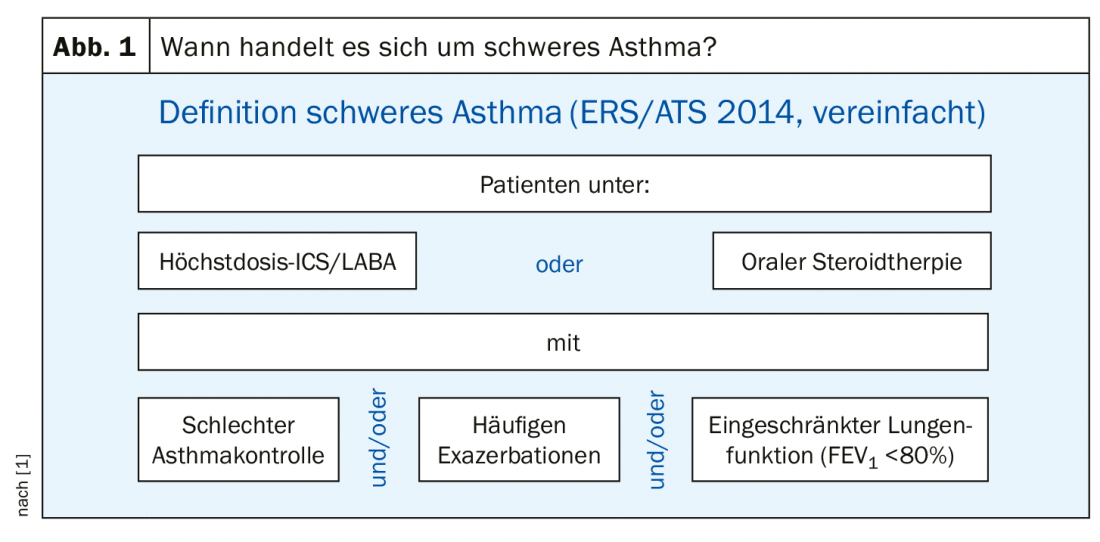
Selon les directives de l’European Respiratory Society (ERS) et de l’American Thoracic Society (ATS), pour être considéré comme un asthmatique sévère, il faut que le cas de figure suivant se présente : Le patient reçoit d’une part un traitement par stéroïde inhalé et bêtamimétique (CSI/LABA) – et le stéroïde à la dose maximale – ou un traitement par stéroïde oral pendant au moins six mois par an. D’autre part, si malgré l’un de ces traitements, le contrôle de l’asthme est mauvais et/ou les exacerbations sont fréquentes et/ou la fonction pulmonaire est réduite (VEMS <80%), on parle d’asthme sévère. En d’autres termes : Une personne qui reçoit un traitement maximal ou très élevé, mais qui n’est pas bien contrôlée en dessous, est un asthmatique sévère. En Allemagne, cette définition de l’asthme sévère a été adoptée en 2014 à partir des directives internationales de l’ERS et de l’ATS (figure 1).
Grades de gravité en tant que schéma de niveaux
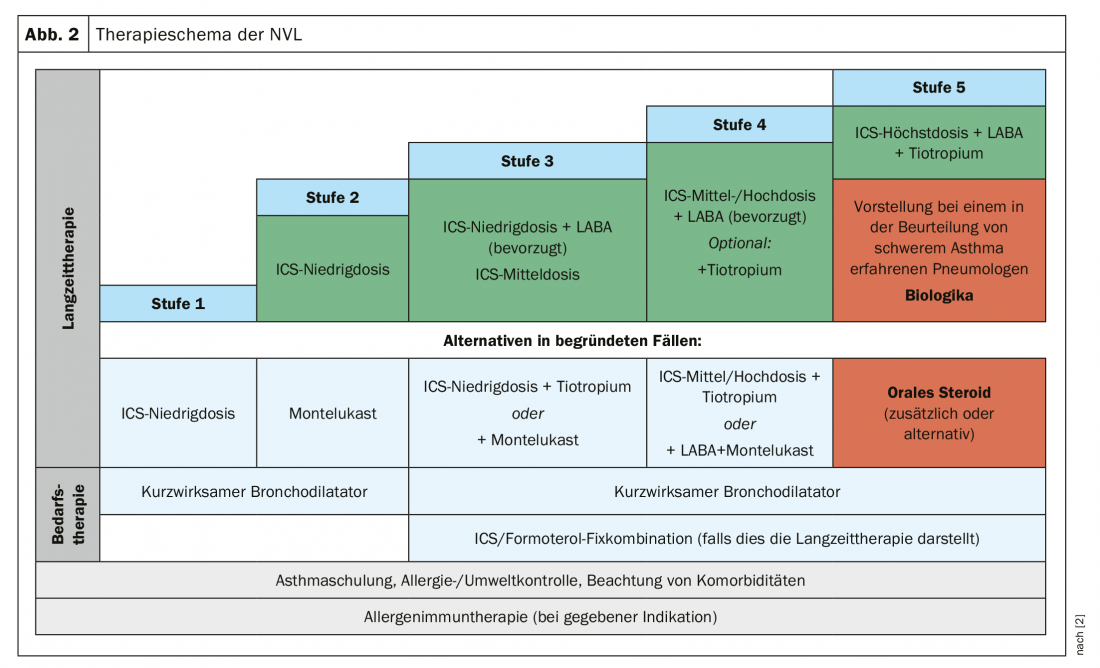
Depuis septembre 2018, nos voisins disposent d’un nouveau guide national de soins (NVL) qui présente les degrés de gravité de l’asthme sous la forme d’une grille de niveaux. Dans un premier temps, le médecin prescrit généralement des bronchodilatateurs à courte durée d’action. Cette catégorie comprend les patients qui ont une forme très légère d’asthme. A partir du niveau 2, nous avons affaire à des patients qui ont besoin de l’inhalateur d’urgence au moins deux fois par semaine. C’est là qu’il faut commencer à envisager un traitement par CSI en tant que traitement permanent. “C’est encore le meilleur cheval de l’écurie”, estime le professeur Marek Lommatzsch, du département de pneumologie de l’hôpital universitaire de Rostock. Une alternative serait le montelukast, par exemple pour les patients qui ont peur des stéroïdes. Il est toutefois moins efficace, du moins chez les adultes.
Si le CSI ne suffit pas, on ne va pas tout de suite à la dose maximale, mais on l’associe à un bêtamimétique. Et si cela ne suffit pas non plus, on peut ajouter un troisième inhalateur, à savoir le tiotropium, seul anticholinergique autorisé. Cependant, la véritable petite révolution du NVL actuel a été que, pour la première fois, la combinaison fixe CSI/LABA a été recommandée. Il y a dix ans, on disait qu’il fallait administrer les CSI et les LABA séparément. Contexte : “On s’est rendu compte que de nombreux patients se procuraient le CSI et le LABA séparément, mais ne prenaient ensuite que le LABA”, explique le professeur Lommatzsch. “Et vous savez que les LABA sont interdits en monothérapie dans l’asthme !”. La combinaison fixe permet d’exclure cette possibilité.
Enfin, au niveau 5, avec les cas d’asthme sévère, il faut essayer d’instaurer un traitement inhalé maximal, au moins temporairement, sur une période d’au moins trois mois, si le patient n’est pas suffisamment contrôlé. Cela signifie : CSI à dose maximale plus LABA plus LAMA (tiotropium) (Fig. 2).
Mais quel est l’effet de l’épuisement d’une thérapie à dose maximale sur les biomarqueurs ? Le professeur Lommatzsch et son équipe de Rostock ont lancé un essai : un groupe de patients souffrant d’asthme non contrôlé et recevant une dose moyenne de CSI a été conditionné à la dose maximale pendant trois mois. Le traitement a eu un impact décisif sur les éosinophiles, qui ont ainsi été réduits d’environ 50%. On sait depuis longtemps que les éosinophiles sont massivement réduits par les stéroïdes oraux ou systémiques, mais il n’était pas clair jusqu’à présent que les CSI avaient également un effet considérable sur ce biomarqueur. “Cela signifie que, d’une part, nous devons considérer la valeur d’Eos dans le contexte de la médication et que, d’autre part, nous en savons encore trop peu sur l’effet systémique réel des CSI à dose maximale”.
Le médecin doit justifier l’utilisation de stéroïdes
Mais qu’en est-il des patients qui suivent un traitement par inhalation à un niveau maximal, qui peuvent inhaler correctement, qui font tout comme le médecin le souhaite, mais qui sont malgré tout réfractaires au traitement ? Pour ces cas, l’actuel NVL a préparé la prochaine petite révolution : chez ces patients, il faudrait au plus tard maintenant penser aux médicaments biologiques. L’alternative serait de recourir aux stéroïdes, mais le médecin doit désormais justifier son choix plutôt que de recourir aux médicaments biologiques.
En effet, selon le professeur Lommatzsch, les asthmatiques entretiennent souvent une relation d’amour-haine avec les stéroïdes systémiques. “Les asthmatiques adorent la prednisolone. C’est presque un critère de diagnostic : si vous demandez à un asthmatique ce qu’il pense de la prednisolone, il vous répond généralement : super. Un BPCO, en revanche, répond : Cela ne sert à rien, il n’y a que des effets secondaires”. Il cite l’exemple d’une patiente de 56 ans de sa clinique qui prenait 80 mg de prednisolone par voie orale tous les jours depuis 1993 et 100 mg par voie intraveineuse tous les deux jours, et qui n’avait en fait aucun problème avec son asthme. “Elle avait de l’obésité, du diabète, de l’hypertension, de l’ostéoporose, des fractures, des troubles du sommeil et une dépression, mais elle voulait voir tous les autres médecins, sauf moi, parce qu’elle pensait que son contrôle de l’asthme était parfait”.
Pour éviter de tels cas à l’avenir, les médicaments biologiques sont nécessaires comme alternative. Pour trouver le bon médicament biologique pour un patient, il est d’abord conseillé d’effectuer un phénotypage. Le professeur Lommatzsch énumère à cet effet trois formes d’asthme qu’il convient d’abord de déterminer :
- L’asthme/le rhume transitoire apparaît dans l’enfance et disparaît ensuite.
- L’asthme précoce débute dans l’enfance et persiste tout au long de la vie.
- L’asthme de l’adulte ne commence qu’à l’âge adulte.
- De même, les biomarqueurs jouent un rôle essentiel dans le phénotypage et, en fin de compte, dans la décision thérapeutique :
- Concentration d’éosinophiles dans le sang (cellules/µl)
- Concentration totale d’IgE dans le sérum
- Prick-test (allergènes typiques) Concentration d’IgE spécifiques dans le sérum
- NO exhalé (FeNO) en ppb (prestation IGeL)
Trouver le médicament biologique approprié
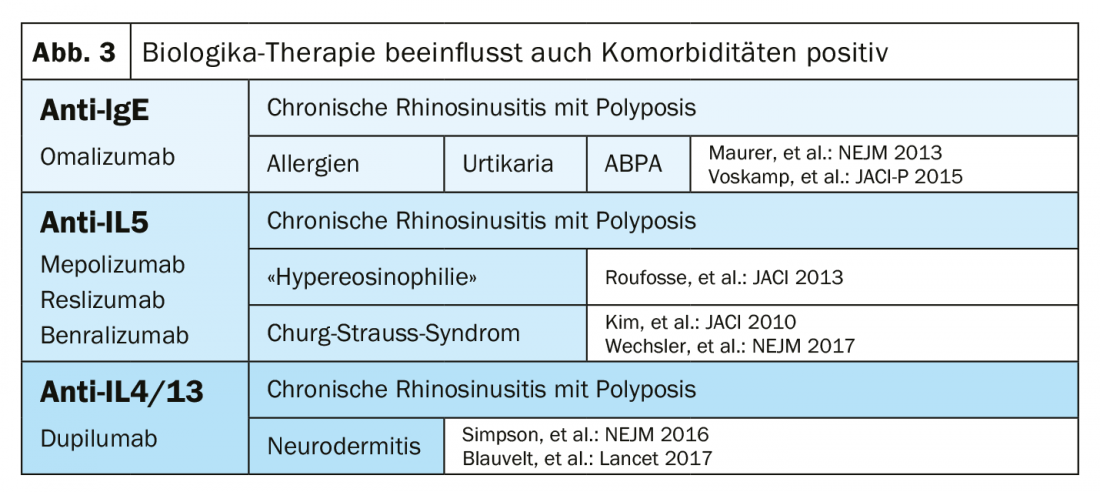
Depuis l’autorisation de mise sur le marché du dupilumab, un agent biologique anti-IL-4/13, en mai 2019, les pneumologues disposent d’un total de cinq agents biologiques. L’omalizumab (anti-IgE) a une action non seulement antiallergique, mais aussi anti-auto-immune et antivirale. Un patient typique sous omalizumab présente un asthme précoce, des allergies et un taux élevé d’IgE totales. Il existe également les agents biologiques anti-IL-5 mepolizumab, reslizumab et benralizumab. Le patient anti-IL-5 typique présente un asthme adulte, aucune allergie et une éosinophilie sanguine prononcée. Cependant, le chevauchement entre les groupes est tout à fait élevé. C’est pourquoi non seulement les biomarqueurs et l’anamnèse sont importants pour choisir le bon médicament biologique, mais aussi les comorbidités (Fig. 3) .
Selon le conseil final de l’expert, les pneumologues devraient toujours prendre en compte ces trois facteurs, phénotype, biomarqueurs et comorbidités, car ils sont essentiels pour choisir le bon médicament biologique.
Source : DGIM 2019, Wiesbaden (D)
Littérature :
- Lommatzsch M, Virchow JC : Asthme sévère : définition, diagnostic et traitement. Dtsch Arztebl Int 2014 ; 111 : 847-855.
- BÄK, KBV, AWMF : Ligne directrice nationale de soins pour l’asthme. Version longue, 3ème édition. Version 1, 2018. www.leitlinien.de/mdb/downloads/nvl/asthma/asthma-3aufl-vers1-lang.pdf, dernière consultation 11.06.19.
InFo PNEUMOLOGIE & ALLERGOLOGIE 2019 ; 1(2) : 18-20 (publié le 27.9.19, ahead of print)
PRATIQUE DU MÉDECIN DE FAMILLE 2019 ; 14(10) : 18-19