La polyneuropathie diabétique (dPNP) est la neuropathie la plus fréquente dans les pays occidentaux. Mais qui les reçoit et comment les reconnaître ? Cette question est d’autant plus importante que 40% des patients dont la dPNP est douloureuse ne sont toujours pas traités. Les possibilités de diagnostic et de traitement ont été abordées lors du congrès allemand sur la douleur.
La dPNP somatosensorielle se développe presque toujours parallèlement à une rétinopathie ou une néphropathie. Frank Birklein, de la clinique et polyclinique de neurologie de l’hôpital universitaire de Mayence (D), a expliqué en introduction que les yeux et les reins devaient toujours être pris en compte lors du diagnostic. La seule exception à cette règle est la neuropathie à petites fibres (SFN), qui peut précéder le diabète. 50% des diabétiques présentent une PNP électrophysiologique, et chez 16% d’entre eux, la PNP est douloureuse. Un quart des diabétiques présentent cliniquement une PNP. 40% des dPNP douloureux ne sont pas traités.
D’un point de vue physiopathologique, la dPNP entraîne des modifications de la métabolisation, en particulier du métabolisme du diabète. La voie des polyols et les produits finaux de glycation avancée (AGE) sont importants ici, car ils s’accumulent et endommagent les neurones et surtout les axones. En outre, on observe des modifications dans les canaux ioniques, en particulier les canaux de potassium et de sodium, et des défauts mitochondriaux, ce qui entraîne finalement un manque d’énergie pour les neurones. Il ne faut pas non plus oublier que des changements structurels se produisent, notamment au niveau des vaisseaux sanguins. Sur le plan vasculaire, cela se traduit par le fait que les veines et les artères des neuropathies de contrôle sont morphologiquement normales, alors que chez les diabétiques, l’artère est rétrécie et se “gonfle”, il y a donc une artériolopathie, les veines sont en partie congestionnées. En fin de compte, un nerf diabétique manque d’oxygène et est hypoxique.
Diagnostic
La première étape du diagnostic devrait être la mesure des vitesses de conduction nerveuse (NLG) – soit effectuée par le patient lui-même, soit par un collègue neurologue de confiance, comme l’a expliqué le professeur Birklein : “Je crois toujours les valeurs normales obtenues dans un cabinet médical, alors que les valeurs pathologiques ne sont pas toujours correctes, par exemple parce que le patient n’a pas été correctement échauffé. Des extrémités froides entraînent un ralentissement de la vitesse de conduction nerveuse”. Au programme de la mesure de la NLG, deux nerfs, moteur et sensitif, font partie du membre supérieur. Le professeur Birklein recommande au moins le cubital, car le médian présente souvent un syndrome du canal carpien (SCC) et il peut y avoir des erreurs de diagnostic si l’on n’en est pas conscient. “Et les patients diabétiques ont maintenant très souvent un SCT”. Au niveau des membres inférieurs, il convient de s’intéresser à deux nerfs moteurs (tibialis, péroné) et, sur le plan sensitif, au nerf sural. L’expert a rappelé que la vitesse de conduction nerveuse d’un diabétique n’évolue guère sur une période pouvant aller jusqu’à cinq ans et qu’elle se maintient généralement à un niveau réduit. Il en va différemment pour les amplitudes des potentiels d’action motrice cumulés que l’on peut stimuler en mesurant le péroné, par exemple. ici, il diminue progressivement sur une période de 2 ans. Cela signifie que les axones se cassent lors de la dPNP. “Ce n’est pas une neuronopathie, mais une axonopathie dying back”, a expliqué le neurologue. Les fibres nerveuses les plus longues sont affectées en premier et les axones meurent. De ce fait, l’amplitude est de plus en plus faible.
Si la NLG est normale, le patient n’a pas de PNP. En règle générale, l’examen neurologique est alors également normal, mais la personne concernée ressent tout de même des douleurs brûlantes (sfPNP au stade précoce). Dans ce cas, il est tout à fait suffisant de déterminer les seuils froids et chauds selon le protocole QST* pour diagnostiquer la sfPNP. Le médecin constate alors la perte de la sensation de froid et de chaud. Le froid correspond à une fonction delta, les nocicepteurs à conduction rapide sont donc la même classe de fibres, et le chaud est la classe C, les nocicepteurs à conduction lente. Le seuil de froid des personnes en bonne santé au niveau du pied part de 32°C – une réduction de 4°C est ressentie par un sujet en bonne santé, alors que chez les patients, ce n’est le cas qu’à partir de 12°C. Au seuil chaud, c’est-à-dire mesuré à partir de 32°C après des températures plus chaudes, les personnes en bonne santé ont besoin d’une différence d’environ 6°C au niveau du pied pour ressentir quelque chose, les patients atteints de PNP ou de diabète ont besoin d’une différence proportionnellement plus importante. Cela reste également constant sur deux ans avec une légère augmentation.
(* Test sensoriel quantitatif)
Si la mesure des seuils chauds et froids ne permet pas de résoudre le problème, la norme pour le diagnostic d’une sfPNP est la biopsie cutanée, proposée par de nombreux laboratoires de neuropathologie.
Prévention
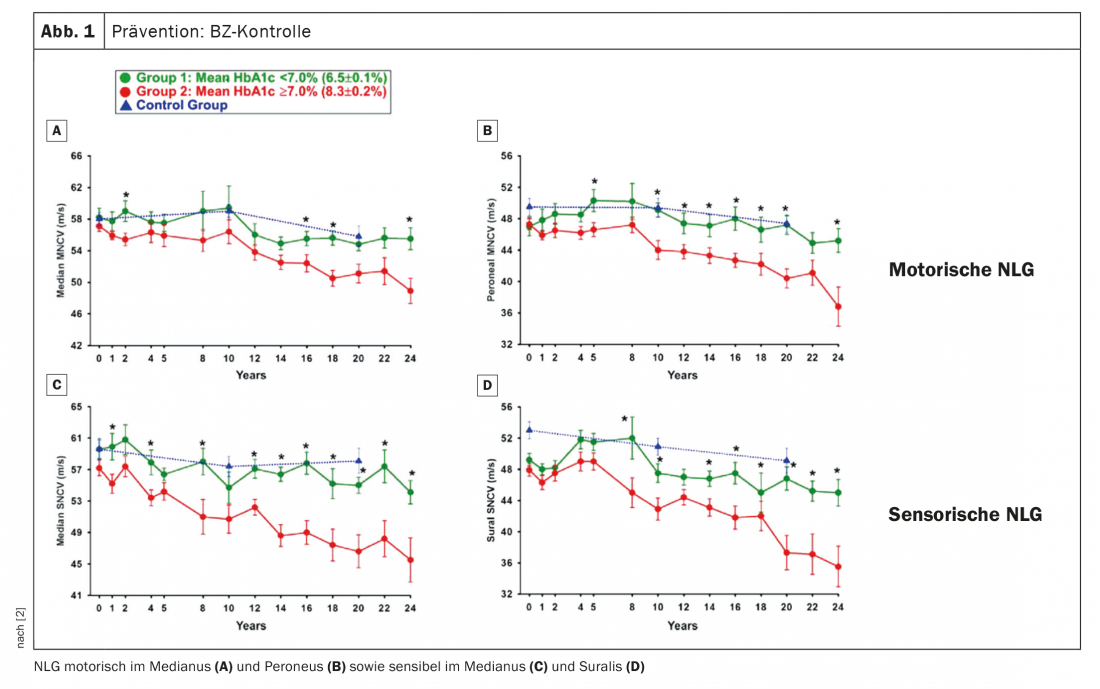
Comment prévenir l’apparition ou la progression d’une dPNP ? Tout d’abord, le contrôle de la glycémie (taux de sucre dans le sang) est évident. Le professeur Birklein a fait référence à un travail dans lequel les vitesses de conduction nerveuse ont été mesurées sur plus de 20 ans (Fig. 1). On peut y voir que la NLG de témoins sains diminue légèrement sur une période de deux décennies, mais que c’est tout à fait normal. Des patients avec une HbA1c ≥7, c’est-à-dire un contrôle conventionnel de la GL, ont été comparés à des patients avec un contrôle intensifié de la GL. Ce que l’on constate, c’est que les patients dont le contrôle de la glycémie a été intensifié dans le cas du diabète de type 1 ont une évolution que l’on attend également chez les personnes en bonne santé. “Si le diabète est bien contrôlé, vous n’aurez pas de PNP pendant de nombreuses années”, a conclu l’expert. En revanche, s’il est moins bien contrôlé, une PNP se développe. Conclusion : le contrôle de la glycémie est essentiel, surtout chez les jeunes qui développent un diabète. Il est donc recommandé d’intensifier le recrutement.
Dans le cas du diabète de type 2, la situation est légèrement différente. Ce sont surtout les facteurs de risque cardiovasculaire qui doivent être pris en compte : Hypertension, tabagisme, IMC, triglycérides, et bien sûr HbA1c. “Les facteurs cardiovasculaires de la PNP ne sont pas bien connus, mais il suffit de penser aux modifications vasculaires du nerf périphérique”, a rappelé le professeur Birklein.
15% des patients dPNP ont des douleurs
Mais pourquoi 15% des patients dPNP souffrent-ils ? Tout d’abord, il ne faut pas oublier une chose, dit-il : Tous les patients qui ont un diabète et une dPNP n’ont pas forcément des douleurs neuropathiques. Les patients atteints de diabète et de neuropathie avancée peuvent également développer, par exemple, une gonarthrose ou une synovite, qui sont responsables de la douleur. Il faut toujours garder ces possibilités à l’esprit.
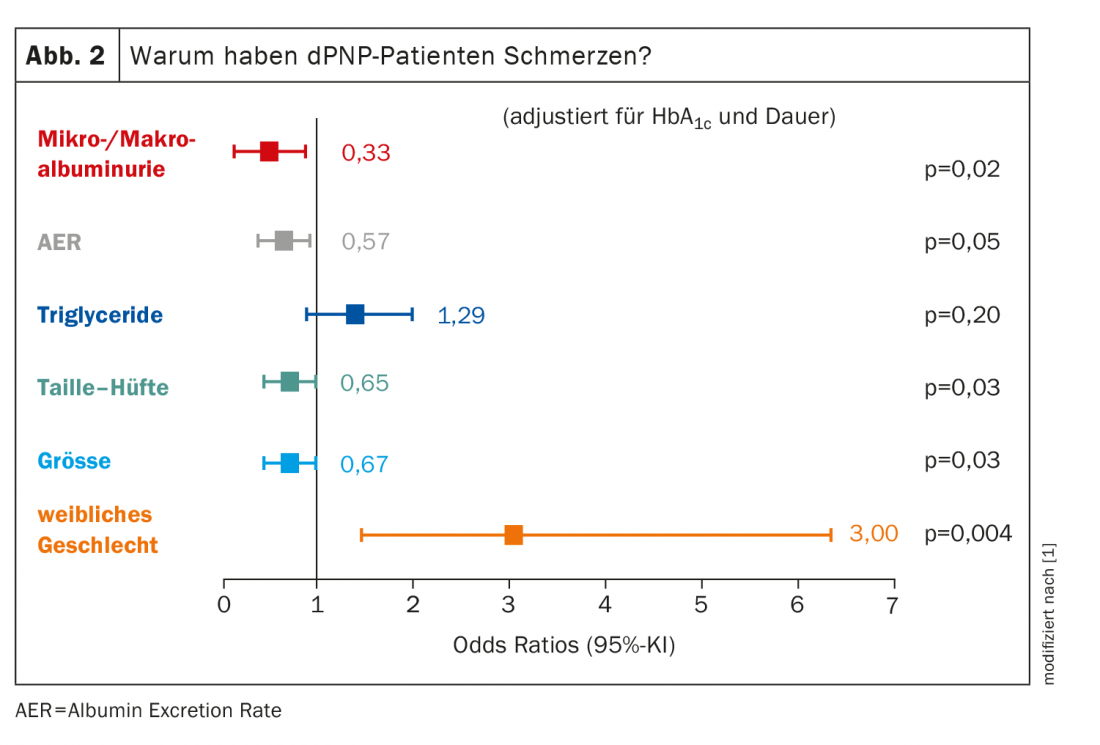
En ce qui concerne le groupe de patients souffrant de PNPd et dont la cause est réellement une polyneuropathie, ce sont surtout les femmes qui sont concernées : Les femmes ont un odds ratio de 3,00 pour la PNP douloureuse. Tous les autres facteurs ont une importance nettement moindre (figure 2). La taille joue un rôle, ce qui peut paraître surprenant au premier abord. Mais plus les axones sont longs, plus il y a de chances qu’ils soient endommagés. “Nous devons toujours garder à l’esprit que le métabolisme de l’axone entier est effectué dans le neurone – plus précisément dans le ganglion de la racine postérieure, en ce qui concerne les fibres de la douleur – et doit être transporté jusqu’aux terminaisons nerveuses. Et plus elles sont grandes, plus la probabilité que quelque chose se passe mal en cours de route est grande”. Le dPNP est d’autant plus douloureux que le nombre d’axones endommagés est élevé.
D’où proviennent donc les douleurs neuropathiques ? Lorsqu’il y a une lésion de l’axone, le neurone devient électriquement instable et s’active spontanément, a expliqué le médecin spécialiste de la douleur. Cela se fait par le biais de canaux de sodium (Na+). Lorsque les canaux sodiques sont bloqués, un neurone endommagé qui a été axotomisé redevient également complètement calme. L’activation des canaux sodiques fonctionne probablement via le méthylglyoxal. Le glucose est transformé en méthylglyoxal dans le plasma. La glyoxalase – une enzyme qui est ici l’étape de limitation du taux – entraîne ensuite la transformation du méthylglyoxal en lactate. Si la glyoxalase ne fonctionne pas bien, le méthylglyoxal finit par s’accumuler. Les mesures du méthylglyoxal dans le plasma ont montré que les patients diabétiques sans douleur présentent une quantité élevée de méthylglyoxal – parce qu’ils ont naturellement aussi plus de glucose que les personnes en bonne santé. Cependant, les patients souffrant de douleurs ont encore une fois une quantité de méthylglyoxal dans le sang nettement plus élevée que les patients non douloureux.
Traitement de la dPNP
En ce qui concerne le traitement des patients atteints de polyneuropathie diabétique, le professeur Birklein a cité un certain nombre d’options pharmacologiques considérées comme des traitements de première intention :
- Anticonvulsivants (bloqueurs des canaux Ca – gabapentine, prégabaline)
- Antidépresseurs tricycliques
- Inhibiteurs de la recapture de la sérotonine et de la noradrénaline (SSNRI) (duloxétine)
- Patch à la capsaïcine
- Patch à la lidocaïne
Selon les lignes directrices S2 actuelles, la carbamazépine, l’oxcarbazépine, la lamotrigine, la venlafaxine et les cannabinoïdes, entre autres, peuvent également être envisagés au cas par cas. Le professeur Birklein n’est pas convaincu par les options de pansements, “il faudrait alors recouvrir la moitié de la jambe de certains patients, et ce n’est pas très esthétique”. Il a également rappelé les possibilités non médicamenteuses, tout en sachant que de nombreuses personnes préfèrent prendre des pilules plutôt que de faire de l’exercice. Si ni les médicaments ni l’exercice n’apportent les résultats escomptés, il reste la stimulation électrique à proximité de la moelle épinière (SCS), qui a donné de bons résultats dans des études sur des patients souffrant de PNP.
– Congrès allemand sur la douleur 2020, Mannheim (D) et en ligne
Sources :
- Polyneuropathie diabétique : du banc au lit. Nouvelles données sur la physiopathologie, le diagnostic et le traitement. Congrès allemand sur la douleur Mannheim, 22.10.2020
- Ziegler D, et al. : BMJ Open 2015 ; 5 : e006559 ; doi : 10.1136/bmjopen-2014-006559
InFo DOULEUR & GERIATRIE 2020 ; 2(2) : 24-25 (publié le 9.12.20, ahead of print)