La chirurgie est la principale forme de traitement du méningiome, suivie par la radiothérapie. Cette dernière est utilisée pour les tumeurs de haut grade, celles dont les résidus ne peuvent pas être enlevés ou pour certains méningiomes de la base du crâne.
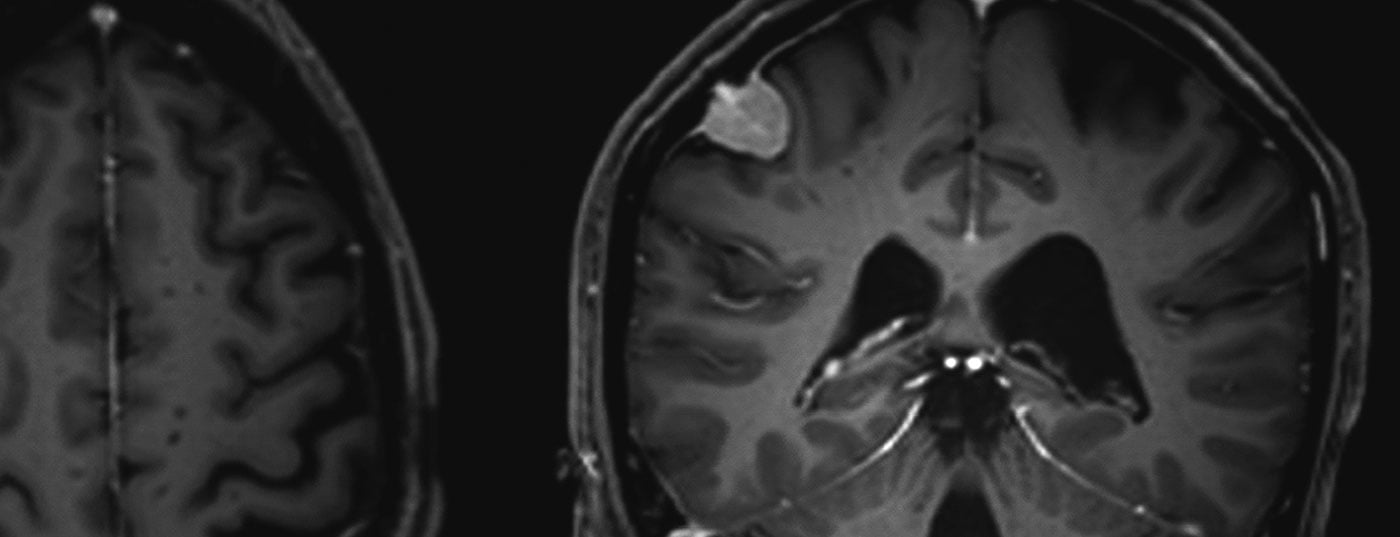
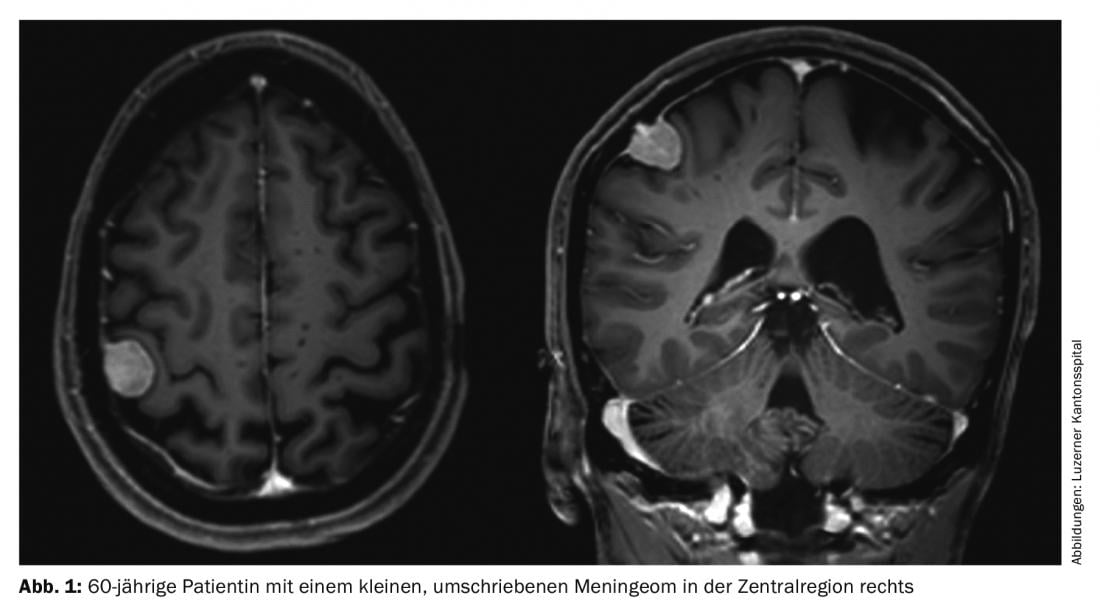
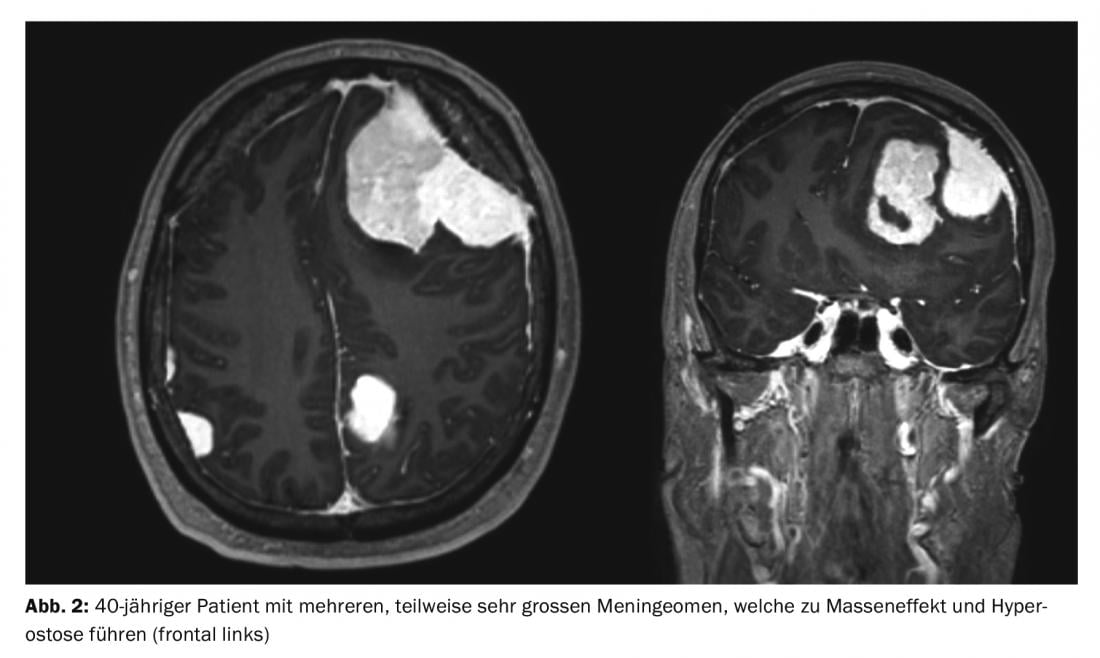
Les méningiomes représentent environ un tiers de toutes les tumeurs primaires du système nerveux central. Une incidence de 7,61/100 000 habitants est rapportée aux États-Unis entre 2008 et 2012 [1]. Il s’agit très majoritairement de tumeurs bénignes à croissance lente. Ceux-ci peuvent affecter l’ensemble de l’axe neuronal. Elles proviennent des cellules méningothéliales arachnoïdiennes et sont donc généralement situées en intracrânien-extra-axial (crânien) ou en intradural-extramédullaire (spinal). Les tumeurs multiples sont présentes dans 8% des cas (fig. 1 et 2) [2], en particulier dans les syndromes génétiques comme la neurofibromatose. Une localisation spinale est observée dans environ 10% des cas. Les méningiomes intracrâniens sont le plus souvent localisés le long du falx cerebri, de l’aile cunéiforme ou au-dessus de la convexité [3].
Histologie et classification OMS 2016
Selon la classification des tumeurs cérébrales de l’OMS, les méningiomes sont classés en grades I (bénins), II (atypiques) et III (méningiomes anaplasiques, susceptibles de métastaser au niveau systémique et présentant des taux de rechute élevés après résection) [4].
Le diagnostic de méningiome est généralement histologique sur des coupes colorées à l’hématoxyline et à l’éosine, sur la base de critères typiques tels que la formation de vertèbres, les pseudo-inclusions nucléaires ou la mise en évidence de corps psammiques (calcifications concentriques stratifiées) [4,5]. Le diagnostic histologique peut être confirmé par immunohistochimie, par exemple pour les marqueurs de l’antigène des membranes épithéliales (EMA) ou du récepteur 2a de la somatostatine.
Depuis la nouvelle classification de l’OMS de 2016, l’invasion du tissu cérébral, qui n’est pas rare en soi, est désormais considérée comme un critère de grade II de l’OMS (méningiome atypique), même si aucun autre critère d’atypie n’est présent [4]. Cela repose sur les taux comparables de rechute et de mortalité des méningiomes avec invasion du parenchyme cérébral et de ceux qui contiennent des signes histologiques d’atypie [6]. En outre, ces critères d’atypie s’appliquent (au moins trois des cinq critères histologiques suivants sont remplis) :
- Nécrose
- Sheeting (perte de la formation de tourbillons ou
- histoarchitecture fasciculaire)
- Des nucléoles célèbres
- Haute cellularité
- Petites cellules [4,6].
Les méningiomes anaplasiques de grade III de l’OMS, environ 2% de tous les méningiomes, présentent une fréquence élevée de mitoses (>20 mitoses dans dix champs visuels) et d’invasion du tissu cérébral, présentent souvent des rechutes précoces même après résection totale et peuvent très rarement métastaser en dehors du système nerveux central [7].
Marqueurs moléculaires
Le diagnostic moléculaire joue également un rôle de plus en plus important dans les méningiomes. Par exemple, il existe des preuves préliminaires que les mutations de la télomérase transcriptase inverse (TERT) entraînent une croissance tumorale plus agressive dans les méningiomes, indépendamment du grade OMS individuel [8,9].
La plupart des méningiomes ne possèdent qu’une copie du bras long du chromosome 22 (22q) [10]. La neurofibromatine 2, un gène localisé en 22q, est en outre souvent mutée, y compris dans la neurofibromatose 2, qui se caractérise entre autres par de multiples méningiomes [11]. Certaines aberrations chromosomiques, telles que la perte du bras court du chromosome 1 (1p), du bras long du chromosome 10 (10q) ou 14 (14q), sont associées à un risque accru de malignité et de récidive [12,13]. Des recherches intensives sont menées dans le but d’intégrer les marqueurs moléculaires dans la classification de l’OMS, comme c’est le cas pour d’autres tumeurs cérébrales, et de permettre ainsi un diagnostic plus ciblé et éventuellement, à l’avenir, un traitement plus personnalisé dans le sens de ce que l’on appelle les “thérapies ciblées”.
Clinique
La clinique dépend de la localisation et de la taille des méningiomes. Les méningiomes supratentoriels peuvent se manifester par des déficits neurologiques de tout type ou des crises d’épilepsie. En cas d’épilepsie symptomatique, les patients sont mis sous traitement antiépileptique, qui peut être arrêté après l’ablation complète des méningiomes au cours des quelques semaines postopératoires qui suivent la normalisation de l’électroencéphalographie. Les méningiomes spinaux entraînent typiquement des douleurs nocturnes, généralement diffuses, mais qui peuvent aussi être radiculaires en forme de ceinture au niveau de la tumeur. Il n’est pas rare qu’une paraparésie d’apparition insidieuse et d’évolution lente, se manifestant initialement simplement par des troubles de la marche, soit diagnostiquée tardivement, car il s’agit généralement de patients âgés, chez qui d’autres formes de troubles de la marche sont fréquentes. Comme la clinique n’est généralement pas causée par une invasion par la tumeur elle-même, mais par une compression locale, le pronostic de récupération des déficits neurologiques est favorable si l’opération est réalisée rapidement.
En raison de l’utilisation croissante de l’IRM dans la pratique clinique quotidienne, les méningiomes sont de plus en plus souvent découverts par hasard (dans jusqu’à 1% de toutes les IRM).
Imagerie
L’imagerie par résonance magnétique avec renforcement du contraste est généralement utilisée pour le diagnostic et le suivi des méningiomes, ou en cas de contre-indication, la tomodensitométrie avec renforcement du contraste [14,15].
L’IRM de perfusion peut être utilisée pour établir un diagnostic différentiel avec d’autres entités, car les méningiomes ont généralement un volume sanguin cérébral relatif (rCBV) élevé et ne présentent pas d’autres lésions (par exemple, des métastases durales) [16]. En utilisant des ligands peptidiques tels que le 90Y-Dotatoc ou le 68Ga-Dotatate comme traceurs pour la tomographie par émission de positrons (TEP), l’expression du récepteur 2 de la somatostatine peut être utilisée pour différencier les méningiomes des tissus sains [17,18]. En spectroscopie de résonance magnétique, les méningiomes présentent un pic d’alanine caractéristique entre 1,3 et 1,5 ppm (“parties par million”) [19].
Gestion et thérapie
De nos jours, les méningiomes sont souvent découverts par hasard : une IRM pour déterminer la cause d’un mal de tête révèle rarement une cause de douleur, mais il n’est pas rare qu’il s’agisse d’une découverte fortuite. En ce qui concerne la prise en charge ultérieure de ces lésions asymptomatiques avec un suivi clinique et d’imagerie d’abord tous les six mois puis tous les ans, il existe peu de preuves dans la littérature et elles sont relativement faibles [14,20–22]. Si un traitement est nécessaire en raison de symptômes cliniques ou d’une croissance documentée par l’imagerie, la résection microneurochirurgicale est pratiquement toujours le traitement de premier choix [14]. L’objectif de la chirurgie doit être – chaque fois que possible – une résection complète de la tumeur, y compris la dure-mère et l’os atteints. L’étendue de la résection des méningiomes et, en conséquence, leur risque de récidive sont toujours classés selon la classification de Simpson de 1957 [23] (tab. 1) [22,24].
L’embolisation préopératoire des méningiomes peut dans certains cas simplifier une opération, par exemple lorsque l’apport sanguin à la tumeur ne peut pas être bien contrôlé par voie chirurgicale ou seulement à la fin de la résection pour des raisons anatomiques. Les méningiomes de grade III de l’OMS, c’est-à-dire anaplasiques, doivent être opérés chirurgicalement de la manière la plus radicale possible afin de réduire autant que possible le risque de récidive et de métastases [14].
Pour les petites tumeurs, pour celles qui ne peuvent pas être opérées ou seulement de manière incomplète, en cas de localisation dans la région du sinus caverneux ou de la pointe de l’os temporal ou chez les patients âgés et présentant une comorbidité élevée, la radiochirurgie (irradiation stéréotaxique à dose unique convergente) peut être utilisée. Dans certains cas, par exemple pour les tumeurs de grande taille dans la région de la pointe de l’os du rocher ou du sinus caverneux, la dose de rayons peut également être appliquée sous forme de radiothérapie fractionnée en plusieurs doses. Dans le cas des méningiomes de grade II de l’OMS, le recrutement des patients est en cours pour l’étude ROAM/EORTC 1308 (ISRCTN71502099), dans laquelle les patients ayant subi une résection tumorale correspondant aux grades I-III de Simpson sont assignés au hasard à une radiothérapie ou à un placebo en postopératoire précoce, afin de déterminer si la radiothérapie peut réduire le risque de récidive tumorale ou prolonger la période sans récidive [25]. Actuellement, une radiothérapie fractionnée adjuvante est recommandée pour les méningiomes de grade II de l’OMS ayant subi une résection incomplète ou pour les tumeurs de grade II de l’OMS ayant progressé [26–28], même si certaines études ont montré des résultats incertains ou aucun avantage convaincant [29–32]. De même, pour les méningiomes de grade III de l’OMS, il est recommandé d’effectuer une radiothérapie fractionnée en postopératoire, quelle que soit l’étendue de la résection [14].
La pharmacothérapie joue un rôle tout à fait secondaire dans le traitement des méningiomes. Cela pourrait changer à l’avenir avec la découverte de cibles potentielles pour les “thérapies ciblées”.
Opération
Un méningiome est enlevé par une technique microchirurgicale. En cas de localisation à proximité de structures éloquentes telles que le tronc cérébral ou la moelle épinière, l’opération est réalisée avec un monitoring neurophysiologique peropératoire, notamment avec des potentiels évoqués moteurs.
Pour les tumeurs intracrâniennes, la technologie de neuronavigation est utilisée pour la planification de l’opération afin d’obtenir un accès aussi centré que possible sur la tumeur. Celui-ci doit être le plus petit et le moins traumatisant possible, tout en étant suffisamment grand pour permettre de voir suffisamment les bords de la tumeur. Spinal, la localisation en hauteur se fait simplement par radiographie ou fluoroscopie. Après la laminotomie ou l’hémilaminectomie et avant l’ouverture de la dure-mère, l’exposition correcte est contrôlée par échographie. Pour l’accès, les lamines des corps vertébraux concernés sont réinsérées et refixées avec des mini-plaquettes de titane (laminotomie/laminoplastie). De plus en plus souvent, on utilise des voies d’abord mini-invasives, comme les hémilaminectomies, qui ne nécessitent qu’une exposition unilatérale et permettent une guérison plus rapide et moins douloureuse.
Après la réalisation de la craniotomie, les méningiomes sont retirés le plus complètement possible, de préférence en un seul morceau et avec leur point d’attache sur la dure-mère. L’os atteint est également retiré si cela est techniquement possible. La dure-mère est reconstruite avec des matériaux propres (périoste du crane) ou étrangers (patchs de remplacement de la dure-mère en matériaux synthétiques ou xénogéniques). Une telle résection avec ablation complète de la tumeur, y compris l’excision de la base durale et l’excision de l’os atteint, est classée selon le grade I de Simpson (tab. 1). Dans les cas où cela n’est pas techniquement possible, par exemple près de la base du crâne, une résection moins destructrice (Simpson grade II-III) est pratiquée. Les biopsies (Simpson V) pour les méningiomes sont une exception extrêmement rare.

En postopératoire, les patients sont surveillés de manière standard pendant une nuit en unité de soins intensifs. Le premier jour postopératoire, une IRM est également réalisée de manière standard pour documenter la tumeur résiduelle et les éventuelles complications (ischémies, hémorragies, hydrocéphalie). Une quantité importante et inattendue de tumeur résiduelle, qui pourrait conduire à une réopération précoce, n’est presque jamais observée dans les opérations de méningiome. La durée moyenne d’hospitalisation est de quatre à cinq jours en cas d’évolution non compliquée et la convalescence est d’environ six semaines.
Suivi des patients
Le suivi postopératoire se fait par des examens IRM en série. Pour les méningiomes de grade I de l’OMS, un intervalle annuel est recommandé pendant les cinq premières années, puis un intervalle de contrôle clinique et d’imagerie tous les deux ans [14]. Pour les méningiomes de grade II de l’OMS, un intervalle de contrôle plus court de six mois est recommandé [33], et pour les méningiomes de grade III de l’OMS, un intervalle de contrôle de trois à six mois est même recommandé [14].
Prévisions
Le taux de survie à 5 ans de tous les méningiomes réunis est d’environ 90% et dépend principalement du taux de récidive (grade I de l’OMS : 10%/grade II de l’OMS : 30%/grade III de l’OMS : 50%) [34].
L’étendue de la résection des tumeurs selon la gradation de Simpson (tableau 1) estsurtout liée au pronostic pour les méningiomes de la convexité, la gradation semble être moins pertinente pour les méningiomes de la falx ou de la base du crâne [35]. Dans l’ensemble, il semble y avoir un lien avec la survie sans récidive plutôt qu’avec la survie globale [36].
Messages Take-Home
- Jusqu’à nouvel ordre, le traitement chirurgical est la première et principale forme de traitement, suivi de la radiothérapie.
- La radiothérapie est utilisée pour les tumeurs de haut grade, celles dont les restes ne peuvent pas être enlevés ou pour certains méningiomes de la base du crâne.
- Les méningiomes avec invasion cérébrale sont considérés comme des tumeurs de grade II selon la nouvelle classification de l’OMS de 2016.
Littérature :
- Ostrom QT, et al : CBTRUS Statistical Report : Primary Brain and Central Nervous System Tumors diagnostiqués aux États-Unis en 2008-2012. Neuro Oncol 2015 ; 17(Suppl 4) : iv1-iv62.
- Sheehy JP, Crockard HA : Méningiomes multiples : une revue à long terme. J Neurosurg 1983 ; 59(1) : 1-5.
- Yamashita J, et al : Recurrence of intracranial meningiomas, with special reference to radiotherapy. Surg Neurol 1980 ; 14(1) : 33-40.
- Louis DN, et al : The 2016 World Health Organization Classification of Tumors of the Central Nervous System : a summary. Acta Neuropathol 2016 ; 131(6) : 803-820.
- Nowosielski M, et al : Défis diagnostiques dans le méningiome. Neuro Oncol 2017. DOI : 10.1093/neuonc/nox101 [Epub ahead of print].
- Perry A, et al : Meningioma grading : an analysis of histologic parameters. Am J Surg Pathol 1997 ; 21(12) : 1455-1465.
- Thomas HG, Dolman CL, Berry K : Méningiome malin : caractéristiques cliniques et pathologiques. J Neurosurg 1981 ; 55(6) : 929-934.
- Sahm F, et al : Mutations AKT1E17K cluster avec méningiomes méningothéliaux et transitionnels et peut être détecté par immunohistochimie SFRP1. Acta Neuropathol 2013 ; 126(5) : 757-762.
- Goutagny S, et al : Forte incidence de mutations activatrices du promoteur TERT dans les méningiomes en cours de progression maligne. Brain Pathol 2014 ; 24(2) : 184-189.
- Dumanski JP, et al : Deletion mapping of a locus on human chromosome 22 involved in the oncogenesis of meningioma. Proc Natl Acad Sci U S A 1987 ; 84(24) : 9275-9279.
- Rouleau GA, et al : L’altération d’un nouveau gène codant pour une protéine organisatrice de la membrane putative provoque la neuro-fibromatose de type 2. Nature 1993 ; 363(6429) : 515-521.
- Tabernero MD, et al : Caractérisation des anomalies du chromosome 14 par hybridation in situ en interphase et hybridation génomique comparative dans 124 méningiomes : corrélation avec les caractéristiques cliniques, histopathologiques et pronostiques. Am J Clin Pathol 2005 ; 123(5) : 744-751.
- Maillo A, et al : Les récurrences précoces dans les méningiomes histologiquement bénins/de grade I sont associées à des tumeurs de grande taille et à la coexistence de la monosomie 14 et du del(1p36) dans le clone de cellules tumorales ancestral. Neuro Oncol 2007 ; 9(4) : 438-446.
- Goldbrunner R, et al : EANO guidelines for the diagnosis and treatment of meningiomas. Lancet Oncol 2016 ; 17(9) : e383-391.
- Saloner D, et al : Techniques modernes d’imagerie du méningiome. J Neurooncol 2010 ; 99(3) : 333-340.
- Kremer S, et al : Contribution de l’imagerie IRM dynamique de contraste à la différenciation entre métastase durale et méningiome. Neuroradiologie 2004 ; 46(8) : 642-648.
- Collamati F, et al : Toward radioguided surgery with β- decays : uptake of a somatostatin analogue, DOTATOC, in meningioma and high-grade glioma. J Nucl Med 2015 ; 56(1) : 3-8.
- Rachinger W, et al : L’augmentation de la prise de 68Ga-DOTATATE dans l’imagerie PET discrimine le méningiome et les tissus sans tumeur. J Nucl Med 2015 ; 56(3) : 347-353.
- Majós C, et al : Méningiomes intraventriculaires : imagerie RM et résultats spectroscopiques RM dans deux cas. AJNR Am J Neuroradiol 1999 ; 20(5) : 882-885.
- Vernooij MW, et al : Incidental findings on brain MRI in the general population. N Engl J Med 2007 ; 357(18) : 1821-1828.
- Sughrue ME, et al : Prise de décision en matière de traitement basée sur l’histoire naturelle publiée et le taux de croissance des petits méningiomes. J Neurosurg 2010 ; 113(5) : 1036-1042.
- Sughrue ME, et al : The relevance of Simpson Grade I and II resection in modern neurosurgical treatment of World Health Organization Grade I meningiomas. J Neurosurg 2010 ; 113(5) : 1029-1035.
- Simpson D : La récurrence des méningiomes intracrâniens après traitement chirurgical. J Neurol Neurosurg Psychiatry 1957 ; 20(1) : 22-39.
- Gousias K, Schramm J, Simon M : The Simpson grading revisited : aggressive surgery and its place in modern meningioma management. J Neurosurg 2016 ; 125(3) : 551-560.
- Jenkinson MD, et al : The ROAM/EORTC-1308 trial : Radiation versus Observation following surgical resection of Atypical Meningioma : study protocol for a randomised controlled trial. Trials 2015 ; 16 : 519.
- Aghi MK, et al : Long-term recurrence rates of atypical meningiomas after gross total resection with or without postoperative adjuvant radiation. Neurosurgery 2009 ; 64(1) : 56-60 ; discussion 60.
- Komotar RJ, et al : Le rôle de la radiothérapie après la résection large-total des méningiomes atypiques. J Neurosurg 2012 ; 117(4) : 679-686.
- Park HJ, et al : Le rôle de la radiothérapie adjuvante dans le méningiome atypique. J Neurooncol 2013 ; 115(2) : 241-247.
- Hammouche S, et al. : Analyse de la survie à long terme des méningiomes atypiques : taux de survie, facteurs pronostiques, traitement chirurgical et radiothérapeutique. Acta Neurochir (Vienne) 2014 ; 156(8) : 1475-1481.
- Mair R, et al : Radiotherapy for atypical meningiomas. J Neurosurg 2011 ; 115(4) : 811-819.
- Stessin AM, et al : Does adjuvant external-beam radiotherapy improve outcomes for nonbenign meningiomas ? A Surveillance, Epidemiology, and End Results (SEER) -based analysis. J Neurosurg 2012 ; 117(4) : 669-675.
- Yoon H, et al : Méningiome atypique : des essais randomisés sont nécessaires pour résoudre les résultats rétrospectifs contradictoires concernant le rôle de la radiothérapie adjuvante. J Cancer Res Ther 2015 ; 11(1) : 59-66.
- Marosi C, et al : Méningiome. Crit Rev Oncol Hematol 2008 ; 67(2) : 153-171.
- Mahaley MS, et al : National survey of patterns of care for brain-tumor patients. J Neurosurg 1989 ; 71(6) : 826-836.
- Voss KM, et al : The Simpson grading in meningioma surgery : does the tumor location influence the pronostic value ? J Neurooncol 2017 ; 133(3) : 641-651.
- Nanda A, et al : Pertinence du système de classification de Simpson et de la survie sans récidive après chirurgie pour le méningiome de grade I de l’Organisation mondiale de la santé. J Neurosurg 2017 ; 126(1) : 201-211.
InFo ONKOLOGIE & HÄMATOLOGIE 2017 ; 5(6) : 11-15