Dans le cas du cancer colorectal, la chirurgie reste la seule chance de guérison. Le traitement primaire du cancer du côlon consiste en une résection oncologique de la partie de l’intestin où se trouve la tumeur. Dans le cas du cancer du rectum, la radiochimiothérapie néoadjuvante fait partie intégrante du concept thérapeutique pour les tumeurs avancées. Le pronostic des patients atteints de cancer du rectum a été révolutionné par l’introduction de la technique chirurgicale d’excision totale du mésorectum (TME) par Sir Bill Heald. Le même concept doit être appliqué aux cancers du côlon.
En préopératoire, tout patient atteint d’un cancer du côlon doit faire l’objet d’un staging adéquat, qui comprend, outre l’examen clinique, la détermination du taux de CEA. Afin de déterminer l’étendue locale de la tumeur et d’exclure un second cancer, il convient de toujours effectuer une coloscopie complète ou, en cas de tumeur sténosante, un lavement colique de contraste ou une coloscopie virtuelle. Pour exclure la présence de métastases, une échographie du foie et un scanner abdominal (voire thoracique) doivent être réalisés.
Traitement chirurgical du cancer du côlon
Le traitement primaire du cancer du côlon consiste en une résection locale R0 avec une marge de sécurité d’au moins 5 cm avec dissection oncologique des ganglions lymphatiques [1]. Comme le drainage lymphatique suit le trajet des vaisseaux artériels, la dépose des vaisseaux artériels à proximité de la sortie est un élément essentiel de la résection radicale de la tumeur avec dissection centrale des ganglions lymphatiques oncologiques (fig. 1).
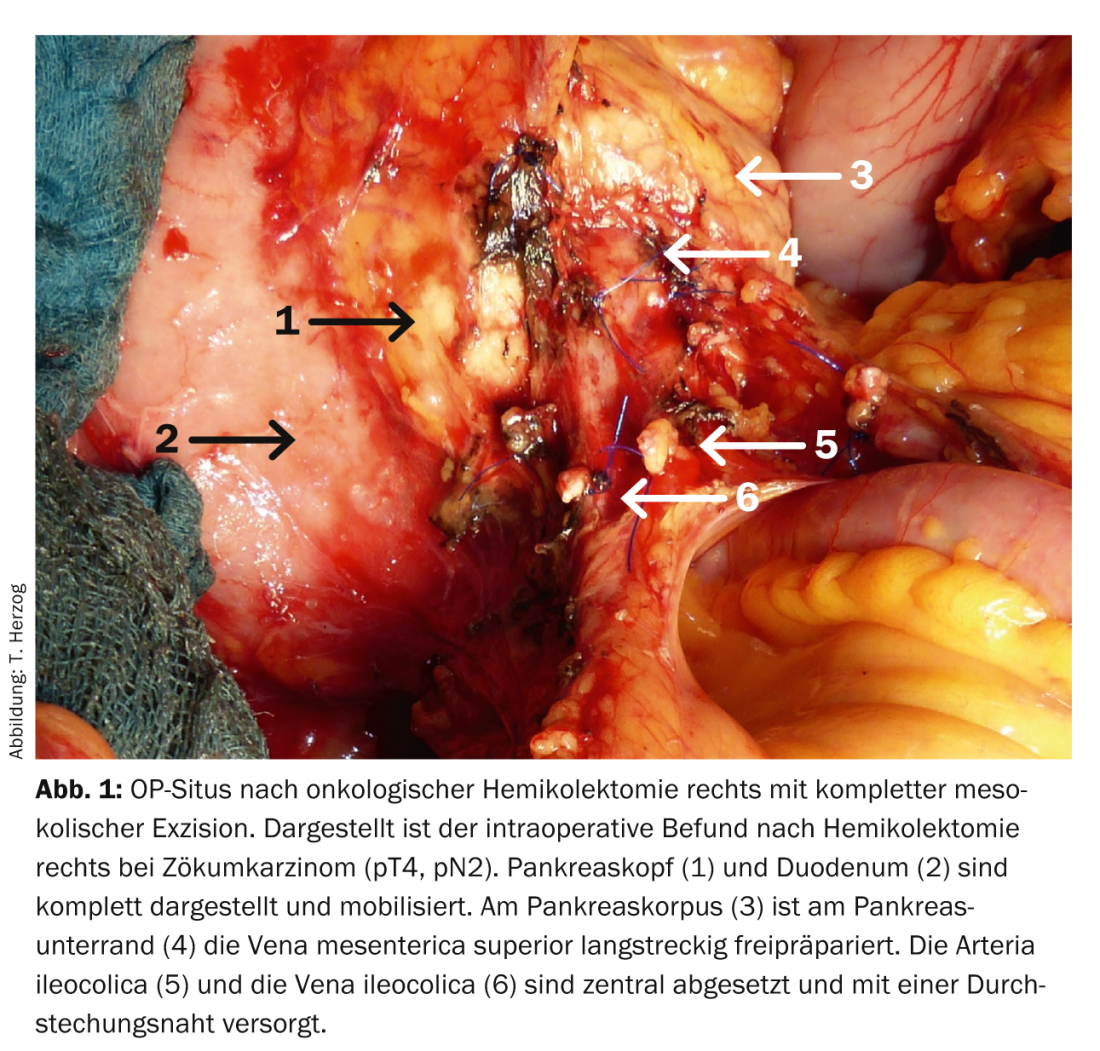
En outre, la résection doit être effectuée en préservant les couches de l’enveloppe embryonnaire, c’est-à-dire en préservant l’intégrité du mésocôlon, comme dans le cas de l’exérèse mésorectale totale (TME) du cancer du rectum, appelée “exérèse mésocolique complète” (CME) [2]. Pour un staging adéquat, au moins douze ganglions lymphatiques doivent être retirés et examinés sur le plan histo-pathologique, ce qui est pratiquement toujours garanti en cas de ligature centrale des vaisseaux [3].
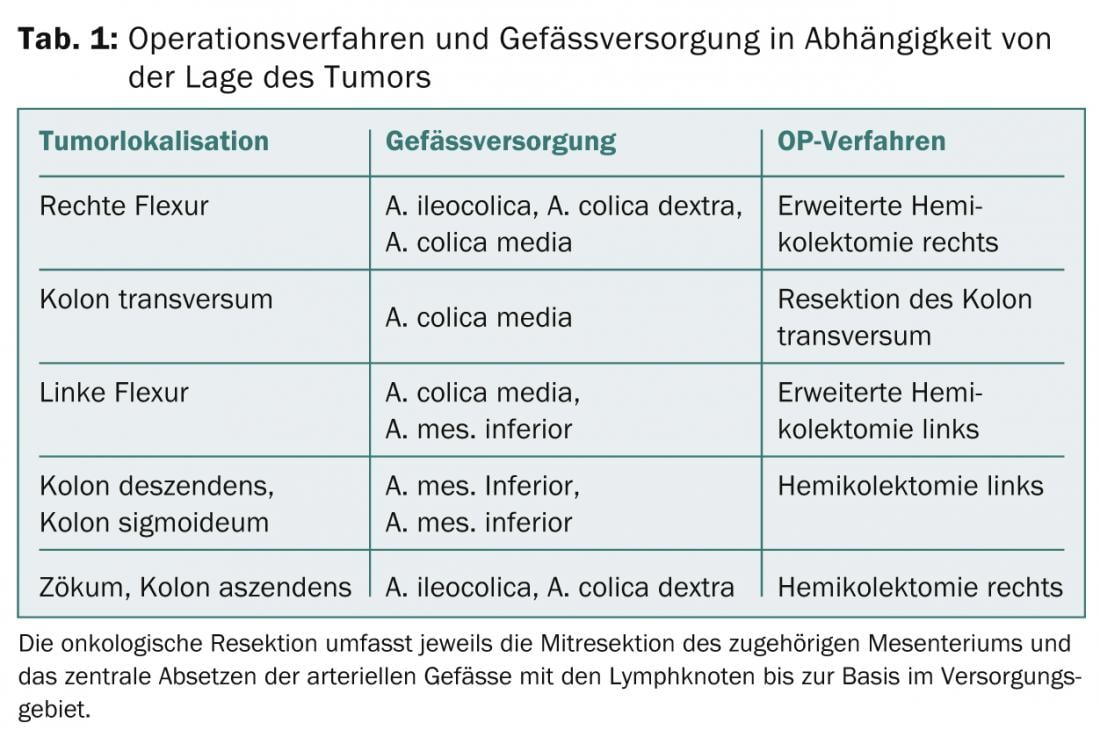
En raison de la vascularisation artérielle, la localisation de la tumeur conditionne la procédure chirurgicale (tab. 1). Pour obtenir une situation locale R0, la résection des organes voisins infiltrés est nécessaire et oncologiquement judicieuse pour les tumeurs T4. Les patients présentant des métastases hépatiques ou pulmonaires isolées doivent être présentés à un chirurgien disposant de l’expertise nécessaire et discutés dans le cadre de réunions interdisciplinaires sur les tumeurs.
En situation palliative, c’est le plus souvent la métastase hépatique qui est le facteur pronostique déterminant, de sorte qu’en l’absence d’obstruction, une résection tumorale primaire n’est pas toujours nécessaire. Il est toutefois important d’éviter une opération en urgence en cas de perforation tumorale ou d’obstruction avec iléus, car les opérations en urgence sont associées à un moins bon pronostic [4]. Dans cette mesure, la résection tumorale palliative pour la prophylaxie de l’iléus est tout à fait pertinente, à condition que la résection soit effectuée avec une faible morbidité. Alternativement, la mise en place mini-invasive d’une stomie peut être utile pour la prévention de l’iléus. La pose endoscopique de stents intestinaux intraluminaux peut être indiquée dans des cas exceptionnels d’obstruction du côté gauche, mais elle comporte également de nombreux risques et ne peut donc pas être recommandée de manière générale [5,6]. Après l’ablation endoscopique d’un carcinome T1 lorsque la base du polype est histologiquement exempte de carcinome (R0) et en situation de faible risque (G1, L0), il n’est pas nécessaire de procéder à une résection ultérieure, mais en situation de risque élevé, un traitement chirurgical oncologique radical doit être effectué.
Traitement chirurgical du cancer du rectum
Le concept de traitement multimodal des patients atteints de cancer du rectum doit être discuté en étroite collaboration avec les radiothérapeutes et les oncologues dans le cadre de conférences interdisciplinaires sur les tumeurs. L’objectif de tout traitement chirurgical du cancer du rectum est une résection locale R0. Pour le diagnostic préopératoire, l’endosonographie est aujourd’hui indispensable pour évaluer le statut des ganglions lymphatiques et l’IRM pelvienne pour évaluer les marges de résection circonférentielles. Comme pour le cancer du côlon, la meilleure façon d’évaluer les métastases à distance est de recourir à l’échographie et à la tomodensitométrie assistée par contraste. Pour les stades avancés de la tumeur (uT3 et uT4) et les métastases ganglionnaires régionales (uN+), une radiochimiothérapie néoadjuvante à base de 5-fluorouracile avec une dose de radiation de 50 Gray doit être effectuée [1,7].
L’introduction de l’excision totale du mésorectum (ETM) a révolutionné le traitement chirurgical des patients atteints de cancer du rectum. Cette technique a été introduite par Sir Bill Heald et s’est aujourd’hui établie comme le gold standard [8]. L’ETM s’oriente vers les fascias de l’enveloppe anatomo-embryonnaire du petit bassin et consiste en l’excision complète du corps adipeux mésorectal sans lésion de ces fascias de l’enveloppe du petit bassin. Cela permet d’éliminer complètement le tissu lymphatique entourant la tumeur localement autour du rectum, ce qui réduit significativement le risque de récidive locale à moins de 5% à long terme.
Pour les cancers du rectum du tiers inférieur à moyen du rectum (0-12 cm à partir de la ligne ano-cutanée), une ETM doit toujours être réalisée, tandis que pour les cancers du rectum du tiers supérieur du rectum (13-16 cm à partir de l’ano), une excision partielle mésorectale (PME) peut parfois être suffisante. En respectant cette couche de préparation, les nerfs sacrés importants peuvent toujours être préservés. La qualité de l’excision mésorectale est importante, car il existe une corrélation directe entre la qualité chirurgicale de la préparation de l’ETM et la survie globale [9,10]. Pour réaliser une dissection adéquate des ganglions lymphatiques, l’artère mésentérique inférieure doit être sectionnée au centre, environ 2 cm après sa sortie de l’aorte, en préservant l’origine des nerfs sacrés.
Les opérations de préservation de la continence sont possibles pour les tumeurs jusqu’à 1 cm à partir de l’ano. Selon la hauteur de la tumeur, la reconstruction se fait sous forme de descendo-rectostomie ou d’anastomose colo-anale. La reconstruction doit inclure la formation d’une poche, les résultats à long terme après coloplastie transversale (“Berner Pouch”) et J-Pouch étant équivalents [11].
La pose d’une iléostomie réduit la mortalité
La mise en place d’une iléostomie double temporaire et protectrice devrait être effectuée pour toutes les résections rectales du tiers inférieur et moyen du rectum, car elle permet de réduire la morbidité et la mortalité [12]. Pour les tumeurs infiltrant le sphincter, la radicalité chirurgicale prime sur la préservation du sphincter. Pour les patients présentant une infiltration sphinctérienne, l’exérèse rectale abdominopérinéale avec colostomie terminale est une alternative de traitement pertinente. Les résultats fonctionnels après résection rectale dépendent de la hauteur de l’anastomose ; les patients ayant subi une radiothérapie préopératoire et une anastomose colo-anale présentent le risque d’incontinence le plus élevé.
Dans le cas du cancer précoce du rectum, le risque de métastases lymphogènes dépend de la profondeur d’infiltration de la tumeur dans la paroi rectale. Pour les cancers précoces avec infiltration du tiers supérieur ou moyen de la sous-muqueuse (T1sm1 ou T1sm2), la microchirurgie endoscopique transanale locale (MET) est une alternative à l’approche ouverte avec MET, si cette excision peut être réalisée avec une marge de sécurité appropriée.
Prof. Dr. med. Waldemar Uhl
Littérature :
- Pox C, et al. : [S3-guideline colorectal cancer version 1.0]. Z Gastroenterol 2013 ; 51 : 753-854.
- Hohenberger W, et al. : Standardized surgery for colonic cancer : complete mesocolic excision and central ligation – technical notes and outcome. Colorectal Dis 2009 ; 11 : 354-364 ; Discussion 364-355.
- Chang GJ, et al : Lymph node evaluation and survival after curative resection of colon cancer : systematic review. J Natl Cancer Inst 2007 ; 99 : 433-441.
- Bass G, et al : Emergency first presentation of colorectal cancer predicts significantly powerful outcomes : a review of 356 consecutive Irish patients. Dis Colon Rectum 2009 ; 52 : 678-684.
- Cirocchi R, et al : Sécurité et efficacité du stenting colique endoscopique en tant que passerelle vers la chirurgie dans la gestion de l’obstruction intestinale due au cancer du côlon gauche et du rectum : une revue systématique et une méta-analyse. Surg Oncol 2013 ; 22 : 14-21.
- Pirlet IA, et al : Stenting préopératoire d’urgence versus chirurgie pour l’obstruction colique maligne aiguë gauche : un essai contrôlé randomisé multicentrique. Surg Endosc 2011 ; 25 : 1814-1821.
- Sauer R, et al : Chimioradiothérapie préopératoire versus postopératoire pour le cancer rectal. N Engl J Med 2004 ; 351 : 1731-1740.
- Heald RJ, Ryall RD : Récurrence et survie après excision mésorectale totale pour cancer rectal. Lancet 1986 ; 1 : 1479-1482.
- Maslekar S, et al : Les grades mésorectaux prédisent les récidives après résection curative pour cancer rectal. Dis Colon Rectum 2007 ; 50 : 168-175.
- Herzog T, et al : TME quality in rectal cancer surgery. Eur J Med Res 2010 ; 15 : 292-296.
- Biondo S, et al : Résultats fonctionnels à long terme d’une étude clinique randomisée de coloplastie transversale par rapport à une poche en J du côlon après résection antérieure basse pour cancer rectal. Surgery 2013 ; 153 : 383-392.
- Ulrich AB, et al : Diverting stoma after low anterior resection : more arguments in favor. Dis Colon Rectum 2009 ; 52 : 412-418.
InFo Oncologie & Hématologie 2014 ; (2)7 : 7-9