L’objectif de la chirurgie du cancer du pancréas est d’enlever la tumeur en milieu sain avec la meilleure marge de sécurité possible entre les bords de la tumeur et les surfaces de résection. Les tumeurs résécables sont celles pour lesquelles l’espérance de vie est la plus longue. Les cancers du pancréas limite résécables sont définis en fonction du degré d’infiltration des organes voisins. Dans la nouvelle ligne directrice S3, le bord de coupe est décrit de manière plus précise qu’auparavant dans l’expertise histopathologique. Un pronostic défavorable doit être déduit si le rapport entre les ganglions lymphatiques atteints et les ganglions lymphatiques sans tumeur (ratio lymphatique) est ≥0,2. Les thérapies néoadjuvantes semblent être une option très prometteuse.
Le taux de survie à 5 ans du cancer du pancréas reste le plus faible de toutes les tumeurs malignes dans le monde, soit 8%. Le traitement chirurgical reste néanmoins essentiel, car il s’agit de la seule procédure potentiellement curative [1]. Le diagnostic préalable est complet et prévoit, outre les enquêtes de base, les examens suivants :
- Laboratoire de routine
- Marqueurs tumoraux CA 19-9 et CEA
- HbA1c
- Diagnostic fonctionnel avec élastase fécale et test de détection du glucose par voie orale
- Radiographie du thorax
- Sonographie
- Couche mince renforcée par un agent de contraste
- CT-abdomen
- Cholangiopancréatographie par résonance magnétique (MRCP)
- Œsophago-gastro-duodénoscopie
- Endosonographie
- Cholangiopancréatographie rétrograde endoscopique (CPRE) avec tentative de prélèvement ou de pose de stent en cas d’ictère sévère.
Dans des cas sélectionnés, une laparoscopie de stadification doit être discutée : Lorsque l’imagerie ne montre pas de résultats clairs concernant une métastase dans le péritoine et/ou le foie, mais qu’une métastase est probable en raison d’un taux élevé de CA 19-9 de >1000 U/ml, ou lorsque la tentative endosonographique préalable de confirmation biopsique du malignome a échoué [2].
Un traitement néoadjuvant peut permettre d’augmenter la probabilité d’une résection en fonction du degré de réponse et de rendre possible une résection ultérieure de la tumeur. Les tumeurs qui ne sont pas raisonnablement résécables doivent être traitées par chimiothérapie dans une intention palliative, conformément aux lignes directrices S3 actuelles, via un port i.v. implanté au préalable.
Principes de l’opération
L’objectif de l’opération est l’ablation de la tumeur en milieu sain avec la meilleure distance de sécurité possible entre les bords de la tumeur et les surfaces de résection (situation R0) [3,4]. L’intervention standard pour une tumeur résécable de la tête du pancréas (y compris le processus uncinatus) est la pancréaticoduodénectomie partielle comme opération de Whipple dite classique ou préservant le pylore avec dissection correspondante des ganglions lymphatiques (Fig. 1) [5].
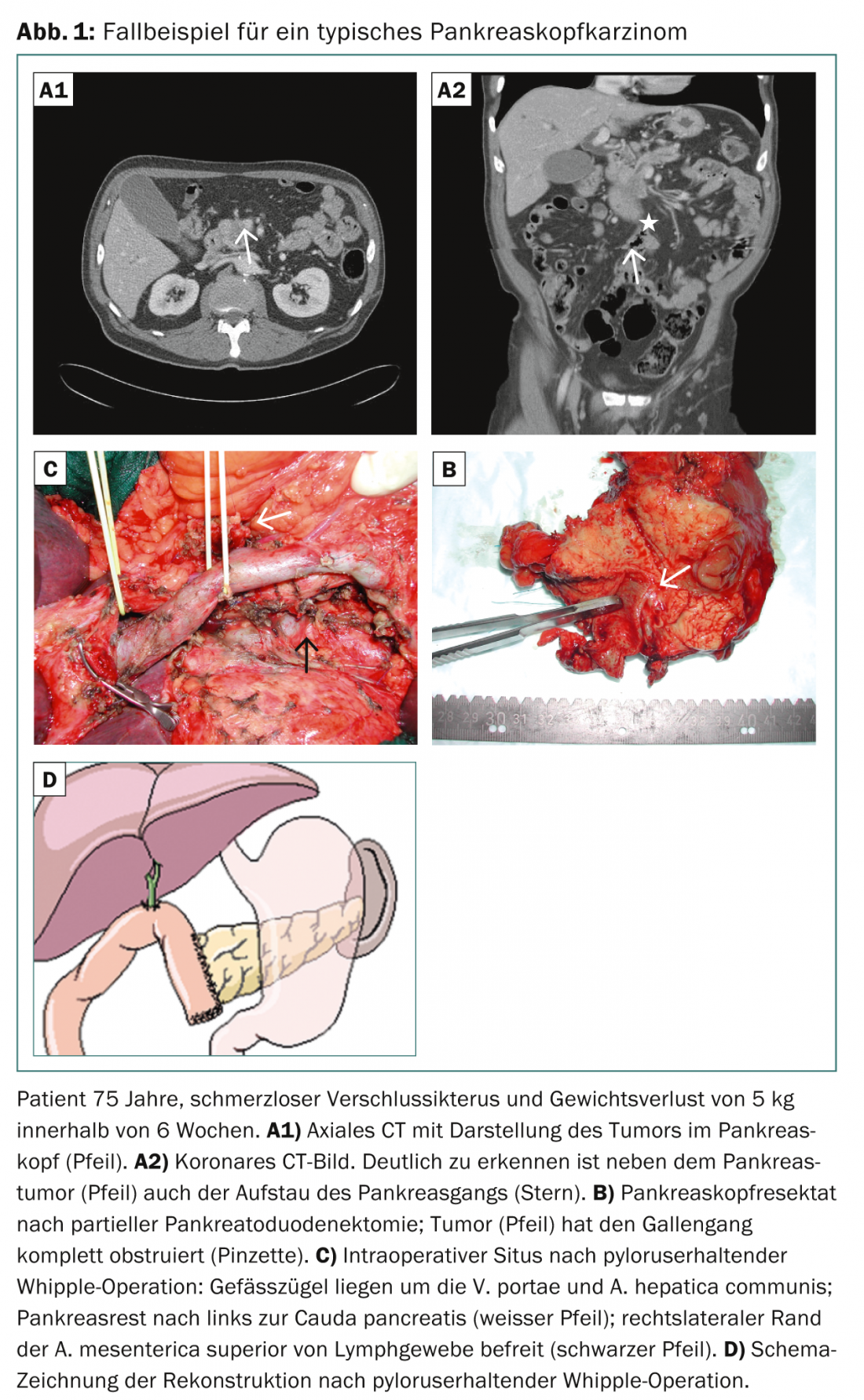
Le niveau de dissection des ganglions lymphatiques comprend les ganglions lymphatiques péripancréatiques et périduodénaux, les ganglions lymphatiques situés à droite de l’artère mésentérique inférieure et les ganglions lymphatiques du ligament hépatoduodénal. Une lymphadénectomie radicale élargie (interaortique, à gauche de l’artère mésentérique supérieure) n’améliore pas le pronostic et est plutôt contre-indiquée en raison de la morbidité postopératoire élevée supplémentaire avec fistule chyleuse et diarrhées massives [6]. Si la tumeur est située à gauche de la veine mésentérique supérieure (corps ou queue du pancréas), on procède à une résection gauche avec splénectomie et dissection locale correspondante des ganglions lymphatiques.
S’il n’apparaît qu’en peropératoire qu’il existe des métastases à distance (péritoine/foie) ou que la tumeur n’est pas raisonnablement résécable localement, une intervention palliative doit être réalisée. Si aucune confirmation histologique n’a été possible jusqu’à présent, la tumeur est biopsiée pour confirmer le diagnostic de manière à ce qu’il n’y ait qu’une faible probabilité de morbidité concernant une fistule pancréatique (par ex. par voie transduodénale ou par le canal biliaire). Une confirmation claire du carcinome est une condition sine qua non pour une chimiothérapie palliative ou néoadjuvante ultérieure. Les résections de métastases hépatiques ne sont généralement pas utiles.
En cas de cholestase, une anastomose biliodigestive est réalisée et le stent biliaire est retiré en peropératoire. Dans cette situation, il est généralement conseillé de créer une gastroentérostomie transmésocolique supplémentaire, même en l’absence de sténose duodénale existante. La combinaison des deux procédures constitue la reconstruction par double pontage.
La résécabilité chirurgicale détermine le pronostic
Malgré la grande qualité des techniques d’imagerie modernes, la résécabilité d’une tumeur du pancréas ne peut être évaluée que par le chirurgien viscéral. L’expérience du chirurgien et du centre jouent ici un rôle central. Les patients doivent donc être présentés dans des centres où le nombre de cas est élevé afin d’évaluer la résécabilité locorégionale. Les tumeurs résécables sont celles pour lesquelles l’espérance de vie est la plus longue. On peut aujourd’hui obtenir des taux de survie à 5 ans de 24 à 36% après une résection oncologique avec chimiothérapie adjuvante. L’infiltration d’organes voisins n’exclut pas nécessairement une résection R0. La résection élargie (en bloc) nécessaire à cet effet promet un pronostic comparable à celui de l’opération standard et devrait être effectuée dans des centres pancréatiques [7].
Le NCCN (National Comprehensive Cancer Network) définit les cancers du pancréas à la limite de la résécabilité en fonction du degré d’infiltration des organes voisins (tableau 1). Un “mur” de l’artère mésentérique supérieure ou du tronc coeliaque de plus de 180° n’est pas considéré comme raisonnablement résécable, mais ne constitue pas à ce jour une contre-indication absolue à une résection selon le consensus des experts. Il faut cependant être conscient que la morbidité et le taux de mortalité périopératoires sont plus élevés [8]. En revanche, l’infiltration de la veine porte, de la veine mésentérique supérieure et de la veine iliaque ne constituent pas des contre-indications absolues. Les résections en bloc du pancréas et des segments veineux portaux ont un taux de complications comparable à celui des opérations sans infiltration des vaisseaux veineux portaux [3,9]. Les données à long terme de certaines études montrent des pronostics comparables à ceux des interventions sans résection partielle des veines. En revanche, l’infiltration de la veine porte au-delà de 2 cm est considérée comme critique et constitue un facteur pronostique négatif [10].

Indications pour la mise en place d’un stent biliaire
Les tumeurs de la tête du pancréas se remarquent généralement par un ictère indolore et entraînent une CPRE. Cependant, la mise en place d’un stent biliaire drainant entraîne très souvent une colonisation bactérienne de la bile (environ 73%) et une cholangite consécutive, qui augmente encore la morbidité en cas de résection pancréatique [11]. L’indication de la pose d’un stent doit donc être posée en concertation avec les chirurgiens viscéraux et être rigoureuse. Toutefois, si la chirurgie ne peut pas être réalisée rapidement en cas d’ictère rapidement croissant (plus de dix fois la norme), l’indication de stenting est indispensable (critères de “bonnes pratiques cliniques”, GCP).
Traitement histopathologique standardisé
La distance minimale à respecter par rapport aux limites de coupe a récemment fait l’objet de discussions très controversées, suite à la redéfinition “arbitraire” de la classification R par le “Royal College of Pathologists” (RCP). Le RCP postule déjà une situation R1 lorsque des cellules tumorales <1 mm sont présentes par rapport à la limite de résection, mais qu’aucune cellule tumorale n’est détectable sur la zone de coupe. Dans la nouvelle ligne directrice S3, il a donc été décidé de décrire plus précisément le bord de coupe circonférentiel (ventral, médial et postérieur) dans l’expertise histopathologique (concept CRM basé sur l’évaluation histologique des cancers colorectaux) :
- Les résections R0 sont décrites comme CRM-négatives (R0-wide) lorsque les cellules tumorales >sont à 1 mm du bord de la résection.
- Les résections R0 sont décrites comme positives pour la CRM (R0-narrow) lorsque la distance entre les cellules malignes et la surface de coupe <est de 1 mm (Fig. 2).
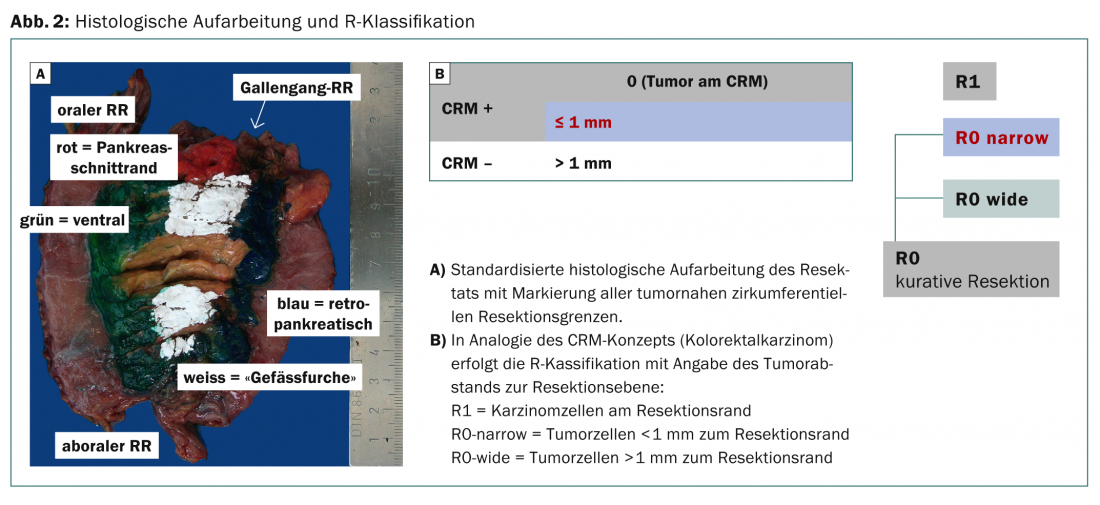
Des études récentes montrent que l’absence de cellules tumorales sur le bord de la coupe est le critère décisif (correspond à l’ancienne définition R selon l’UICC) [12]. L’objectif du nouveau traitement histologique standardisé est d’obtenir de meilleures données pour l’évaluation du pronostic et de la probabilité de récidive à l’avenir.
Le ratio des ganglions lymphatiques est un facteur pronostique
Les nouvelles lignes directrices S3 sur le cancer du pancréas exigent, outre le traitement histologique standardisé, une lymphadénectomie d’au moins dix ganglions lymphatiques locorégionaux. Celles-ci sont traitées de manière à permettre l’indication du ratio ganglionnaire, c’est-à-dire le ratio entre les ganglions atteints et les ganglions non atteints (recommandation des GCP). Un pronostic défavorable doit être déduit si le quotient des ganglions lymphatiques atteints par rapport aux ganglions lymphatiques sans tumeur est ≥ 0,2 [13].
Pas de résection en cas de métastases à distance
Si des métastases à distance sont déjà détectées en préopératoire, le traitement chirurgical n’est généralement pas utile. Il s’agit notamment de métastases d’organes, par exemple dans le foie et les poumons, d’une carcinose péritonéale avec ascite ou de métastases de ganglions lymphatiques en dehors des zones locorégionales (considérées comme des métastases à distance). Si des métastases à distance jusque-là inconnues sont découvertes en peropératoire, la résection entraîne une morbidité périopératoire accrue et ne présente aucun avantage en termes de survie. Cependant, il n’existe que des données bibliographiques limitées à ce sujet [14].
Traitement néoadjuvant du cancer du pancréas
Bien que les données d’études sur les approches thérapeutiques néoadjuvantes chez les patients atteints de tumeurs résécables ou à la limite de la résécabilité (chimioradiothérapie ou chimiothérapie suivie d’une radiothérapie) soient encore insuffisantes, les traitements néoadjuvants semblent être une option très prometteuse [15,16]. Dans certaines études unicentriques, il a ainsi été possible d’obtenir une résécabilité secondaire et d’améliorer ainsi le pronostic des patients concernés. En particulier, des schémas de chimiothérapie intensifiée plus efficaces sont aujourd’hui disponibles (FOLFIRINOX et gemcitabine/abraxane), qui permettent pour la première fois une régression significative de la tumeur.
Bien qu’aucune étude contrôlée et randomisée n’ait encore été publiée, les approches thérapeutiques néoadjuvantes pourraient s’imposer [17]. Ainsi, des patients sont actuellement recrutés dans cinq études différentes visant à évaluer l’intérêt d’un traitement néoadjuvant, y compris pour les cancers considérés comme résécables ou à la limite de la résécabilité. des tumeurs pancréatiques localement avancées. L’objectif est d’obtenir plus souvent une résection tumorale R0 à visée curative afin d’améliorer la survie à long terme des patients atteints de cancer du pancréas.
Littérature :
- Seufferlein T, et al : Dtsch Arztebl Int 2014 ; 111 : 396-402.
- Doi R, et al : Surg Today 2008 ; 38 : 1021-1028.
- Wagner M, et al : Br J Surg 2004 ; 91 : 586-594.
- Hartwig W, et al : Ann Surg 2011 ; 254 : 311-319.
- Chromik AM, et al : Oncologue 2012 ; 18 : 269-282.
- Kahlert C, et al : Chirurg 2008 ; 79 : 1115-1122.
- Nikfarjam M, et al : J Gastrointest Surg 2009 ; 13 : 915-921.
- Yamada S, et al : Pancréas 2009 ; 38 : e13-17.
- Bachellier P, et al : Am J Surg 2001 ; 182 : 120-129.
- Ouaissi M, et al : World J Surg 2010 ; 34 : 2648-2661.
- van der Gaag NA, et al : N Engl J Med 2010 ; 362 : 129-137.
- Janot MS, et al : Langenbecks Arch Surg 2012 ; 397 : 917-925.
- Michalski CW, et al : Br J Surg 2007 ; 94 : 265-273.
- Gleisner AL, et al : Cancer 2007 ; 110 : 2484-2492.
- Chen KT, et al : Ann Surg Oncol 2014 ; 21 : 662-669.
- Rose JB, et al : Ann Surg Oncol 2014 ; 21 : 1530-1537.
- Hammel P, et al. : Résultats finaux de l’étude internationale de phase III LAP 07. ASCT Meeting Abstracts 2013 ; 31 : LBA4003.
InFo ONKOLOGIE & HÉMATOLOGIE 2014 ; 2(7) : 10-13