Clostridium difficile est une cause fréquente de diarrhée et de colite associées aux antibiotiques. L’incidence est en augmentation. Ce sont surtout les formes d’évolution récurrentes qui entraînent une “charge de morbidité” élevée.
Selon les données épidémiologiques publiées en 2017, jusqu’à 15,5% des patients hospitalisés présentent des souches toxigènes de Clostridium difficile (C.difficile), avec un taux de mortalité compris entre 3% et 14% [2]. La diarrhée associée aux antibiotiques est une diarrhée associée à C. difficile dans 10-20% des cas. L’apparition des symptômes quelques heures à quelques semaines après l’antibiothérapie est typique, et la prévalence varie notamment en fonction de l’agent utilisé (ampicilline 5-10% ; amoxicilline-acide clavulanique 10-25% ; céfixime 15-20% ; autres comme les céphalosporines, les fluoroquinolones, les macrolides, la tétracycline 2-5%), selon l’orateur [3]. Le risque de récidive après un premier épisode traité avec succès est d’environ 20% et augmente jusqu’à 40-60% après le deuxième épisode, explique le professeur Ansgar W. Lohse, directeur de clinique et spécialiste en médecine interne et en gastroentérologie à la clinique universitaire de Hambourg-Eppendorf [1,3].
Diagnostic : que recommandent les lignes directrices actuelles ?
Selon le professeur Lohse, les caractéristiques cliniques classiques d’une infection à C. difficile (ICD) sont les suivantes : diarrhées aqueuses (rarement sanglantes), fièvre (28%), douleurs abdominales (22%), iléus, mégacôlon toxique, perforation intestinale, septicémie [3]. Pour l’examen diagnostique, les facteurs de risque suivants peuvent, en cas de symptomatologie correspondante, indiquer une possible CDI comme diagnostic de suspicion : traitement antibiotique (céphalosporines, quinolones, clindamycine, acide clavulanique) ; inhibiteurs de la pompe à protons ; immunosuppression ; âge>65 ans ; colonisation par C. difficile (0-3% chez les personnes non hospitalisées ; 20-40% chez les patients hospitalisés ; maladie inflammatoire chronique de l’intestin [2–4].
En présence d’une gastro-entérite nosocomiale, C. difficile gastro-intestinal et les norovirus sont des causes possibles selon les lignes directrices S2k, les autres agents pathogènes n’étant pas pertinents et ne devant pas être testés, explique l’orateur. Par mesure de précaution, les patients doivent être isolés par contact jusqu’à 48 heures après la suspension des symptômes cliniques en cas de suspicion de gastro-entérite infectieuse (encadré) [3,5]. L’intervenant ajoute que 48h après la fin des symptômes, il est possible de procéder à un isolement sans refaire de test [3].

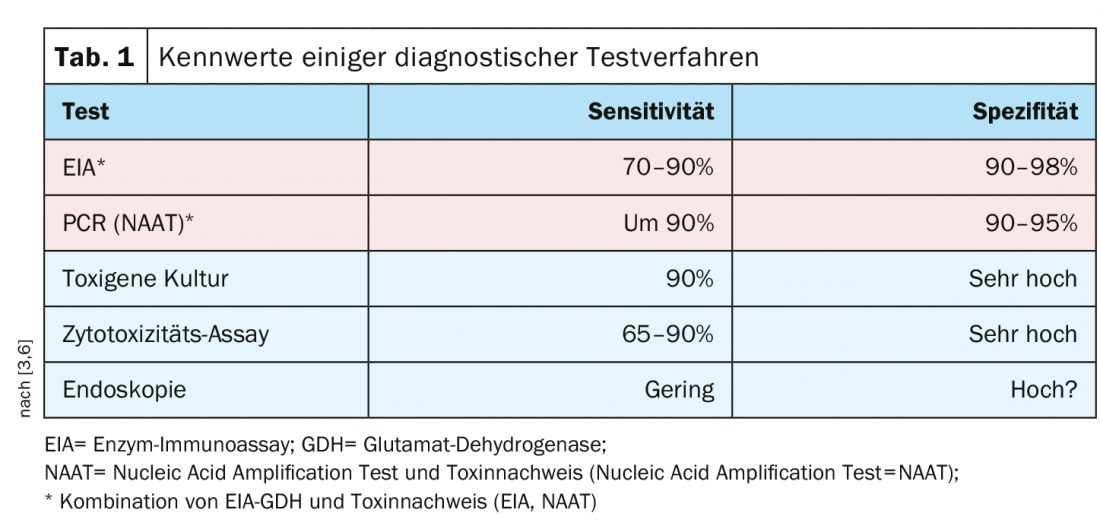
Il existe plusieurs méthodes de test présentant une sensibilité et une spécificité élevées, et il est recommandé de combiner le dosage immunoenzymatique/glutamate déshydrogénase (EIA-GDH) et la détection des toxines (dosage immunoenzymatique=EIA ; test d’amplification des acides nucléiques=NAAT) (tableau 1).
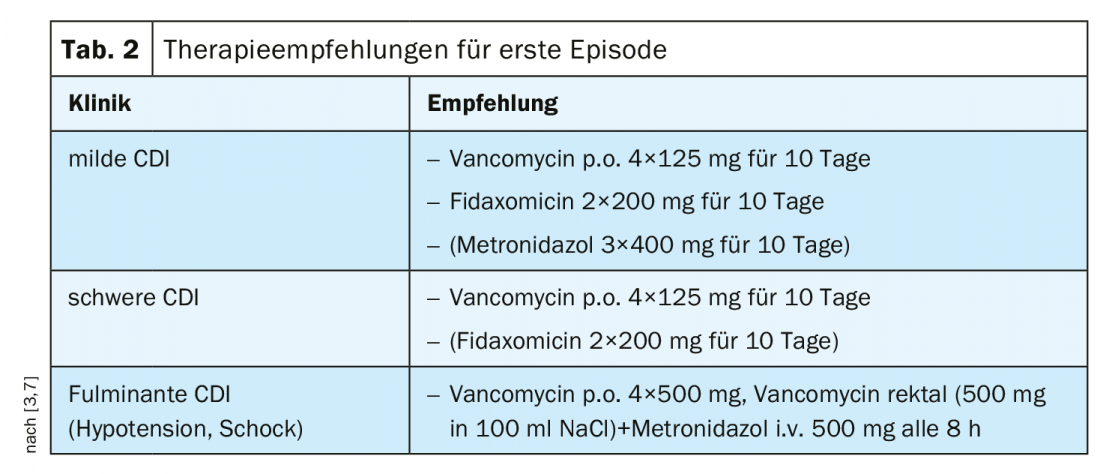
La vancomycine est aujourd’hui considérée comme un traitement de première ligne.
Auparavant, le métronidazole était recommandé pour les CDI légères à modérées en tant que traitement rentable [1]. La vancomycine a été utilisée en cas d’intolérance au métronidazole et/ou de risque accru de récidive [1]. Sur la base des résultats de l’étude, la recommandation a été adaptée en fonction de la gravité de l’IVC, conformément aux lignes directrices IDSA/SHEA 2018 [1]. Selon les recommandations actuelles du consensus, la vancomycine est un traitement de première ligne pour les CDI légères et sévères. (Tab. 2). En cas de CDI peu prononcée et de risque de récidive, on peut opter pour la fidaxomicine ; contrairement aux estimations précédentes, l’utilisation du métronidazole doit être limitée aux cas de manque de disponibilité ou d’intolérance aux deux autres agents [7]. Dans les formes sévères et les évolutions compliquées des CDI, la vancomycine doit toujours être utilisée comme traitement de première ligne [3]. Les facteurs prédictifs d’une CDI sévère selon les lignes directrices S2k sont indiqués dans l ‘aperçu 1. Pour le traitement des CDI récidivantes, la vancomycine ou la fidaxomicine peuvent être utilisées [3,7] (tab. 3).

La prévention des récidives est très importante
Les données montrent que même après un traitement réussi avec l’obtention de la disparition des symptômes, une proportion importante de patients récidivent et que le risque de rechute augmente à chaque échec [8]. Le critère temporel d’une récidive est une réapparition des symptômes dans un délai d’au moins deux semaines et de deux mois au maximum après l’amélioration des symptômes initiaux (nouvelle infection vs réinfection), selon l’orateur [3].

Dans les deux études randomisées et contrôlées par placebo MODIFY I et MODIFY II, l’administration simultanée d’une dose unique de bezlotoxumab (10 mg par kilogramme de poids corporel) pendant un traitement standard (vancomycine, métronidazole ou fidaxomicine) pour C. difficile a entraîné une réduction de 38% du taux de récidive en 12 semaines [9].
En Suisse, le bezlotoxumab, un anticorps monoclonal ayant une forte affinité pour la toxine B de C. difficile, est autorisé depuis fin 2017 pour la prévention des récidives de Clostridioides difficile. Le bezlotoxumab est dirigé contre la toxine B de C. difficile. Une autre option de prévention des récidives avec un taux de réussite élevé est le transfert de microbiome fécal (FMT) [2,3,12].

Il existe de nouveaux résultats de recherche sur les stratégies préventives, telles que l’utilisation de probiotiques, la sanification microbienne intestinale pendant l’antibiothérapie, les vaccins et les nouveaux antibiotiques qui réduisent les effets négatifs sur le microbiome intestinal [1]. En ce qui concerne l’option de la vaccination, une étude de phase III est encore en phase de recrutement jusqu’en 2020 [3,13].
Source : DGIM, Wiesbaden (D)
Littérature :
- Dieterle MG, Rao K, Young VB : Nouvelles thérapies et stratégies préventives pour les infections primaires et récurrentes à Clostridium difficile. Numéro spécial : Antimicrobial Therapeutics Reviews 2019 ; 1435 (1) : 110-138.
- Solbach P, Dersch P, Bachmann O : Stratégies de traitement individualisées pour les infections à Clostridium difficile [Article in German]. Internist (Berl) 2017 ; 58(7) : 675-681. doi : 10.1007/s00108-017-0268-2.
- Lohse A : Présentation de diapositives, DGIM 2019, 05.05.2019, Abdomen aigu : Exposé 1 : C. diff. Colitis, Prof. Dr med. A. Lohse, directeur de clinique, spécialiste en médecine interne et en gastroentérologie, Clinique universitaire de Hambourg-Eppendorf.
- Gould LH, Limbago B : Clostridium difficile in food and domestic animals : a new foodborne pathogen. Clin Infect Dis 2010 ; 51(5) : 577-582. doi : 10.1086/655692.
- AWMF : Infections gastro-intestinales et maladie de Whipple, Ligne directrice S2k 2015, AWMF en ligne. Le portail de la médecine scientifique, numéro d’enregistrement 021-024, version du 31.01.2015 , valable jusqu’au 30.01.2020. www.awmf.org/leitlinien/detail/ll/021-024.html, dernier appel 15.05.2019.
- Manthey CF, Eckmann L, Fuhrmann C : Traitement de l’infection à Clostridium difficile – quelles sont les nouvelles au-delà du métronidazole et de la vancomycine ? Expert Review of Clinical Pharmacology 2017 ; 10 (11). www.tandfonline.com, dernier appel 15.05.2019.
- McDonald LC, et al : Clinical practice guidelines for Clostridium difficile infection in adults and children : 2017 update by the Infectious Diseases Society of America (IDSA) and Society for Healthcare Epidemiology of America (SHEA). Clin. Infect Dis 1018 ; 66 : e1-e48.
- Deshpande A, et al : Risk factors for recurrent Clostridium difficile infection : a systematic review and meta-analysis. Infect Control Hosp Epidemiol 2015 ; 36 : 452-460.
- Wilcox MH, et al : Bezlotoxumab for Prevention of Recurrent Clostridium difficile Infection. N Engl J Med 2017 ; 376(4) : 305-317.
- Curry SR, et al : Haute fréquence de la résistance à la rifampine identifiée dans un clone épidémique de Clostridium difficile provenant d’un grand hôpital d’enseignement. Clin Infect Dis 2009 ; 48 : 425-429.
- Muller L, Halfmann A, Herrmann M : [Current data and trends on the development of antibiotic resistance of Clostridium difficile]. Bundesgesundheitsblatt Gesundheitsforschung Gesundheitsschutz 2012 ; 55 : 1410-1417.
- Van Nood, E : Perfusion duodénale de fèces de donneurs pour le Clostridium difficile récurrent. NEJM 2013 ; 368(5) : 407-415.
- Pfizer Inc : Clostridium difficile vaccine efficacy trial : NCT03090191. www.pfizer.com/science/find-a-trial/nct03090191, dernier appel 15.05.2019.
HAUSARZT PRAXIS 2019 ; 14(6) : 32-33 (publié le 24.5.19, ahead of print)