Pour les tumeurs germinales et épithéliales de l’ovaire, la chirurgie et la chimiothérapie constituent la première ligne de traitement. Toutefois, des progrès ont été réalisés ces dernières années, notamment en ce qui concerne le cancer de l’ovaire. Ainsi, il existe une base de données croissante sur le traitement d’entretien par le bevacizumab et/ou les inhibiteurs de PARP.
Alors que les approches oncologiques ciblées n’ont pas encore réussi à s’imposer dans les tumeurs germinales de l’ovaire, elles sont désormais établies dans la pratique quotidienne et approuvées par les autorités avec les inhibiteurs de la PARP dans le traitement d’entretien des tumeurs épithéliales de l’ovaire. Néanmoins, certaines questions restent sans réponse, comme celle de la combinaison et de la séquence idéales des substances actives. Il manque également des comparaisons directes entre les différentes substances. Et il n’y a pas que les molécules nouvellement introduites qui ne sont pas claires, mais aussi dans le cadre des traitements standard de première ligne des tumeurs ovariennes. L’opération devrait-elle être reportée à une date ultérieure pour augmenter les chances de résection R0 ? Et comment pourrait-on améliorer la prise en charge des patientes atteintes de tumeurs germinales compte tenu du faible nombre de cas ?
Tumeurs des cellules germinales : apprendre des hommes ?
Bien que les tumeurs germinales de l’ovaire aient un bon pronostic après une opération réussie, les études sur le traitement optimal doivent être améliorées. Par exemple, il existe peu de données sur la place de la radiothérapie et il n’est pas certain que la chimiothérapie, telle qu’elle est pratiquée actuellement, soit réellement nécessaire dans tous les cas. Dans le setting récidivant, le paysage des études est également peu peuplé – malgré un pronostic extrêmement mauvais et donc unbesoin médical élevé. Alors que des découvertes passionnantes sur le traitement du séminome et des tumeurs non séminomateuses sont régulièrement publiées chez les hommes, elles sont rares dans le cas des tumeurs germinales féminines. Une stratégie consiste donc à appliquer les résultats d’études de cohortes masculines ou mixtes à des patientes. En effet, les tumeurs des cellules germinales sont beaucoup plus fréquentes chez les hommes, avec une incidence de 6/100 000 par an, que chez les femmes, avec une incidence de 0,2/100 000/an. Viola Heinzelmann, directrice du Centre des tumeurs gynécologiques et médecin-chef en gynécologie/oncologie gynécologique à l’Hôpital universitaire de Bâle, lors du congrès des sociétés allemande, autrichienne et suisse d’hématologie et d’oncologie médicale de cette année à Berlin. Les tumeurs germinales masculines et féminines sont en effet similaires à bien des égards, notamment en ce qui concerne les biomarqueurs disponibles, l’âge de la maladie et les stratégies de traitement. Néanmoins, il existe des différences pertinentes telles que l’augmentation de l’incidence chez les hommes et la classification des stades.
Actuellement, le traitement de première ligne – en grande partie extrapolé à partir de données d’études sur les tumeurs germinales masculines – consiste notamment en la chirurgie (laparotomie ou mini-invasive) et la chimiothérapie. Il convient d’éviter toute rupture afin de prévenir la propagation de la tumeur. Dans la plupart des cas, il est possible d’opérer en préservant la fertilité, mais l’hystérectomie et l’annexectomie sont recommandées une fois le planning familial terminé [1]. Pour les patientes atteintes d’un dysgerminome ou d’un tératome immature de stade IA, une surveillance postopératoire suffit, alors que toutes les autres patientes doivent être soumises à une chimiothérapie dans les dix jours suivant l’opération [1]. Elle a des effets durables sur la fertilité et peut être inutile au stade IA pour toutes les tumeurs germinales – mais on manque de données fiables à ce sujet.
Les récidives doivent également être enlevées chirurgicalement chaque fois que cela est possible. Pour le traitement de deuxième ligne, on utilise notamment la vinblastine/l’ifosfamide/le cisplatine (VeIP) ou le paclitaxel/l’ifosfamide/le cisplatine. Cependant, il existe également des approches curatives à base de carboplatine qui donnent de bons résultats [2]. D’autres options expérimentales comprennent la chimiothérapie à haute dose avec autogreffe de cellules souches, la PEB accélérée ou standard (bléomycine/étoposide/platine), le carboplatine/paclitaxel et la surveillance active [3]. Il existe une étude de phase II sur l’utilisation de l’immunothérapie par inhibiteurs de points de contrôle, publiée en 2021, dans laquelle aucun bénéfice n’a été observé avec l’administration de pembrolizumab [4]. En raison de la grande instabilité génomique, les thérapies ciblées ne sont pas une option pour les tumeurs germinales, selon le professeur Heinzelmann. Une étude randomisée multicentrique actuellement en cours, comparant le paclitaxel/carboplatine à la bléomycine/étoposide/cisplatine en situation de récidive, serait plus prometteuse. Les résultats de cette étude sont attendus en 2024.
Cette année, deux innovations intéressantes ont été présentées lors du congrès de l’European Society for Medical Oncology (ESMO) – du moins en ce qui concerne les tumeurs germinales masculines. Ainsi, pour les séminomes de stade IIA/B, il semble justifié de réduire l’intensité du traitement à une seule administration de carboplatine et à une radiothérapie [5]. Le cabazitaxel pourrait également apporter un avantage en termes de survie dans les tumeurs germinales avancées après deux ou trois lignes de traitement antérieures [6]. Il reste à déterminer si les résultats de ces études sont également applicables aux patientes. La radiothérapie ne fait pas partie du traitement standard chez les femmes, d’une part pour des raisons de préservation de la fertilité et d’autre part pour des raisons anatomiques. Cette option n’a pas encore été étudiée dans des études randomisées chez les femmes. Pour pallier le manque de données sur le traitement des tumeurs germinales féminines, les deux réseaux ENGOT (Réseau européen des groupes d’essais gynécologiques en oncologie) et GCIS (International Gynecological Cancer Intergroup Ovarian Cancer) Ces derniers sont chargés de coordonner et de mettre en place des études importantes afin de faire enfin la lumière sur le dysgerminome, le tératome et autres tumeurs féminines.
Focus sur le traitement de première ligne du cancer de l’ovaire
Outre les tumeurs germinales, la réunion annuelle de la DGHO, de l’OeGHO, de la SSMO et de la SGH/SSH a également porté sur le cancer de l’ovaire, beaucoup plus fréquent. En particulier, la question de savoir si une chimiothérapie néoadjuvante devait être administrée avant la chirurgie a été au centre des débats. Et le traitement d’entretien par bevacizumab et/ou inhibiteur de PARP a également été discuté. Celle-ci fait déjà partie des standards de traitement en première ligne à partir du stade III, en plus de la chirurgie et de la chimiothérapie adjuvante [7]. Alors que les bénéfices correspondants en termes de survie sans progression (PFS) ont déjà été démontrés dans les différentes études pivots, il n’existe pas encore de données publiées sur la survie globale sous le nouveau traitement d’entretien recommandé.
En principe, la résection macroscopiquement complète est considérée comme extrêmement importante pour le pronostic [8]. Celle-ci est obtenue dans environ 60% des cas, avec un taux de résection R0 plus élevé après une chimiothérapie néoadjuvante. Il est donc logique d’attendre la fin de la chimiothérapie primaire avant de procéder à l’opération. Cependant, cette approche ne semble pas améliorer l’outcome [9,10]. L’absence de tumeur après une opération primaire est donc, selon les données actuelles, supérieure à celle obtenue après une opération d’intervalle. Cela se reflète également dans les directives qui ne prévoient pas de chimiothérapie néoadjuvante [7]. Cependant, la séquence de traitement n’a été étudiée que sur des tumeurs avancées, souvent non opérables en première intention. La question de la chimiothérapie néoadjuvante reste donc actuellement sans réponse pour les patientes dont on estime qu’elles sont en premier lieu opérables. C’est pourquoi l’étudeTRUST (Trial on Radical Upfront Surgical Therapy)a été mise en place, incluant des patientes de stade IIIB, IIIC et IV, considérées comme opérables sans tumeur. L’évaluation des données est en cours et devrait permettre de déterminer si, dans certains cas, la chirurgie d’intervalle pourrait être supérieure au traitement standard. Un facteur qui ne doit pas être négligé est la morbidité et la mortalité associées à l’opération. Les patientes présentant un risque élevé de chirurgie devraient être mieux identifiées, selon le professeur Barbara Schmalfeldt, directrice du centre de cancérologie gynécologique de l’hôpital universitaire de Hambourg-Eppendorf. Ces patientes, environ 10%, bénéficieraient davantage d’une chimiothérapie primaire suivie d’une réévaluation de la chirurgie [11–13]. Cependant, l’identification de ces patientes fragiles est un défi. L’approche présentée au congrès est la méthode dite des “4 A”, dans laquelle l’âge, l’albumine, le stade de la maladie (Advanced Disease) et l’état général sont pris en compte dans la décision de traitement.
Malgré des données convaincantes pour le traitement d’entretien en première ligne, la chirurgie et la résection la plus complète possible restent d’une grande importance – ce point a également été souligné par le professeur Schmalfeldt. Ainsi, même sous traitement d’entretien, la PFS serait fortement dépendante du résidu tumoral [14].
Le rôle des inhibiteurs de la PARP dans le cancer séreux de l’ovaire de haut grade
Les innovations les plus révolutionnaires de ces dernières années dans le traitement du cancer de l’ovaire concernent le traitement d’entretien en première ligne. Après l’introduction du bevacizumab, un inhibiteur du VEGF, dans cette indication, les inhibiteurs du PARP, le niraparib et l’olaparib, ont été ajoutés en présence d’une mutation BRCA ou d’un autre déficit de recombinaison homologue (HRD). La condition préalable au traitement d’entretien par le bevacizumab et/ou l’inhibiteur de PARP est une réponse à la chimiothérapie de première ligne [15]. Les bénéfices de l’inhibition du VEGF – dans ce cas, l’administration de bevacizumab commence en même temps que la chimiothérapie et se poursuit après la fin de celle-ci – ont été confirmés lors de la réunion annuelle de l’ASCO de cette année. En revanche, la prolongation du traitement de 15 à 30 mois n’a pas apporté de bénéfice supplémentaire [16]. De même, l’utilisation des inhibiteurs de la PARP, l’olaparib et le niraparib, en traitement d’entretien de première ligne dans les tumeurs HRD-positives entraîne un avantage avéré en termes de SSP par rapport au placebo et à la monothérapie par bévacizumab [17]. Cela a déjà conduit à des autorisations de Swissmedic et à des modifications correspondantes des lignes directrices [7,15].
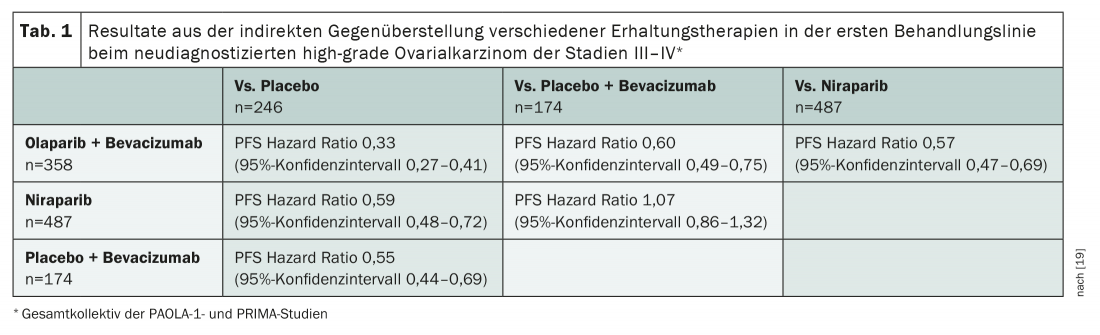
Bien que l’utilité des inhibiteurs de la PARP dans le cancer de l’ovaire HRD-positif de haut grade ne soit plus guère contestée, certaines questions relatives à leur utilisation doivent encore être résolues. Ainsi, il n’existe à ce jour aucune comparaison directe entre les différentes substances actives. De même, le traitement combiné avec le bevacizumab fait toujours l’objet de controverses. Il existe à cet effet deux comparaisons indirectes ajustées à la population sur la base des études d’enregistrement [18,19]. Celles-ci sont méthodologiquement discutables – et extrêmement intéressantes. D’une part, ils fournissent des indications selon lesquelles l’administration simultanée d’un inhibiteur de PARP et de bevacizumab présente des avantages en termes de PFS par rapport à la monothérapie par inhibiteur de PARP. Cette option semble également donner de meilleurs résultats que l’administration de bevacizumab seul (tab. 1). En l’absence de contre-indication au bévacizumab, cette substance devrait donc être utilisée – complétée par un inhibiteur de PARP dans les cas HRD positifs. En cas de contre-indication au bevacizumab, un traitement d’entretien par inhibition de la PARP seule peut être initié après la chimiothérapie chez les patientes HRD-positives. Les inhibiteurs de la PARP – en l’occurrence l’olaparib, le niraparib et le rucaparib – sont également autorisés dans le cancer de l’ovaire sensible au platine en rechute, et ce indépendamment du statut mutationnel.
Avec l’utilisation accrue de substances actives ciblées, la question de la stratégie de test optimale se pose de plus en plus. Une chose est sûre : un test génétique devrait être proposé dans tous les cas [7]. Alors que certains centres effectuent d’abord le diagnostic de la tumeur, puis celui de la lignée germinale, d’autres préfèrent procéder à l’inverse. Il n’existe pas de norme établie.
Source : Symposium scientifique “Update Ovarialtumore” sous la présidence de Sigrun Greil-Ressler et Hans Tesch, 04.10.2021, réunion annuelle des sociétés allemande, autrichienne et suisse d’hématologie et d’oncologie médicale, Berlin (D)
Littérature :
- Brown J, et al : Gynecologic Cancer Intergroup (GCIG) consensus review for ovarian germ cell tumors. Int J Gynecol Cancer. 2014 ; 24(9 Suppl 3) : S48-54.
- De Giorgi U, et al : Salvage high-dose chemotherapy in female patients with relapsed/refractory germ-cell tumors : a retrospective analysis of the European Group for Blood and Marrow Transplantation (EBMT). Ann Oncol. 2017 ; 28(8) : 1910-1916.
- Uccello M, et al : Traitement anticancéreux systémique des tumeurs germinales ovariennes malignes (MOGCTs) : gestion actuelle et approches prometteuses. Ann Transl Med. 2020 ; 8(24) : 1713.
- Tsimberidou AM, et al. : Pembrolizumab chez les patients atteints de tumeurs germinales métastatiques avancées. Oncologist . 2021 ; 26(7) : 558-e1098.
- Papachristofilou A, et al : Single-dose carboplatin followed by involved-node radiotherapy as curative treatment for seminoma stage IIA/B : Efficacy results from the international multicenter phase II trial SAKK 01/10. ESMO Congress 2021, Proffered Paper Session – Genitourinary tumours, non-prostate 2, Abstract #LBA30.
- Baciarello G, et al : A prospective phase II trial of cabazitaxel in men patients with chemotherapy pre-treated metastatic germ-cell tumors : The CABA-GCT study. Congrès ESMO 2021, session mini orale – Tumeurs génito-urinaires, non-prostate, Abstract #655MO.
- AWMF S3-Leitlinie : Diagnostic, traitement et suivi des tumeurs malignes de l’ovaire, version 5.0, septembre 2021.
- du Bois A, et al : Role of surgical outcome as prognostic factor in advanced epithelial ovarian cancer : a combined exploratory analysis of 3 prospectively randomized phase 3 multicenter trials : by the Arbeitsgemeinschaft Gynaekologische Onkologie Studiengruppe Ovarialkarzinom (AGO-OVAR) and the Groupe d’Investigateurs Nationaux Pour les Etudes des Cancers de l’Ovaire (GINECO). Cancer. 2009 ; 115(6) : 1234-1244.
- Vergote I, et al : Chimiothérapie néoadjuvante ou chirurgie primaire dans le cancer de l’ovaire de stade IIIC ou IV. N Engl J Med. 2010 ; 363(10) : 943-953.
- Kehoe S, et al. : Chimiothérapie primaire versus chirurgie primaire pour un cancer ovarien avancé nouvellement diagnostiqué (CHORUS) : un essai ouvert, randomisé, contrôlé, non-infériorité. Lancet . 2015 ; 386(9990) : 249-257.
- Vergote I, et al. : Chimiothérapie néoadjuvante dans le cancer ovarien avancé : sur quoi sommes-nous d’accord et en désaccord ? Gynecol Oncol. 2013 ; 128(1) : 6-11.
- Aletti GD, et al. : Approche multidisciplinaire dans la prise en charge des patients atteints de cancer ovarien avancé : une approche personnalisée. Résultats d’une unité spécialisée dans le cancer de l’ovaire. Gynecol Oncol. 2017 ; 144(3) : 468-473.
- Ataseven B, et al : L’albumine sérique préopératoire est associée au taux de complications postopératoires et à la survie globale chez les patients atteints de cancer épithélial de l’ovaire subissant une chirurgie cytoreductrice. Gynecol Oncol. 2015 ; 138(3) : 560-565.
- Harter P, et al : Efficacité de l’olaparib de maintenance plus bevacizumab par statut de biomarqueur chez les patients cliniques à haut et à bas risque atteints de cancer ovarien avancé nouvellement diagnostiqué dans l’essai PAOLA-1. International Journal of Gynecologic Cancer. 2020 ; 30 : A13-A4.
- Information sur les médicaments de Swissmedic : www.swissmedicinfo.ch (dernier accès le 28.10.2021).
- Pfisterer J, et al. : Durée optimale de traitement du bevacizumab (BEV) combiné au carboplatine et au paclitaxel chez les patients (pts) atteints de cancer épithélial primaire de l’ovaire (EOC), de cancer du tube de Fallope (FTC) ou de cancer péritonéal (PPC) : A multicenter open-label randomised 2-arm phase 3 ENGOT/GCIG trial of the AGO Study Group, GINECO, and NSGO (AGO-OVAR 17/BOOST, GINECO OV118, ENGOT Ov-15, NCT01462890). ASCO Annual Meeting 2021, Oral Abstract Session Gynecologic Cancer, Abstract #5501.
- Ray-Coquard I, et al : Olaparib plus Bevacizumab as First-Line Maintenance in Ovarian Cancer. N Engl J Med. 2019 ; 381(25) : 2416-2428.
- Vergote I, et al : Population adjusted indirect comparison of the SOLO1 and PAOLA-1/ENGOT-ov25 studies of olaparib with or without bevacizumab, bev alone and placebo in the maintenance treatment of women with newly diagnosed stage III/IV ovarian cancer with BRCA mutation. SGO Annual Meeting 2020, Abstract #35.
- Hettle R, et al. : Population-adjusted indirect treatment comparison (PAITC) of maintenance PARP inhibitor (PARPi) with or without bevacizumab versus bevacizumab in women with newly diagnosed ovarian cancer (OC). ASCO Annual Meeting 2020, Poster Session Gynecologic Cancer, Abstract #6052.
InFo ONKOLOGIE & HÄMATOLOGIE 2021 ; 9(6) : 19-22 (publié le 7.12.21, ahead of print)