Les modèles de peau humaine créés par bio-impression 3D ont déjà fait leur entrée dans la recherche médicale. Toutefois, des efforts de recherche supplémentaires sont nécessaires pour pouvoir exploiter cette avancée technologique pour une application thérapeutique clinique immédiate.
Les propriétés biologiques de la peau des animaux de laboratoire diffèrent de celles de la peau humaine [1]. Cela concerne par exemple l’épaisseur de l’épiderme dans la peau murine ou encore la contractilité dermique après une blessure. Un modèle de peau humaine intégrale en trois dimensions s’est déjà établi comme système de test in vitro dans le cadre de questions biomédicales [1].
La cicatrisation des plaies, un domaine d’application de la bio-impression 3D
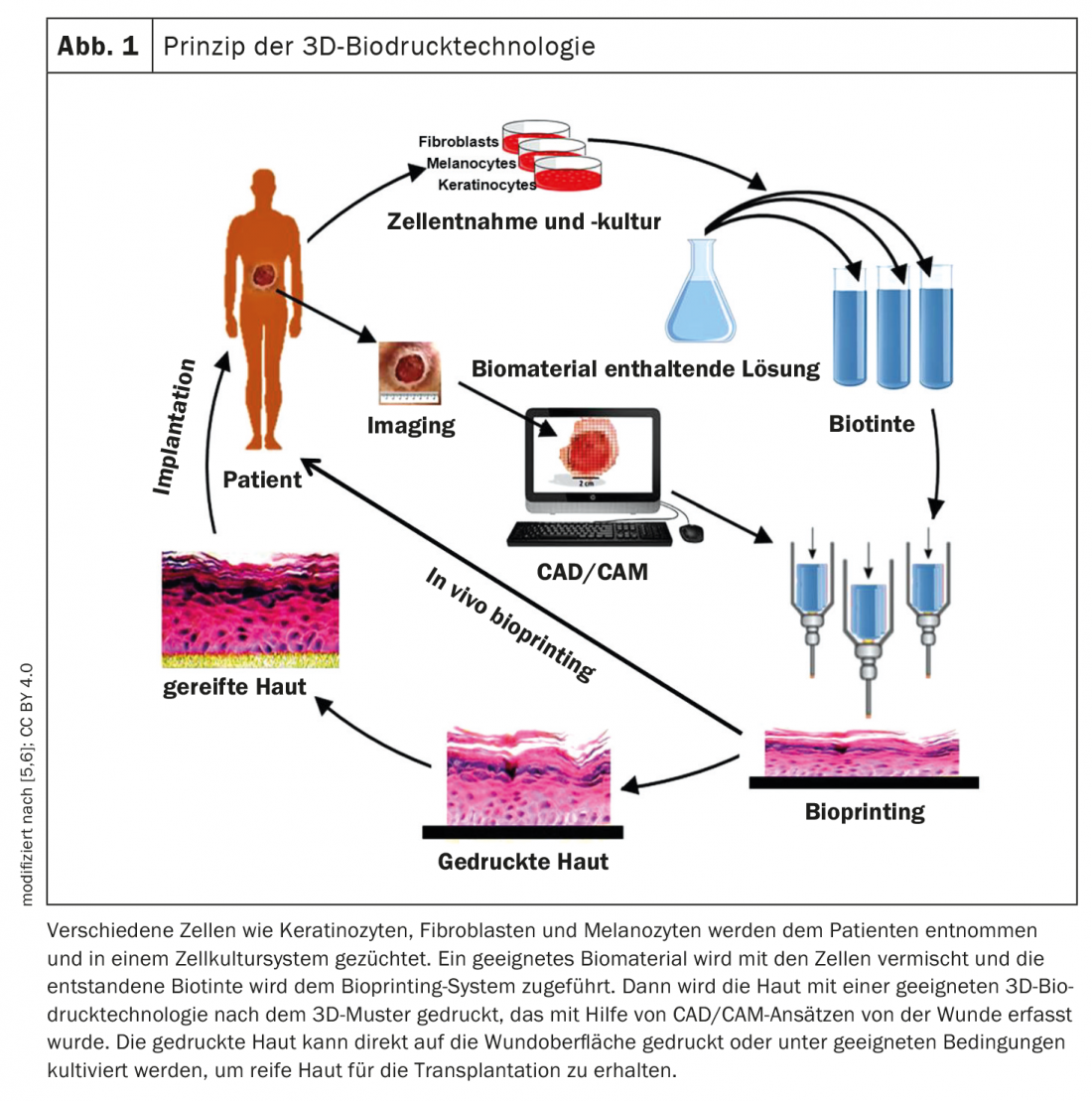
La cartographie de la plaie est un préalable à la création d’un modèle structurel bionique [5,6]. La modélisation tridimensionnelle et la technologie d’imagerie numérique permettent ensuite d’obtenir des informations morphologiques sur le défaut cutané, et un modèle de peau stratifié est créé par des méthodes de stratification adaptatives afin de générer des commandes d’impression appropriées (Fig. 1) [7]. Des échantillons de peau sont ensuite prélevés sur le patient afin d’obtenir des kératinocytes et des fibroblastes dermiques pour le tri et l’enrichissement cellulaires ultérieurs [8]. Pour produire de l’encre biologique, on utilise un rapport optimal entre la suspension cellulaire et l’hydrogel. Ensuite, la peau est imprimée par bio-impression 3D et soit transplantée directement sur la surface de la plaie, soit cultivée dans des conditions appropriées afin d’obtenir une peau mature pour la transplantation. Hennessy et al. ont montré que la structure et la fonction des substituts cutanés à deux couches sont plus proches de celles de la peau humaine naturelle que celles des substituts cutanés à une couche [9].
Des chercheurs ont produit un modèle de peau complet
Kim et al. ont pu produire en 2017 un modèle de peau complet, composé d’un derme et d’un épiderme stratifié très similaire à la peau humaine, en utilisant une imprimante 3D combinée à extrusion et à jets multiples [3]. Pour ce faire, ils ont construit une structure de support en polycaprolactone et en hydrogel de gélatine par extrusion de matériau et l’ont également imprimée avec des fibroblastes dermiques primaires humains incorporés dans du collagène. Ces étapes ont été répétées jusqu’à l’obtention de l’épaisseur souhaitée de la structure, soit 3,5 mm. Une couche finale de kératinocytes épidermiques humains a été appliquée par impression multi-jets. Après deux semaines d’incubation du tissu artificiel, outre un comportement d’étirement des fibroblastes très similaire à celui de la peau humaine, l’expression du collagène et des marqueurs de différenciation spécifiques au derme ont notamment été observés comme indices d’un tissu cutané entièrement fabriqué artificiellement et fondamentalement fonctionnel [4].
Littérature :
- Marquardt Y, Huth S, Baron JM : Recherche dermatologique : possibilités d’utilisation de modèles de peau en 3D. Dtsch Arztebl 2020 ; 117(24) : [20]; DOI : 10.3238/PersDerma.2020.06.12.05
- Kocak E, Yildiz A, Acarturk F : Technologie de bioimpression en trois dimensions : applications dans les domaines pharmaceutique et biomédical. Colloïdes Surf B Biointerfaces 2020 ; 197 : 111396.
- Kim BS, et al : Impression cellulaire 3D directe de la peau humaine avec le système fonctionnel transwell. Biofabrication 2017 ; 9(2):025034.
- “Technologies d’impression 3D pour la régénération des tissus mous et durs”, 16.03.2022, www.zwp-online.info/fachgebiete/oralchirurgie/grundlagen/3d-druck-techno…,(dernière consultation 07.12.2022)
- Xu J, et al : Polymers 2020 ; 12(6) : 1237. www.mdpi.com/2073-4360/12/6/1237
- Augustine R : Skin bioprinting : une nouvelle approche pour créer de la peau artificielle à partir de blocs de construction synthétiques et naturels. Prog. Biomater 2018 ; 7 : 77-92.
- Malik HH, et al : Impression tridimensionnelle en chirurgie : une revue des applications chirurgicales actuelles. J Surg Res 2015 ; 199 : 512-522.
- Gutierrez-Rivera A, et al : A protocol for enrichment of CD34+ stromal cell fraction through human skin disaggregation and magnetic separation. J Dermatol Sci 2010 ; 59 : 60-62.
- Hennessy R, Markey MK, Tunnell JW : J Biomed Opt 2015 ; 20 : 27001.
- “Le paysage de la recherche en Suisse. Un panorama technologique”, www.satw.ch/fileadmin/user_upload/SATW_Forschungslandschaft_Schweiz_SBFI…,(dernière consultation 07.12.2022).
DERMATOLOGIE PRATIQUE 2022 ; 32(6) : 31











