L’étiologie du syndrome du côlon irritable est multifactorielle. La modification du mode de vie est une composante importante du traitement de fond. Le choix de la méthode thérapeutique doit être fait avec le patient. Une psychothérapie devrait être proposée en cas d’évolution grave et de comorbidités psychologiques.
Le syndrome du côlon irritable se manifeste par de nombreux symptômes, au premier rang desquels figurent les douleurs abdominales, l’irrégularité des selles et les ballonnements [1,2]. Les symptômes conditionnent une réduction subjectivement très ressentie de la qualité de vie et du quotidien des personnes concernées, sans corrélats somatiques (biochimiques et/ou structurels) suffisamment explicatifs [3].
Définitions
Au niveau national et international, différentes définitions peuvent être appliquées au syndrome du côlon irritable. Les critères Rome IV (2017) sont les plus utilisés dans le monde [4]. En Allemagne, la définition est celle du guide S3 (actuellement en cours de révision) [1]. Selon cette ligne directrice, les symptômes sont liés à l’intestin, à l’exclusion de toute maladie organique, et durent depuis au moins trois mois, ce qui réduit la qualité de vie des patients [1]. Le syndrome du côlon irritable post-infectieux est une forme particulière qui est probablement due à des modifications du microbiome, de l’axe intestin-cerveau et de la réponse immunitaire [5]. Les critères de Rome IV divisent en quatre sous-types (classification selon la Bristol Stool Form Scale [BSFS]) [4,6]:
- RDS-D (diarrhée)
- >25% des selles sont liquides ou contiennent des grumeaux mous (types 6 et 7)
- RDS-C (constipation)
- >25% des selles boulettes solides ou ressemblant à des saucisses, grumeleuses (types 1 et 2)
- RDS-M (mixte)
- >25% des chaises de type 1 et 2 ; >25% de type 6 et 7
- RDS-U (non-sous-type)
- ne peut être classé sur la base de la BSFS
Les comorbidités : Les maladies concomitantes jouent un rôle important dans le contexte du syndrome du côlon irritable. Une méta-analyse a montré que jusqu’à 94% des patients atteints du syndrome du côlon irritable souffrent de comorbidités psychologiques qui ont un impact sur l’évolution de la maladie et la sévérité des symptômes [7]. Les troubles anxieux et la dépression sont deux comorbidités psychologiques qui sont souvent associées au syndrome du côlon irritable et qui, à leur tour, augmentent également de manière significative le risque de genèse du syndrome du côlon irritable [8,9].
Aspects épidémiologiques : Des études récentes montrent une prévalence de plus en plus élevée du syndrome du côlon irritable (11,2% dans le monde). Il convient de noter que ce chiffre dépasse les prévalences cumulées des maladies inflammatoires chroniques de l’intestin et de la maladie cœliaque [3,10]. Les femmes sont plus souvent touchées par la maladie que les hommes (2:1) [11]. Compte tenu de la prévalence élevée, on peut également imaginer l’ampleur des coûts socio-économiques engendrés. Ainsi, seuls les coûts directs s’élèvent en moyenne à 572 euros par patient et par an [12].
Physiopathologie
Les facteurs étiologiques du syndrome du côlon irritable n’ont pas encore été entièrement étudiés et compris. Il est cependant certain que l’origine est multifactorielle, le modèle biopsychosocial de la maladie offrant la meilleure approche explicative [13]. Selon ce dernier, des facteurs somatiques, psychologiques et sociaux s’entremêlent et se combinent pour déterminer le syndrome du côlon irritable (figure 1).
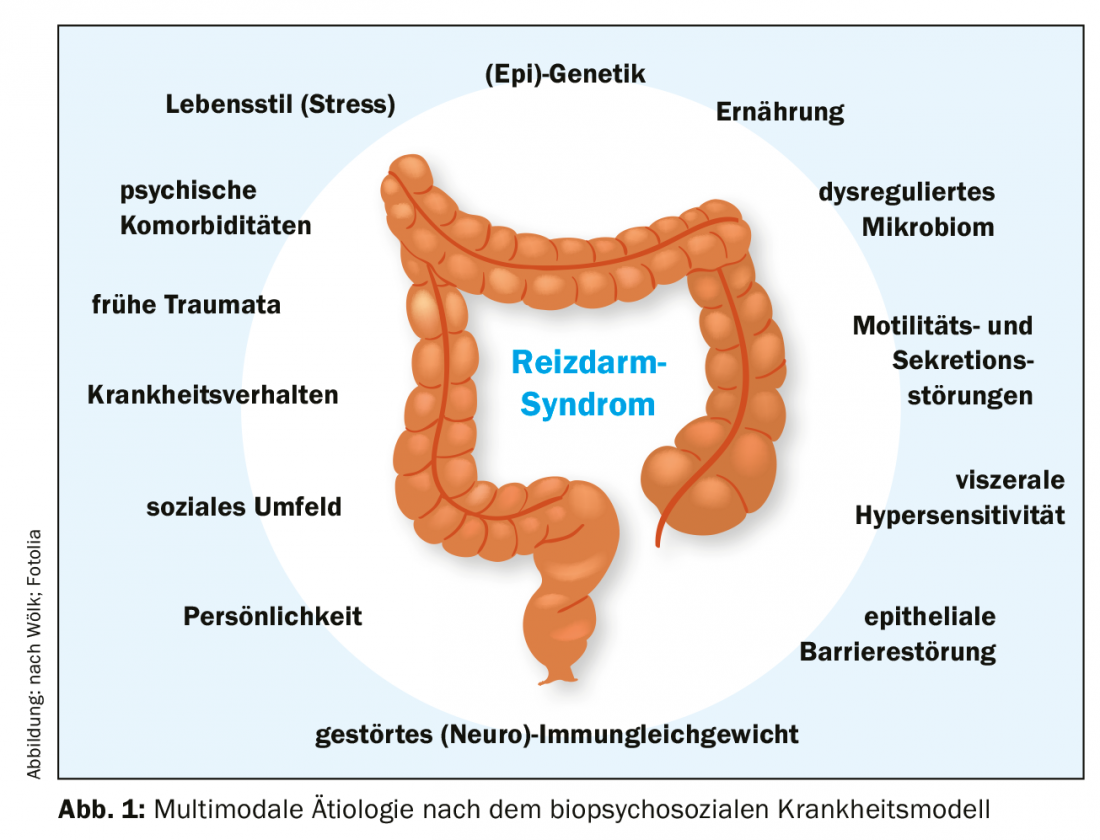
Les aspects biologiques : Les facteurs d’influence somatiques font actuellement l’objet d’une grande attention de la part des chercheurs. Le microbiome est également une cible thérapeutique potentielle importante [14,15]. Les patients présentent une composition modifiée de la flore intestinale par rapport aux témoins sains [14], bien que les données à ce sujet ne soient pas encore homogènes. Le microbiome semble également influencer l’axe intestin-cerveau dysfonctionnel dans le syndrome du côlon irritable (axe microbiome-cerveau intestinal) et pourrait expliquer la forme post-infectieuse du syndrome du côlon irritable ainsi que le risque accru après l’utilisation d’antibiotiques [3,5,16].
D’autres changements biologiques incluent une sensibilité viscérale accrue [17] et une perméabilité accrue de la barrière épithéliale gastro-intestinale [18], souvent associée à des altérations de l’équilibre (neuro)immunitaire avec une augmentation des cellules endocrines/paracrines actives dans la muqueuse [19]. Enfin, les aspects génétiques ne sont pas les moindres [3].
De plus, la motilité et la sécrétion du côlon sont modifiées, ce qui constitue une approche thérapeutique [20]. L’axe intestin-cerveau joue un rôle important dans ces changements et contribue très probablement à l’association avec les maladies mentales [21].
Aspect psychosocial : les comorbidités psychiques contribuent d’une part à l’apparition du syndrome du côlon irritable et augmentent d’autre part le risque d’évolution grave et réfractaire de la maladie [7]. Inversement, le syndrome du côlon irritable est également un facteur de risque pour les troubles anxieux, la dépression et d’autres troubles somatoformes [8,9]. L’axe hypothalamo-hypophyso-surrénalien (axe HPA) joue un rôle important dans ce contexte [22,23]. En cas de stimulation chronique (par exemple par un stress prolongé), des cascades de signaux inflammatoires sont déclenchées dans le tractus gastro-intestinal, ce qui peut contribuer au maintien et/ou à l’aggravation des symptômes. Les comportements pathologiques acquis, le statut socio-économique et les expériences traumatiques vécues dans la petite enfance sont d’autres aspects importants qui peuvent contribuer à l’apparition et à la persistance du syndrome du côlon irritable [10,24,25].
Diagnostic
En raison de la diversité des expressions symptomatiques, un algorithme diagnostique unique est particulièrement important. Le guide S3 donne un schéma clair pour cela, selon lequel le diagnostic d’exclusion du syndrome du côlon irritable doit être attribué après un diagnostic de base défini et l’exclusion individuelle des diagnostics différentiels pertinents (Fig. 2) [1]. Il existe de nombreux diagnostics différentiels possibles, c’est pourquoi il convient de procéder en fonction de la constellation et de l’évolution temporelle des symptômes [1].
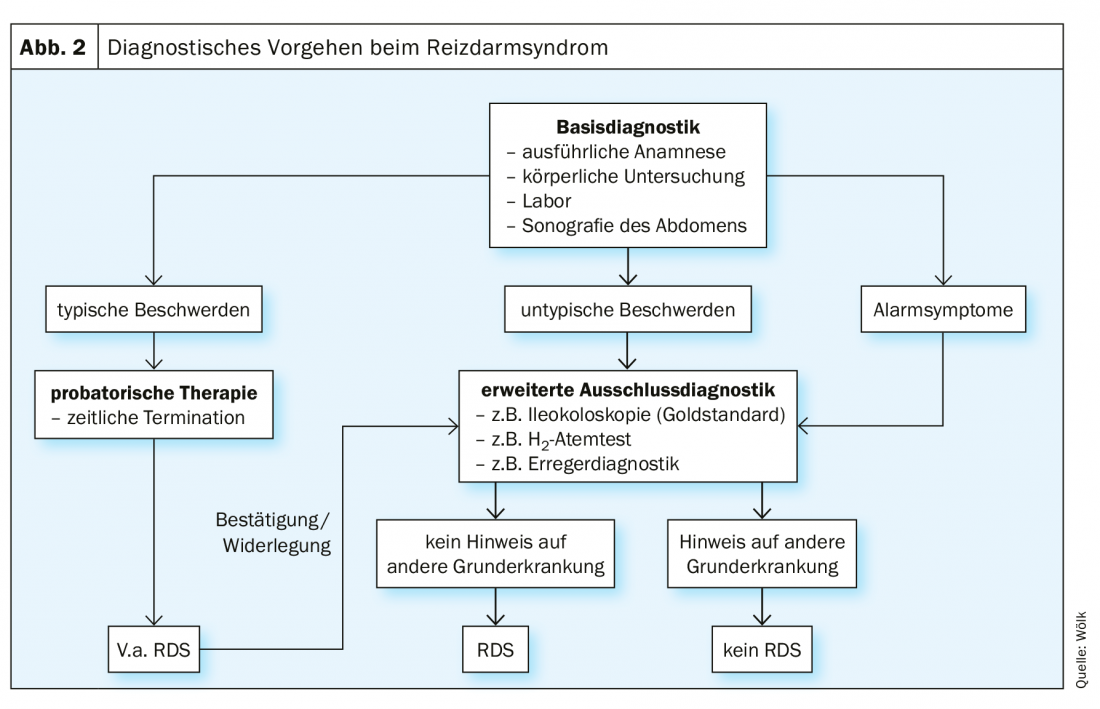
La première étape du diagnostic de base est l’anamnèse, au cours de laquelle une attention particulière doit être portée aux symptômes d’alarme (par exemple perte de poids, sang dans les selles, etc.) [1]. Ceux-ci donnent des indications sur les corrélations des troubles au niveau somatique, ce qui nécessite un examen approprié [1]. L’examen physique, la prise d’un bilan de base et une échographie de l’abdomen sont ensuite réalisés [1]. Toutefois, un diagnostic de certitude ne peut être établi qu’après un diagnostic individuel d’exclusion [1]. Cela inclut une iléocoloscopie, surtout en cas de diarrhée [1]. En présence de symptômes typiques, il convient de suspecter un syndrome du côlon irritable et de commencer un traitement probatoire [1].
Thérapie
La pathogenèse multifactorielle décrite précédemment ouvre un large éventail d’options thérapeutiques, qui comprennent des mesures générales, pharmacologiques et psychologiques. Cependant, cela rend également difficile la formulation de recommandations thérapeutiques générales. La relation de confiance entre le médecin et le patient est particulièrement importante dans le traitement du syndrome du côlon irritable [1,26]. Cela permet de déterminer la meilleure stratégie thérapeutique dans l’esprit du shared decision making [27]. Un entretien psycho-éducatif initial constitue la base de cette démarche [26]. Les objectifs du traitement pourraient être définis comme le soulagement des symptômes et l’amélioration de la qualité de vie, étant donné que seuls 10% des patients atteignent une absence totale de symptômes [28]. Les options thérapeutiques sont divisées en trois catégories ci-dessous.
Modification du mode de vie et de l’alimentation
Un mode de vie équilibré : En ce qui concerne le mode de vie, il convient de procéder à des ajustements individuels. Les techniques de relaxation et la pratique régulière d’un exercice modéré (3 à 5 fois par semaine) pour stimuler la motilité du côlon ont montré un effet positif sur la sévérité des symptômes dans un essai clinique randomisé (ECR) [29].
Le yoga doit être considéré comme une technique de relaxation efficace. Intégrer le yoga dans la vie quotidienne est une possibilité qui a montré une amélioration significative des symptômes, des niveaux d’anxiété et de la qualité de vie dans une méta-analyse récente de six ECR [30].
Il faut également veiller à dormir suffisamment, car les troubles du sommeil accompagnent souvent le syndrome du côlon irritable [31]. La consommation de nicotine n’est pas un facteur de risque fondé sur des preuves, mais elle devrait être minimisée dans le cadre d’un mode de vie généralement sain [31,32]. En raison de l’influence du mode de vie sur l’axe HPA, celui-ci peut avoir un impact sur la sévérité du syndrome du côlon irritable [22,23].
Mesures diététiques : L’alimentation est l’un des principaux facteurs associés à l’expression subjective des symptômes et à la diminution de la qualité de vie, par exemple par l’évitement et la peur d’aliments spécifiques [33,34]. En cas d’intolérance alimentaire connue, en particulier de malabsorption des glucides, ceux-ci doivent être réduits en conséquence dans le régime [35,36]. Un régime réduit en gluten peut être envisagé, car il peut conduire à un soulagement des symptômes, en particulier chez les patients présentant des taux élevés d’immunoglobulines G (IgG), comme l’a montré une méta-analyse [37,38]. Il reste cependant beaucoup à faire en matière de recherche sur le mécanisme exact de la pathologie. Il convient de noter que les essais thérapeutiques doivent être réévalués au plus tard après trois mois [1].
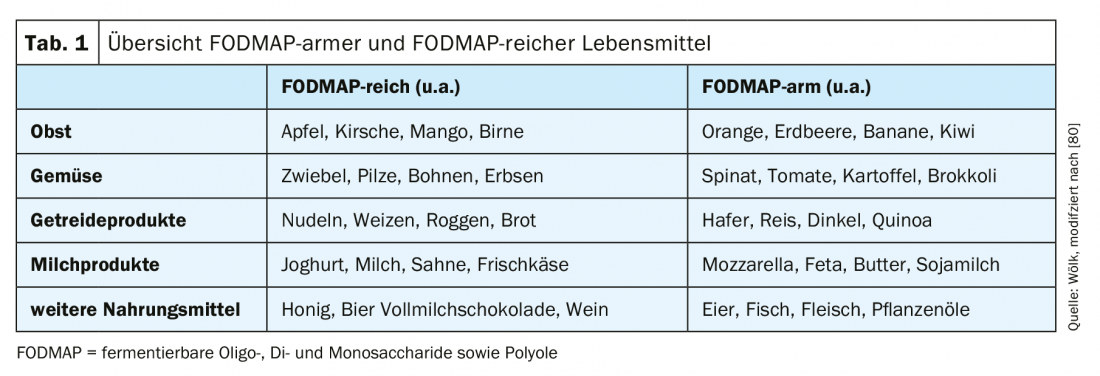
Le régime dit “pauvre en FODMAP” (“oligo-, di- et monosaccharides et polyols fermentescibles”) est actuellement au centre du traitement du syndrome du côlon irritable (tab. 1). Les FOPMAPs sont décomposés et fermentés dans l’intestin par le microbiome. Il en résulte la formation de gaz et d’acides gras libres ainsi qu’une liaison accrue avec l’eau, ce qui peut entraîner une aggravation des symptômes par une sécrétion accrue [3,39,40]. Cependant, les régimes très stricts et de longue durée présentent un risque de carence [41]. Des méta-analyses montrent des effets positifs du régime pauvre en FODMAP, mais cela a souvent été évalué de manière aiguë et des études à long terme sont en attente [42,43]. Une méta-analyse récente portant sur un total de douze études (six ECR et six études de cohorte) a montré qu’une réduction des FODMAPs pouvait améliorer les symptômes, notamment les douleurs abdominales et les ballonnements [42]. Ainsi, le régime pauvre en FODMAP peut être un élément thérapeutique utile dans le traitement du syndrome du côlon irritable, mais en veillant à fournir suffisamment de micronutriments, de vitamines et d’oligo-éléments.
Traitement pré-, pro- et antibiotique : en l’état actuel des choses, les preuves de l’utilité thérapeutique d’un traitement ciblant le microbiome sont encore rares [44]. Les prébiotiques sont définis comme des composants alimentaires non digestibles qui stimulent la croissance de certaines souches bactériennes. Les probiotiques sont des bactéries vivantes qui ont un impact positif sur le microbiome, et les antibiotiques ont pour cible le microbiome, en réduisant autant que possible les espèces productrices de gaz [44].
Pour un traitement efficace des troubles selon le sous-type, il est essentiel de connaître les combinaisons de souches bactériennes et de substances actives nécessaires, qui font encore l’objet de recherches [44]. La méthodologie hétérogène des différents essais cliniques randomisés portant sur différentes souches bactériennes (même en combinaison, souvent à des concentrations très différentes) rend actuellement difficile toute recommandation claire de traitement [44,45]. Cependant, les souches Bifidobacterium (B.) infantis et B. animalis ssp. lactis d’agir contre les ballonnements, Lactobacillus casei Shirota également contre la constipation (niveau de preuve B dans les lignes directrices S3) [1]. L’antibiotique rifaximine réduit les espèces bactériennes productrices de gaz et peut être utilisé à titre expérimental dans le cadre de troubles liés au ballonnement [44,46].
Pharmacothérapie axée sur les symptômes
En cas de succès insuffisant des mesures générales, un traitement médicamenteux symptomatique ciblé sur les symptômes du patient doit être mis en place (tableau 2) [1]. Celle-ci diffère selon le sous-type.
Douleur : la première classe de substances utilisées pour traiter les douleurs abdominales sont les spasmolytiques comme la butylscopolamine [1]. L’effet anticholinergique du parasympathicolytique inhibe les muscles lisses et diminue les crampes et les douleurs [47].
En alternative ou en complément, on peut essayer des produits phytothérapeutiques, en particulier l’huile de menthe poivrée ou l’huile de cumin, qui peuvent toutes deux obtenir des réductions significatives de la douleur dans une grande méta-analyse de 2008 et également selon des analyses actuelles [1,48,49]. L’huile de menthe poivrée, dans une composition spéciale libérée dans l’intestin grêle, a montré de bons effets sur le syndrome du côlon irritable dans un essai clinique randomisé récent [50]. Si la douleur n’est pas suffisamment réduite, il existe l’option des antagonistes 5HT3 (par exemple l’ondansétron), qui ont un effet antispasmodique et inhibiteur de la motilité grâce à leur action antisérotoninergique.
Les antidépresseurs (antidépresseurs tricycliques [TZA] dans le sous-type RDS-D et inhibiteurs sélectifs de la recapture de la sérotonine [SSRI] dans le RDS-O), administrés à faible dose, ont également de bons effets [1,3,51,52]. A plus forte dose, les antidépresseurs agissent également contre les comorbidités psychiques et sont utilisés en conséquence [52].
Diarrhée : les irrégularités des selles (fréquence accrue et consistance liquide) peuvent être traitées par des médicaments qui prolongent le transit colique et inhibent les sécrétions [3]. Les classes de substances appropriées sont donc les agonistes des récepteurs opioïdes, comme le lopéramide, un agoniste des récepteurs opioïdes μ (qui ne traverse pas la barrière hémato-encéphalique) [1]. Selon les recherches actuelles, l’eluxadoline peut être plus bénéfique en tant qu’agoniste des récepteurs opioïdes μ et κ et antagoniste des récepteurs opioïdes δ, car elle agit en plus sur la douleur [53]. Cependant, le traitement par l’eluxadoline est très coûteux [54].
En outre, les inhibiteurs de la résorption des acides biliaires (par exemple la colestyramine) constituent une option thérapeutique [1]. Il a été démontré que le sous-type RDS-D peut être associé à une perte accrue d’acides biliaires [55]. La colestyramine réduit l’effet laxatif des acides biliaires libres en liant ces derniers [55], c’est pourquoi, en cas de perte importante d’acides biliaires, les symptômes ont été soulagés avec un taux de réussite de 96% [55]. Les spasmolytiques, les antagonistes 5HT3 et les TZA (surtout l’amitryptiline) peuvent également être utilisés dans le sous-type RDS-D [1,51,52].
Constipation : la constipation est traitée médicalement en augmentant la sécrétion et en réduisant le temps de transit du côlon [3]. Les laxatifs de type osmotique (p. ex. macrogol), qui fluidifient les selles en fixant l’eau et facilitent la défécation, constituent le remède de choix [1,48,54]. Les fibres hydrosolubles comme le psyllium agissent selon le même principe et doivent également être envisagées, en veillant à un apport hydrique suffisant (1,5 à 2 l/j) [1,56].
Afin d’induire la sécrétion dans le côlon et d’augmenter la motilité, la lubiprostone active des canaux de chlorure et constitue donc une alternative [57]. Le prucalopride (agoniste 5HT4) et les ISRS stimulent la motilité colique en tant que médicaments pro-sérotoninergiques et peuvent être essayés en cas de constipation sévère réfractaire [1,52,58]. Les TZA provoquent souvent une constipation comme effet secondaire, c’est pourquoi ils ne devraient pas être utilisés ici [1,52]. En tant qu’agent phytothérapeutique, STW-5 a eu un effet bénéfique [59].
Les ballonnements : Le ballonnement, qui se traduit par un météorisme, une distension abdominale et des flatulences, est dû à une augmentation de la production de gaz par le microbiote et est souvent un symptôme associé à la constipation [1,3]. Les liants gazeux (par exemple le siméthicone) peuvent constituer une tentative de traitement, mais leur effet est souvent limité [1]. Il a été démontré que l’antibiotique rifaximine, qui agit en réduisant les espèces bactériennes de la flore intestinale produisant des gaz, avait de bons effets sur les flatulences [46,60]. Cependant, l’effet n’a été démontré qu’à court terme (41% d’amélioration avec le traitement par rifaximine contre 23% dans le groupe placebo) [46,60].
Psychothérapie
La psychothérapie est un troisième pilier thérapeutique, surtout dans les cas graves et réfractaires. Celle-ci est recommandée dans les lignes directrices, car elle aborde l’étiologie multimodale également du côté des aspects psychologiques et sociaux [1]. L’axe intestin-cerveau, déjà mentionné à plusieurs reprises, est bidirectionnel, ce qui fait que les troubles gastro-intestinaux ont d’une part un effet négatif sur l’anxiété et la dépressivité par exemple (bottom-up) ; d’autre part, les traits de caractère, les comportements et les modes de pensée ainsi que les comportements relationnels conditionnent la perception et la gravité des symptômes (top-down) [61]. L’approche psychothérapeutique a un impact particulier sur la qualité de vie des patients [62].
La forme de psychothérapie qui présente le plus de preuves est la thérapie cognitivo-comportementale (TCC) [63], une méta-analyse de 18 essais cliniques randomisés (n=1380) ayant montré un NNT (Number-Needed-to-Treat) de trois patients pour la TCC [3,63]; ce résultat est donc nettement meilleur que pour les interventions pharmacologiques, par exemple. En outre, les méthodes psychodynamiques, l’hypnothérapie liée à l’intestin ainsi que la thérapie basée sur la pleine conscience et d’autres méthodes (psychoéducation, auto-assistance et méthodes de relaxation) constituent des points de départ psychothérapeutiques et sont présentées ci-après (tab. 3) [3].
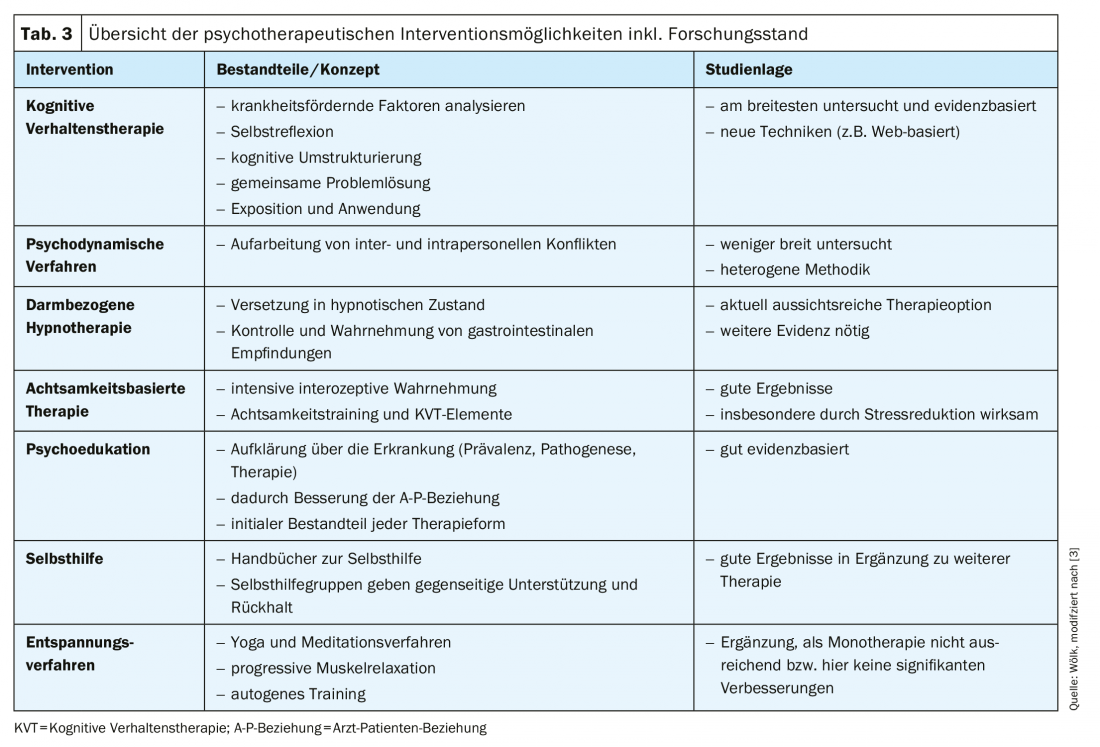
Thérapie cognitivo-comportementale : la base importante d’une TCC réussie est la relation de confiance et d’ouverture du thérapeute avec le patient [64]. Ainsi, dès 1995, une étude prospective a montré qu’une relation médecin-patient positive réduisait la nécessité de consultations ultérieures [64].
Le thérapeute travaille de manière psycho-éducative en expliquant d’abord au patient le contexte et les liens du tableau clinique [65]. Il aide à réfléchir à son propre comportement et à ses pensées qui aggravent les symptômes, puis à les restructurer cognitivement [65]. Ensuite, la thérapie comprend une recherche commune de stratégies de résolution et leur application par le biais d’une exposition à des situations stressantes [65]. Cette procédure a entraîné une amélioration significative de la qualité de vie (d=0,49) [66–68]. Toutefois, aucun avantage n’a été constaté par rapport à d’autres méthodes psychothérapeutiques [3]. La disponibilité limitée des TCC dans les soins primaires implique la nécessité d’étudier plus avant, par exemple, les offres de TCC basées sur le web [69].
Les méthodes psychodynamiques : Comme alternative à la TCC, les méthodes psychodynamiques peuvent être utilisées dans la thérapie. Elles visent à traiter les conflits interpersonnels et intrapersonnels qui peuvent être impliqués dans l’apparition des symptômes du syndrome du côlon irritable [70].
Les études sur cette forme de thérapie ne sont toutefois pas aussi nombreuses que celles sur la TCC. De même, le contenu des thérapies est plus hétérogène dans les études que dans le cas de la TCC [3]. Ce
L’hétérogénéité réduit la comparabilité des études correspondantes. Néanmoins, les méthodes psychodynamiques constituent une option relativement peu coûteuse pour traiter les patients dont l’évolution de la maladie est surtout grave [71].
Cependant, un essai clinique randomisé (n=257) n’a pas montré de supériorité de la thérapie psychodynamique par rapport au traitement par la paroxétine uniquement (ISRS, 20 mg/j) pendant trois mois. Les deux groupes ont montré une amélioration significative de la qualité de vie par rapport au traitement standard [1,71].
Hypnothérapie liée à l’intestin : en tant que forme particulière d’hypnothérapie, elle doit être distinguée des autres méthodes énumérées [3]. L’objectif de l’état modifié de conscience est de retrouver le contrôle des perceptions gastro-intestinales et d’améliorer ainsi la symptomatologie [72].
L’hypnothérapie se présente actuellement comme une intervention psychothérapeutique prometteuse. Dans une grande cohorte de 1000 patients atteints du syndrome du côlon irritable, une diminution significative de la sévérité des symptômes, définie par une réduction d’au moins 50 points du score de sévérité des symptômes du SCI (IBS-SSS), a été obtenue chez 76% des patients [73].
Le NNT est de quatre patients, celui-ci se référant à 452 patients issus de sept essais cliniques randomisés [3]. Selon une revue récente, jusqu’à 73% des patients répondent positivement à l’hypnothérapie liée à l’intestin [3,72]. Les inconvénients de l’hypnothérapie intestinale sont sa disponibilité encore très limitée et son coût relativement élevé [3].
Thérapie basée sur la pleine conscience : la thérapie basée sur la pleine conscience est la dernière méthode psychothérapeutique que nous allons examiner de plus près, car elle permet notamment de réduire la détresse ressentie à cause de la maladie [74]. La combinaison d’éléments de pleine conscience et d’éléments cognitifs permet d’entraîner la perception et l’autoréflexion en permettant une meilleure thérapie après une perception interoceptive intensive des symptômes [3]. La thérapie s’étend généralement sur une période de huit semaines [3,74].
Les études sur ce sujet sont malheureusement peu nombreuses. Une étude clinique randomisée menée sur 75 femmes a montré que la forme de traitement entraînait une réduction significative des symptômes (26,4% vs 6,2%) par rapport au groupe témoin et que l’amélioration se poursuivait après trois mois, tandis qu’une autre étude clinique a décrit une harmonisation de l’amélioration des symptômes par le traitement par rapport au groupe témoin après six mois (n=90). [74,75]. Cela permet de supposer un effet plutôt à court terme de cette forme de thérapie. Cependant, les faiblesses méthodologiques réduisent la pertinence des études, et des recherches supplémentaires sont donc indiquées. Ainsi, une étude pilote menée cette année a montré des résultats prometteurs pour la thérapie basée sur la pleine conscience (réduction du stress plus importante qu’avec la thérapie comportementale dialectique) [76].
Autres alternatives : Les interventions psychothérapeutiques alternatives viennent en complément des formes de thérapie mentionnées. Les lignes directrices recommandent la psychoéducation, l’auto-assistance et les méthodes de relaxation comme options [1].
La psychoéducation, au sens de l’explication de la genèse biopsychosociale telle que décrite précédemment, est importante pour la relation médecin-patient fonctionnelle et pour que le patient se sente perçu et compris avec ses souffrances [13,64].
L’auto-assistance passe par exemple par des manuels, qui peuvent être recommandés selon les études actuelles (réduction significative, de 60%, des consultations médicales après un an d’utilisation d’un manuel) [1,77]. Les procédés de détente peuvent être utilisés en combinaison, il n’y a pas d’évidence convaincante pour la monothérapie [1,78].
Perspectives
Le syndrome du côlon irritable est une pathologie multifactorielle présente dans le monde entier [12]. Les facteurs pathogéniques possibles entraînent une multitude d’approches thérapeutiques. Les rôles de l’alimentation (p. ex. teneur en FODMAP) et du microbiome sont importants, car la flore bactérienne peut être influencée par les pré-, pro- et antibiotiques, et peut-être aussi par le transfert du microbiome fécal (FMT). Le FMT doit toutefois être considéré avec prudence, car les études sur ce sujet sont encore rares et seuls des résultats limités ont été obtenus dans le cadre d’un essai clinique randomisé [79]. De plus, il existe de nombreuses options médicamenteuses pour le traitement des symptômes. Bien que les psychotropes soient peu appréciés des patients (et souvent aussi des médecins), les méta-analyses montrent qu’ils constituent des options thérapeutiques très favorables. La psychothérapie doit être proposée en particulier aux patients présentant une évolution sévère et des comorbidités psychologiques. La TCC, la psychothérapie psychodynamique, mais aussi l’hypnothérapie intestinale et la thérapie basée sur la pleine conscience sont des méthodes appropriées à cet égard.
Messages Take-Home
- La genèse du syndrome du côlon irritable est multifactorielle et s’explique par le modèle biopsychosocial de la maladie.
- Des modifications du mode de vie (par ex. réduction du stress) devraient être apportées comme traitement de base.
- L’hypnothérapie liée à l’intestin est encore difficilement réalisable en raison d’une disponibilité limitée.
- Le choix de la forme de traitement doit être fait avec le patient.
- La psychothérapie doit être proposée en cas d’évolution grave et de comorbidités psychologiques.
Littérature :
- Layer P, et al : Irritable bowel syndrome : German consensus guidelines on definition, pathophysiology and management. Z Gastroenterol, 2011. 49(2) : 237-293.
- Mearin F, et al : Troubles de l’intestin grêle. Gastroenterology, 2016.
- Enck P, et al : Syndrome de l’intestin irritable. Nature Reviews Disease Primers, 2016. 2 : 16014.
- Lacy BE, Patel NK : Rome Criteria and a Diagnostic Approach to Irritable Bowel Syndrome (Critères de Rome et approche diagnostique du syndrome de l’intestin irritable). J Clin Med, 2017. 6(11).
- Lee YY, Annamalai C,Rao SSC : Syndrome de l’intestin irritable post-infectieux. Curr Gastroenterol Rep, 2017. 19(11): 56.
- Lewis SJ. Heaton KW : Stool form scale as a useful guide to intestinal transit time. Scand J Gastroenterol, 1997. 32(9) : 920-924.
- Whitehead WE, Palsson O, Jones KR : Systematic review of the comorbidity of irritable bowel syndrome with other disorders : what are the causes and implications ? Gastroenterology, 2002. 122(4) : 1140-1456.
- Ford AC, et al : Irritable bowel syndrome : a 10-yr natural history of symptoms and factors that influence consultation behavior. Am J Gastroenterol, 2008. 103(5) : 1229-1239 ; quiz 1240.
- Sibelli A, et al : A systematic review with meta-analysis of the role of anxiety and depression in irritable bowel syndrome onset. Psychol Med, 2016. 46(15) : 3065-3080.
- Lovell RM, Ford AC : Prévalence globale et facteurs de risque du syndrome de l’intestin irritable : une méta-analyse. Clin Gastroenterol Hepatol, 2012. 10(7) : 712-721.e4.
- Lovell RM, Ford AC : Effet du genre sur la prévalence du syndrome de l’intestin irritable dans la communauté : revue systématique et méta-analyse. Am J Gastroenterol, 2012. 107(7) : 991-1000.
- Thomas G, Grobe SS, Szecsenyi J : BARMER-Arztreport 2019 in Schriftenreihe zur Gesundheitsanalyse. 2019.
- Tanaka Y, et al : Modèle biopsychosocial du syndrome de l’intestin irritable. J Neurogastroenterol Motil, 2011. 17(2) : 131-139.
- Carroll IM, et al. : Alterations dans la composition et la diversité du microbiote intestinal chez les patients atteints du syndrome de l’intestin irritable à prédominance diarrhéique. Neurogastroenterol Motil, 2012. 24(6) : 521-530, e248.
- Carroll IM, et al : Analyse moléculaire du microbiote intestinal luminal et muqueux dans le syndrome de l’intestin irritable prédominé par la diarrhée. Am J Physiol Gastrointest Liver Physiol, 2011. 301(5) : G799-807.
- Moser G, Fournier C, Peter J : Microbiome intestinal- axe du bon cerveau et syndrome de l’intestin irritable. Wien Med Wochenschr, 2018. 168(3-4): 62-66.
- Zhou Q, Zhang B, Verne GN : Perméabilité de la membrane intestinale et hypersensibilité dans le syndrome de l’intestin irritable. Pain, 2009. 146(1-2): 41-6.
- Piche T, et al. : Impaired intestinal barrier integrity in the colon of patients with irritable bowel syndrome : involvement of soluble mediators. Gut, 2009. 58(2) : 196-201.
- Barbara G, et al : Le système immunitaire dans le syndrome de l’intestin irritable. J Neurogastroenterol Motil, 2011. 17(4) : 349-359.
- Larsson MH, et al : Elevated motility-related transmucosal potential difference in the upper small intestin in the irritable bowel syndrome. Neurogastroenterol Motil, 2007. 19(10) : 812-820.
- Elsenbruch S, et al : Les patients atteints du syndrome de l’intestin irritable ont une modulation émotionnelle altérée des réponses neurales aux stimuli viscéraux. Gastroenterology, 2010. 139(4) : 1310-1319.
- Walter SA, et al : Stress pré-expérimental chez les patients atteints du syndrome du côlon irritable : taux élevés de cortisol avant même la provocation de symptômes avec distension rectale. Neurogastroenterol Motil, 2006. 18(12) : 1069-1077.
- FitzGerald LZ, Kehoe, Sinha K : Dérégulation de l’axe hypothalamo-pituitaire-adrénal chez les femmes atteintes du syndrome de l’intestin irritable en réponse à un stress physique aigu. West J Nurs Res, 2009. 31(7) : 818-836.
- O’Mahony SM, et al : Irritable Bowel Syndrome and Stress-Related Psychiatric Co-morbidities : Focus on Early Life Stress. Handb Exp Pharmacol, 2017. 239 : 219-246.
- Whitehead WE, et al : Learned illness behavior in patients with irritable bowel syndrome and peptic ulcer. Dig Dis Sci, 1982. 27(3) : 202-208.
- Di Palma JA, Herrera JL : Le rôle d’une communication efficace entre le clinicien et le patient dans la gestion du syndrome de l’intestin irritable et de la constipation chronique. J Clin Gastroenterol, 2012. 46(9) : 748-751.
- Towle A, Godolphin W : Cadre pour l’enseignement et l’apprentissage informés par la prise de décision partagée. Bmj, 1999. 319(7212) : 766-771.
- Hauser W, et al : Functional bowel disorders in adults. Dtsch Arztebl Int, 2012. 109(5) : 83-94.
- Johannesson E, et al : L’activité physique améliore les symptômes dans le syndrome de l’intestin irritable : un essai contrôlé randomisé. Am J Gastroenterol, 2011. 106(5) : 915-922.
- Schumann D, et al : Effet du yoga dans le traitement du syndrome de l’intestin irritable : A Systematic Review. Clin Gastroenterol Hepatol, 2016. 14(12) : 1720-1731.
- Tu Q, et al : Sleep disturbances in irritable bowel syndrome : a systematic review. Neurogastroenterol Motil, 2017. 29(3).
- Sirri L, Grandi S, Tossani E : Smoking in Irritable Bowel Syndrome : A Systematic Review. J Dual Diagn, 2017. 13(3) : 184-200.
- Bohn L, Storsrud S, Simren M : Nutrient intake in patients with irritable bowel syndrome compared to the general population. Neurogastroenterol Motil, 2013. 25(1) : 23-30.e1.
- Bohn L, et al : Les symptômes gastro-intestinaux auto-reportés liés à l’alimentation dans le SII sont communs et associés à des symptômes plus graves et à une qualité de vie réduite. Am J Gastroenterol, 2013. 108(5) : 634-641.
- Goldstein R, Braverman D, Stankiewicz H : Malabsorption des glucides et effet de la restriction alimentaire sur les symptômes du syndrome de l’intestin irritable et les troubles fonctionnels de l’intestin. Isr Med Assoc J, 2000. 2(8) : 583-587.
- Shepherd SJ, et al : Dietary triggers of abdominal symptoms in patients with irritable bowel syndrome : randomized placebo-controlled evidence. Clin Gastroenterol Hepatol, 2008. 6(7) : 765-771.
- Wahnschaffe U, et al : Predictors of clinical response to gluten-free diet in patients diagnosed with diarrhea-predominant irritable bowel syndrome. Clin Gastroenterol Hepatol, 2007. 5(7) : 844-850 ; quiz 769.
- Atkinson W, et al : Food elimination based on IgG antibodies in irritable bowel syndrome : a randomised controlled trial. Gut, 2004. 53(10) : 1459-1464.
- Cummings JH, Macfarlane GT : Rôle des bactéries intestinales dans le métabolisme des nutriments. JPEN J Parenter Enteral Nutr, 1997. 21(6) : 357-365.
- Gibson PR, Shepherd SJ : Evidence-based dietary management of functional gastrointestinal symptoms : The FODMAP approach. J Gastroenterol Hepatol, 2010. 25(2) : 252-258.
- Catassi G, et al : The Low FODMAP Diet : Many Question Marks for a Catchy Acronym. Nutrients, 2017. 9(3).
- Altobelli E, et al : Low-FODMAP Diet Improves Irritable Bowel Syndrome Symptoms : A Meta-Analysis. Nutrients, 2017. 9(9).
- Varju P, et al : Low fermentable oligosaccharides, disaccharides, monosaccharides and polyols (FODMAP) diet improves symptoms in adults suffering from irritable bowel syndrome (IBS) compared to standard IBS diet : A meta-analysis of clinical studies. PLoS One, 2017. 12(8) : e0182942.
- Ford AC, et al. : Systematic review with meta-analysis : the efficacy of prebiotics, probiotics, synbiotics and antibiotics in irritable bowel syndrome. Aliment Pharmacol Ther, 2018. 48(10) : 1044-1060.
- Didari T, et al : Efficacité des probiotiques dans le syndrome de l’intestin irritable : Updated systematic review with meta-analysis. World J Gastroenterol, 2015. 21(10) : 3072-3084.
- Pimentel M, et al : Rifaximin therapy for patients with irritable bowel syndrome without constipation. N Engl J Med, 2011. 364(1) : 22-32.
- Krueger D, et al. : Effet du bromure de butyle hyoscine (Buscopan(R)) sur les voies cholinergiques dans l’intestin humain. Neurogastroenterol Motil, 2013. 25(8) : e530-539.
- Ford AC, Lacy BE, Talley NJ : Syndrome de l’intestin irritable. N Engl J Med, 2017. 376(26) : 2566-2578.
- Ford AC, et al. : Effet de la fibre, des antispasmodiques, et de l’huile de menthe poivrée dans le traitement du syndrome du côlon irritable : revue systématique et méta-analyse. Bmj, 2008. 337 : a2313.
- Cash BD, Epstein MS, Shah SM : A Novel Delivery System of Peppermint Oil Is an Effective Therapy for Irritable Bowel Syndrome Symptoms. Dig Dis Sci, 2016. 61(2) : 560-571.
- Garsed K, et al : A randomised trial of ondansetron for the treatment of irritable bowel syndrome with diarrhoea. Gut, 2014. 63(10) : 1617-1625.
- Moret C, Briley M : Antidépresseurs dans le traitement de la fibromyalgie. Neuropsychiatr Dis Treat, 2006. 2(4) : 537-548.
- Lacy BE, et al : Efficacité de l’eluxadoline chez les patients atteints de SII-D qui ont déclaré avoir utilisé du lopéramide auparavant. Am J Gastroenterol, 2017. 112(6) : 924-932.
- Defrees DN, Bailey J : Syndrome de l’intestin irritable : Épidémiologie, physiopathologie, diagnostic et traitement. Prim Care, 2017. 44(4) : 655-671.
- Wedlake L, et al. : Systematic review : the prevalence of idiopathic bile acid malabsorption as diagnosis by SeHCAT scanning in patients with diarrhea-predominant irritable bowel syndrome. Aliment Pharmacol Ther, 2009. 30(7) : 707-717.
- Zuckerman MJ : The role of fiber in the treatment of irritable bowel syndrome : therapeutic recommendations. J Clin Gastroenterol, 2006. 40(2) : 104-108.
- Li F, et al : Lubiprostone Is Effective in the Treatment of Chronic Idiopathic Constipation and Irritable Bowel Syndrome : A Systematic Review and Meta-Analysis of Randomized Controlled Trials. Mayo Clin Proc, 2016. 91(4) : 456-68.
- Corsetti M, Tack J : Nouvelles options de traitement pharmacologique pour la constipation chronique. Expert Opin Pharmacother, 2014. 15(7) : 927-941.
- Madisch A, et al. : Treatment of irritable bowel syndrome with herbal preparations : results of a double-blind, randomized, placebo-controlled, multi-centre trial. Aliment Pharmacol Ther, 2004. 19(3) : 271-279.
- Pimentel M : Review article : potential mechanisms of action of rifaximin in the management of irritable bowel syndrome with diarrhoea. Aliment Pharmacol Ther, 2016. 43 Suppl 1 : 37-49.
- Fond G, et al : Anxiety and depression comorbidities in irritable bowel syndrome (IBS) : a systematic review and meta-analysis. Eur Arch Psychiatry Clin Neurosci, 2014. 264(8) : 651-660.
- Guthrie E, et al : A randomised controlled trial of psychotherapy in patients with refractory irritable bowel syndrome. Br J Psychiatry, 1993. 163 : 315-321.
- Laird KT, et al. : Efficacité à court terme et à long terme des psychothérapies pour le syndrome de l’intestin irritable : une revue systématique et une méta-analyse. Clin Gastroenterol Hepatol, 2016. 14(7) : 937-947.e4.
- Owens DM, Nelson DK, Talley NJ : The irritable bowel syndrome : long-term prognosis and the physician-patient interaction. Ann Intern Med, 1995. 122(2) : 107-112.
- Kinsinger SW : Cognitive-behavioral therapy for patients with irritable bowel syndrome : current insights. Psychology research and behavior management, 2017. 10 : 231-237.
- Laird KT, et al. : Efficacité comparée des thérapies psychologiques pour améliorer la santé mentale et le fonctionnement quotidien dans le syndrome du côlon irritable : une revue systématique et une méta-analyse. Clinical Psychology Review, 2017. 51 : 142-152.
- Radziwon CD, Lackner JM : Cognitive Behavioral Therapy for IBS : How Useful, How Often, and How Does It Work ? Current Gastroenterology Reports, 2017. 19(10): 49.
- Li L, et al : Cognitive-behavioral therapy for irritable bowel syndrome : a meta-analysis. J Psychosom Res, 2014. 77(1) : 1-12.
- Kawanishi H, et al : Cognitive behavioral therapy with interoceptive exposure and complementary video materials for irritable bowel syndrome (IBS) : protocol for a multicenter randomized controlled trial in Japan. Biopsychosoc Med, 2019. 13 : 14.
- Palsson OS, Whitehead WE : Psychological Treatments in Functional Gastrointestinal Disorders : A Primer for the Gastroenterologist. Gastroentérologie et hépatologie cliniques, 2013. 11(3) : 208-216.
- Creed F, et al : The cost-effectiveness of psychotherapy and paroxetine for severe irritable bowel syndrome. Gastroenterology, 2003. 124(2) : 303-317.
- Peters SL, Muir JG, Gibson PR : Review article : gut-directed hypnotherapy in the management of irritable bowel syndrome and inflammatory bowel disease. Aliment Pharmacol Ther, 2015. 41(11) : 1104-1115.
- Miller V, et al : Hypnotherapy for irritable bowel syndrome : an audit of one thousand adult patients. Aliment Pharmacol Ther, 2015. 41(9) : 844-855.
- Gaylord SA, et al : Mindfulness training reduces the severity of irritable bowel syndrome in women : results of a randomized controlled trial. Am J Gastroenterol, 2011. 106(9) : 1678-1688.
- Zernicke KA, et al : Mindfulness-based stress reduction for the treatment of irritable bowel syndrome symptoms : a randomized wait-list controlled trial. Int J Behav Med, 2013. 20(3) : 385-396.
- Mohamadi J, Ghazanfari F, Drikvand FM : Comparaison de l’effet de la thérapie comportementale dialectique, de la thérapie cognitive basée sur la pleine conscience et de la psychothérapie positive sur le stress perçu et la qualité de vie chez les patients atteints du syndrome de l’intestin irritable : un essai pilote randomisé et contrôlé. Psychiatr Q, 2019. 90(3) : 565-578.
- Robinson A, et al : A randomised controlled trial of self-help interventions in patients with a primary care diagnosis of irritable bowel syndrome. Gut, 2006. 55(5) : 643-648.
- Ford AC, et al. : Efficacité des antidépresseurs et des thérapies psychologiques dans le syndrome du côlon irritable : revue systématique et méta-analyse. Gut, 2009. 58(3) : 367-378.
- Johnsen PH, et al : Faecal microbiota transplantation versus placebo for moderate-to-severe irritable bowel syndrome : a double-blind, randomised, placebo-controlled, parallel-group, single-centre trial. Lancet Gastroenterol Hepatol, 2018. 3(1) : 17-24.
- Storr M : Le guide alimentaire du régime FODMAP : un régime différent pour le côlon irritable, l’intolérance au blé et autres troubles digestifs. 2017 : W. Zuckschwerdt Verlag.
PRATIQUE DU MÉDECIN DE FAMILLE 2019 ; 14(9) : 9-15