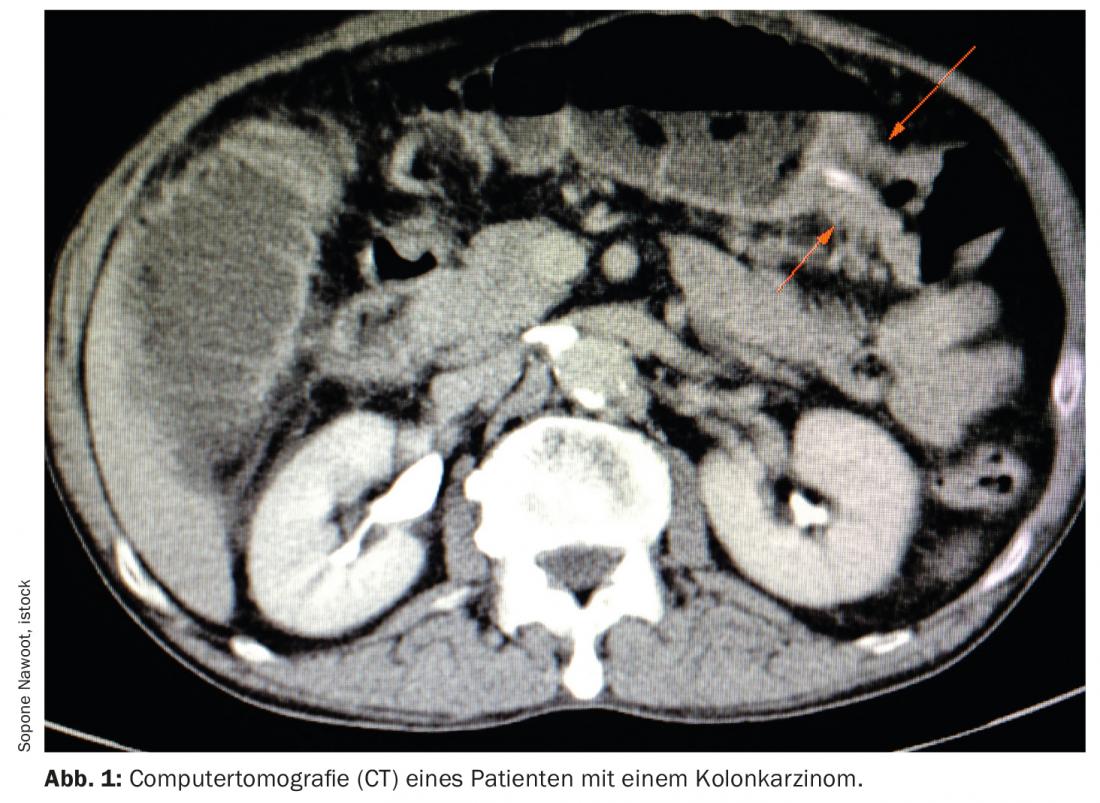
Lorsqu’un événement malin est détecté dans le corps, il est souvent déjà trop tard. Malgré des programmes de traitement complets, toutes les tumeurs ne peuvent pas être traitées efficacement à tous les stades. Dans le tractus gastro-intestinal en particulier, les changements ne sont souvent perceptibles que tardivement. Mais un dépistage généralisé de la population générale n’est pas non plus toujours efficace. Une analyse.
Le dépistage est un examen des personnes asymptomatiques sans maladie connue. Celui-ci a pour objectif de détecter les maladies à un stade précoce afin de permettre un meilleur traitement. La base doit être une certaine fréquence de maladie. Emanuel Burri, de Liestal, a expliqué que le test devait avoir une sensibilité et une spécificité élevées, être rentable, peu contraignant pour la personne concernée et sûr. Le dépistage dans le tractus gastro-intestinal implique l’œsophage, le foie, la bile, l’estomac, le pancréas et le côlon. En ce qui concerne l’œsophage, il faut surtout faire attention à l’œsophage de Barrett. En effet, l’adénocarcinome de la jonction gastro-œsophagienne est en constante augmentation depuis 1975. L’augmentation de l’incidence est de 2,2% par an [1]. Les causes sont principalement liées à l’obésité, qui entraîne un reflux et, à terme, un œsophage de Barrett.
En cas de modifications endoscopiques au-dessus de la jonction gastro-œsophagienne entre l’épithélium pavimenteux et la muqueuse de l’estomac, on parle de Barrett. L’épithélium pavimenteux est remplacé par un épithélium cylindrique, ce qui entraîne une métaplasie intestinale. L’épithélium de Barrett a tendance à devenir dysplasique, ce qui favorise le développement d’un adénocarcinome, selon l’orateur. Le risque de survenue d’un adénocarcinome dans la population générale est de 0,03%, alors qu’il est de 0,12% chez les patients atteints d’œsophage de Barrett. Est-ce que cela vaut la peine de procéder à un dépistage ? Le fait que le reflux gastro-œsophagien soit très fréquent dans la population normale (25-35%) plaide en faveur de cette hypothèse. En cas de reflux chronique, la prévalence de l’œsophage de Barrett est corrélée. Si elle est normalement de 1 à 2 %, elle passe à 7-10 % en cas de reflux chronique. Cependant, 50% des patients atteints d’œsophage de Barrett ne présentent pas de symptômes de reflux chronique et 80% des cancers de Barrett n’ont pas été diagnostiqués avec une maladie de reflux. De plus, dans 95% des cas de carcinome de Barrett, il n’y avait pas de diagnostic connu d’œsophage de Barrett. Burri a résumé en disant que de nombreux carcinomes sont manqués parce que le diagnostic de l’œsophage de Barrett n’est pas posé. Le fait que la progression de l’œsophage de Barrett vers le carcinome de Barrett soit très faible est toutefois un argument contre le dépistage. 95% des patients atteints d’œsophage de Barrett ne meurent pas d’un carcinome de Barrett.
Un dépistage pourrait être effectué à l’aide d’une gastroscopie. L’avantage est la possibilité de réaliser des biopsies ciblées, ce qui permet un diagnostic plus précis. Cependant, les coûts élevés et les différences de qualité dues aux différentes expertises en matière d’endoscopie plaident contre cette approche. Une nouvelle méthode comme l’analyse cytologique par cytosponge intervient ici. Son coût est moins élevé et elle présente une bonne sensibilité (80%) et spécificité (87%) [2,3]. Tout bien considéré, les sociétés savantes ne recommandent pas un dépistage généralisé. Celui-ci devrait être réservé aux patients à haut risque. Les patients à haut risque sont les hommes de plus de 50 ans souffrant de reflux gastro-œsophagien chronique, d’obésité, d’abus de nicotine et ayant des antécédents familiaux d’œsophage de Barrett.
Cancer de l’estomac principalement dans les pays asiatiques
L’incidence du cancer de l’estomac varie considérablement à travers le monde. Il est surtout fréquent dans les pays asiatiques, mais plus rare en Europe et en Amérique du Nord [4,5]. C’est pourquoi seuls les pays asiatiques ont mis en place des programmes de dépistage. Le mauvais résultat à 5 ans (30-40%) et le fait que le diagnostic n’est souvent posé qu’à un stade avancé plaident en ce sens. En revanche, la tendance encourageante à la baisse de l’incidence du carcinome gastrique est un argument en sa faveur, selon Burri. Dans les pays où le dépistage est pratiqué, le diagnostic est effectivement plus précoce. Il en résulte que la mortalité diminue plus rapidement que l’incidence. Cependant, l’éradication de H. pylori est un facteur important de la baisse de l’incidence des tumeurs, de sorte qu’un changement de stratégie vers une prévention primaire est envisagé [6].
Dépistage des voies biliaires et du foie
En ce qui concerne les voies biliaires, une maladie se distingue et nécessite un dépistage : la cholangite sclérosante primaire (CSP). Il s’agit d’une inflammation chronique des voies biliaires, souvent asymptomatique, qui peut conduire à une cirrhose par fibrose. 80% des personnes atteintes présentent une maladie inflammatoire chronique de l’intestin en comorbidité. Le diagnostic se fait par imagerie [7]. Le carcinome hépatocellulaire (CHC) est la quatrième cause de mortalité par cancer dans le monde. 90% des CHC se développent dans un foie cirrhotique. Le risque de CHC est de 3 à 5 % par an et le taux de survie à 5 ans est de 10 à 15 % aux États-Unis [8]. L’incidence du CHC est en augmentation, en particulier dans les pays industrialisés. Principalement en raison de l’obésité, du syndrome métabolique et de la NASH. Selon les recommandations de la Swiss Association for the Study of the Liver, un dépistage devrait être effectué chez les patients atteints de cirrhose, d’hépatite B ou de fibrose de haut grade avec des facteurs de risque supplémentaires [9].
Le risque de développer un cancer du pancréas au cours de la vie est de 1,6%. Pour cela, il existe un test presque parfait avec une sensibilité et une spécificité de 99% chacune. Pourtant, le dépistage n’est pas pratiqué dans la population générale, car il y a malgré tout 1000 faux positifs pour 100 000 personnes [10]. Cependant, le taux de survie à 5 ans est très faible (5-10%) et l’incidence est en légère augmentation. Un dépistage pourrait donc s’avérer nécessaire à l’avenir.
Cancer du côlon : fréquent et encore plus fréquent à l’avenir
Pour le cancer du côlon, on s’attend à une augmentation de l’incidence annuelle actuelle de 50/100 000 de 12,7% chez les personnes âgées de 70 ans ou moins et de 81,4% chez les patients de 70 ans ou plus. En effet, les facteurs de risque sont, outre l’âge, l’obésité, la nicotine, l’alcool et l’alimentation, entre autres. En Amérique, des réflexions sont donc en cours pour abaisser l’âge du dépistage à 45 ans. En effet, l’avantage du cancer du côlon est son délai très long avant l’apparition de la tumeur maligne. En Suisse, des programmes de dépistage sont donc déjà en place dans certains cantons. D’autres veulent suivre. Ils consistent en un FIT, un test de sang occulte dans les selles tous les deux ans et une coloscopie tous les dix ans.
Source : “Tumorscreening in der Gastroenterologie”, FomF Update Refresher, 29.1.2022
Littérature :
- Pohl H, Welch HG : The role of overdiagnosis and reclassification in the marked increase of esophageal adenocarcinoma incidence. J Natl Cancer Institute 2005 ; 97 : 142-146.
- Fitzgerald RC, di Pietro M, O’Donovan M, et al. : Cytosponge-trefoil factor 3 versus usual care to identify Barrett’s oesophagus in a primary care setting : a multicentre, pragmatic, randomised controlled trial. Lancet 2020 ; 396 : 333-344.
- Ross-Innes CS, Debiram-Beecham I, O’Donovan M, et al. : Evaluation of a Minimally Invasive Cell Sampling Device Coupled with Assessment of Trefoil Factor 3 Expression for Diagnosing Barrett’s Esophagus : A Multi-Center Case-Control Study. PLoS Med 2015 ; 12(1) : e1001780.
- Tural D, Selçukbiricik F, Akar E, et al : Gastric cancer : A case study in Turkey. J Cancer Res Ther 2013 ; 9(4) : 644.
- Crew KD, Neugut AI. Épidémiologie du cancer gastrique. World J Gastroenterol 2006 ; 12(3) : 354-362.
- Huang RQ, Li X, Le MH, et al : Histoire naturelle et risque de carcinome hépatocellulaire chez les patients atteints d’hépatite B chronique non traités avec une phase indéterminée. Clin Gastrol Hepatol 2021 ; S1542-3565(21)00069-0.
- Rizvi S, Eaton JE, Gores GJ : La cholangite sclérosante primaire en tant que maladie pré-maligne du tractus bilieux : surveillance et prise en charge. Gastroentérologie et hépatologie cliniques 2015 ; 13 : 2152-2165.
- Samant H, Amiri HS, Zibari GB : Addressing the worldwide hepatocellular carcinoma : epidemiology, prevention and management. J Gastrointest Oncol 2021 ; 12(Suppl 2) : S361-S373.
- Goossens N, Toso C, Heim MH : Prise en charge du carcinome hépatocellulaire : avis d’expert du SASL. Swiss Med Wkly 2020 ; 150 : w20296.
- Henrikson NB, Bowles EJA, Blasi PR, et al : Screening for Pancreatic Cancer : Updated Evidence Report and Systematic Review for the US Preventive Services Task Force. JAMA 2019 ; 322(5) : 445-454.
InFo ONKOLOGIE & HÉMATOLOGIE 2022 ; 10(2) : 30-31