Au cours des dernières années, il est devenu évident que le succès du traitement dépendait de manière décisive d’un traitement modificateur précoce de la maladie (DMARD), qui permet de contrôler l’activité de la maladie. Cela implique des soins multidisciplinaires collaboratifs. L’arsenal de substances actives s’est considérablement développé au cours des dernières années. Les produits biologiques et les “petites molécules” permettent des stratégies de traitement ciblées et individualisées. Selon l’EULAR, leur utilisation peut se faire en alternative ou en combinaison avec les DMARD conventionnels.
“Dans le domaine des traitements de l’arthrite, d’énormes progrès ont été réalisés ces dernières années”, explique le Dr Thomas Langenegger, médecin-chef de l’hôpital cantonal de Zoug [1]. Le développement de la pharmacothérapie et l’utilisation précoce d’un traitement adapté au patient ont considérablement amélioré le pronostic de la polyarthrite rhumatoïde au cours des dernières décennies. Les agents modernes de modification de la maladie interviennent de manière ciblée dans les processus inflammatoires. Selon les estimations de la European League Against Rheumatism (EULAR), l’objectif thérapeutique d’une rémission durable ou au moins d’une faible activité de la maladie peut aujourd’hui être atteint chez 70 à 80% des patients atteints de polyarthrite rhumatoïde. Cela a des conséquences positives pour les personnes concernées en termes de qualité de vie et de maintien de l’autonomie [2].
Évaluation diagnostique interdisciplinaire
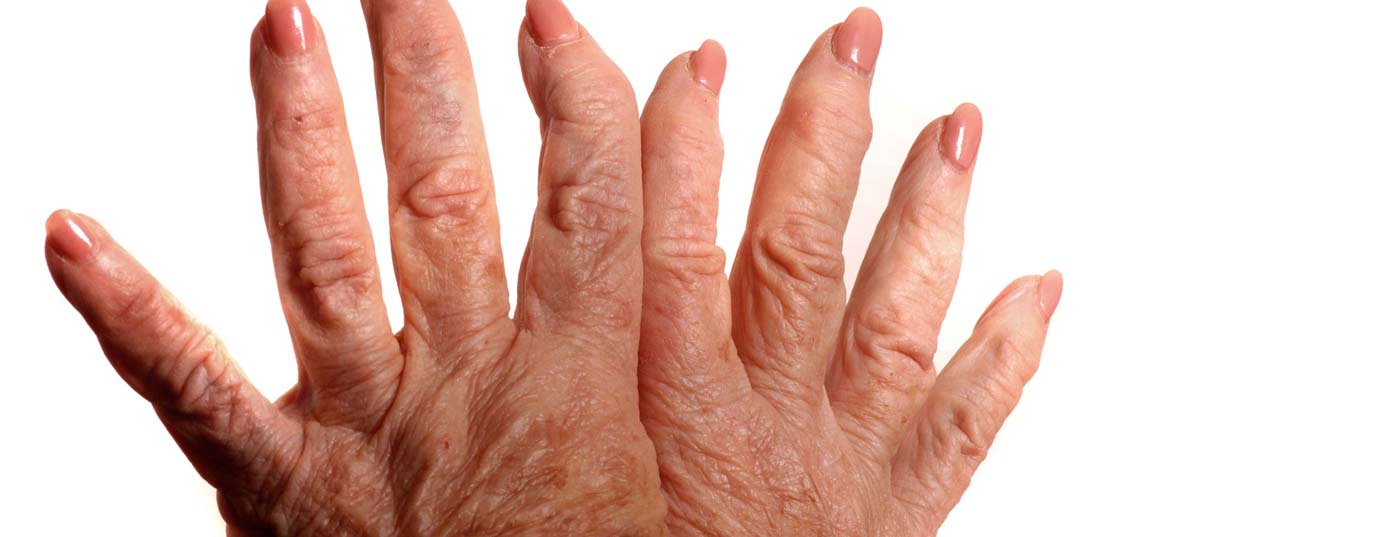
Un changement de mentalité a eu lieu dans le traitement des maladies rhumatismales d’origine immunologique. “Il y a de plus en plus de preuves que plus le traitement est précoce et ciblé et conduit à une rémission, plus il est facile de réduire les médicaments au cours de l’évolution, voire de les arrêter dans certains cas”, explique l’expert. Dans la pathogenèse, les voies immunopathologiques médiées par les cytokines, dont l’activation induit une inflammation des tissus et des articulations, jouent un rôle important. Les symptômes typiques de la polyarthrite rhumatoïde sont la douleur, la raideur articulaire et la limitation des mouvements. Le diagnostic est basé sur l’anamnèse et les critères de classification ACR/EULAR, ainsi que sur d’autres résultats d’inspection, d’examens de laboratoire, d’échographie et de radiographie [3]. Comme les lésions articulaires peuvent évoluer rapidement en cas de polyarthrite rhumatoïde, il est important de poser un diagnostic sûr le plus tôt possible. Outre la rémission, l’objectif du traitement est de prévenir la destruction de l’articulation ou les lésions organiques et d’atténuer les éventuelles comorbidités (encadré). Les médicaments utilisés aujourd’hui pour traiter l’arthrite sont répartis dans les trois classes suivantes : AINS (anti-inflammatoires non stéroïdiens), glucocorticoïdes et médicaments de base. “Il y a de plus en plus de médicaments et de possibilités de traitement pour des indications de plus en plus nombreuses et larges”, a déclaré le Dr Langenegger.

Utiliser les glucocorticoïdes de manière limitée dans le temps
Certes, les stéroïdes occupent toujours une place importante dans le traitement de la polyarthrite rhumatoïde, en particulier dans la phase d’induction du traitement jusqu’à ce que les médicaments de base soient pleinement efficaces. Mais aujourd’hui, les stéroïdes sont administrés aussi longtemps que nécessaire ou aussi brièvement que possible et à la dose la plus faible possible, explique le Dr Langenegger. Dans une perspective à long terme, on essaie généralement de supprimer complètement les stéroïdes. Mais il y a certaines indications ou groupes de patients pour lesquels cela n’est pas possible. Dans ces cas, il est recommandé de maintenir le traitement à la dose la plus faible possible et de penser en particulier à l’effet secondaire pertinent le plus fréquent d’un traitement stéroïdien au long cours : l’ostéoporose. Outre les mesures de la densité osseuse, une prophylaxie par le calcium et la vitamine D peut être envisagée chez ces patients, ainsi qu’un traitement par biphosphonates antirésorptifs si nécessaire.
Les AINS sont également toujours utilisés aujourd’hui, avec l’utilisation d’inhibiteurs de la pompe à protons (IPP) pour la prévention des effets secondaires gastro-intestinaux indésirables dans le cadre d’un traitement continu. Si l’on utilise des inhibiteurs de COX2, il faut tenir compte des éventuels effets secondaires cardiovasculaires, a déclaré l’orateur.
Les recommandations de l’EULAR préconisent une utilisation précoce des DMARD
Le traitement de base fait appel à des médicaments anti-inflammatoires modificateurs de la maladie (“Disease-Modifying-Anti-Rheumatic Drugs”, DMARD), qui ont beaucoup moins d’effets secondaires que les AINS et les corticostéroïdes. Ils modifient l’évolution de la maladie en agissant sur les voies de signalisation inflammatoires du système immunitaire, en ralentissant et, dans le meilleur des cas, en stoppant le processus inflammatoire, ce qui entraîne ensuite la disparition des symptômes [4]. Les médicaments actuellement disponibles sur le marché sont des agents modificateurs de la maladie conventionnels (csDMARDs), des agents biologiques et biosimilaires (bDMARDs) et des agents semi-synthétiques (tsDMARDs). La Ligue européenne contre le rhumatisme (EULAR) a publié en 2020 une mise à jour de ses recommandations de traitement pour la prise en charge de la polyarthrite rhumatoïde (PR) [8,10]. Il y est recommandé de commencer le traitement par DMARD dès que possible après le diagnostic. Comme le montrent des études récentes, un contrôle rapide de l’activité de la maladie a un effet positif sur le pronostic ultérieur [5–7]. Le méthotrexate (MTX) reste le traitement de première intention, complété si nécessaire par l’utilisation à court terme de corticostéroïdes oraux, en particulier lors de l’initiation du traitement ou d’un changement de DMARD conventionnel en raison d’une réponse insuffisante. Le léflunomide ou la sulfasalazine peuvent être utilisés comme alternatives au MTX. Chez les patients qui ne répondent pas suffisamment au traitement DMARD initial, il convient de stratifier les facteurs pronostiques défavorables. Ces facteurs incluent les auto-anticorps, la persistance d’une activité modérée ou élevée de la maladie, des érosions précoces et un nombre élevé d’articulations enflées. En l’absence de facteurs pronostiques défavorables, le changement de csDMARD doit être envisagé. Chez les patients à risque, l’utilisation supplémentaire d’un médicament biologique (bDMARD) ou d’un tsDMARD est recommandée à un stade précoce. L’utilisation combinée avec le MTX doit être préférée à la monothérapie. Si le traitement combiné ne permet pas d’obtenir une réponse suffisante, il convient de passer à un autre bDMARD ou à un autre tsDMARD ayant un mécanisme d’action différent.

De plus en plus de produits biologiques et de représentants des “petites molécules” disponibles
Avec le rituximab, le premier représentant des médicaments biologiques (bDMARDs) pour le traitement des rhumatismes a été autorisé à la vente en 1997. Depuis, de nombreuses autres substances ont été ajoutées (tableau 1). Outre les inhibiteurs du TNF-alpha, des inhibiteurs de l’IL6 et des anticorps dirigés contre les cellules B sont disponibles. Les produits biologiques sont obtenus à partir ou à l’aide d’organismes biologiques (p. ex. cultures cellulaires, bactéries), ont une structure complexe et un processus de fabrication coûteux. C’est pourquoi le coût de ce groupe de médicaments est relativement élevé. Depuis quelques années, des biosimilaires sont également apparus sur le marché. Il s’agit de médicaments d’imitation présentant une grande similarité (“similarity”) en termes de structure, d’activité biologique, de pureté et de sécurité.
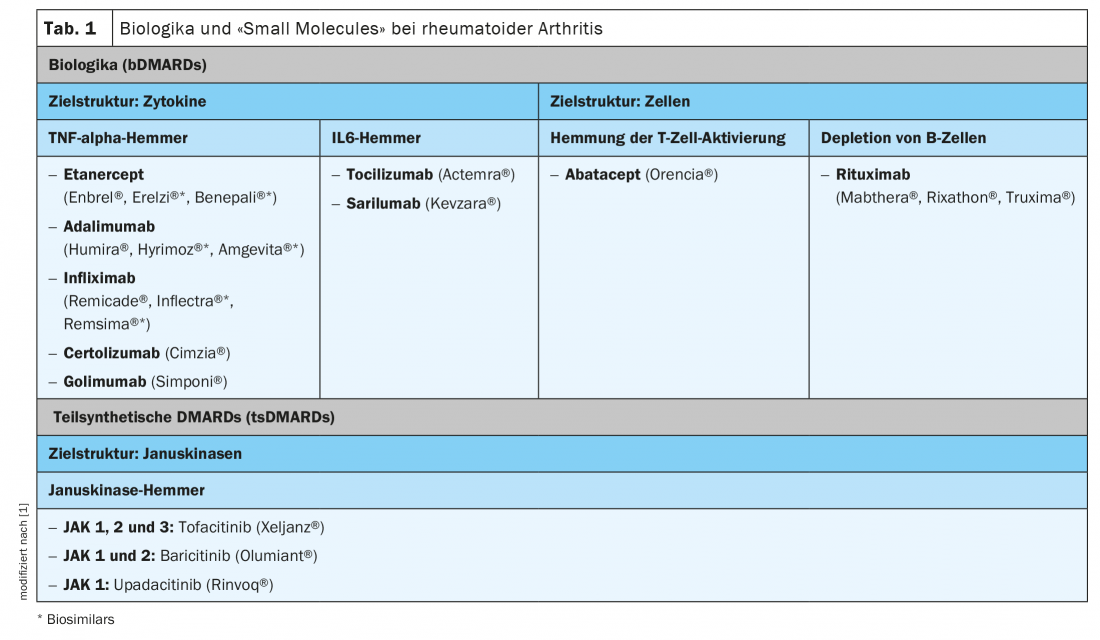
Les agents modificateurs de maladie semi-synthétiques (tsDMARD) sont des substances de faible poids moléculaire (“petites molécules”) qui provoquent une inhibition intracellulaire ciblée de la synthèse ou de l’expression de certaines cytokines. En 2013, le tofacitinib, premier représentant des inhibiteurs de Janus kinase, a été approuvé pour la polyarthrite rhumatoïde, suivi plus tard par le baricitinib et l’upadicitinib (tab. 1). Le filgocitinib et le peficinitib font actuellement l’objet d’études cliniques en vue d’une autorisation de mise sur le marché. Les Janus kinases (JAK) sont des enzymes intracellulaires qui sont activées par la production de cytokines sur des récepteurs de surface cellulaire. Les JAK activées entraînent la production de cytokines pro-inflammatoires via la STAT et le nucléus.
Source : FomF Médecine générale et interne
Littérature :
- Langenegger T : Arthritis Therapie : Dr. med. Thomas Langenegger, Update. FOMF 2.12.2020.
- Polyarthrite rhumatoïde : vivre avec une maladie chronique. Ligue suisse contre le rhumatisme 2020, www.rheumaliga.ch/assets/doc/ZH_Dokumente/Broschueren-Merkblaetter/Krankheitsbilder/RA.pdf
- Aletaha D, et al : 2010 Rheumatoid Arthritis Classification Criteria, Arthritis & Rheumatism, Vol. 62, No. 9, September 2010, pp 2569-2581, consulté le 28.08.2019
- Schneider M, et al. : Lignes directrices pour la prise en charge de la polyarthrite rhumatoïde précoce. Société allemande de rhumatologie 4e édition, 2019.
- Combe B, et al : Annales des maladies rhumatismales 2017 ; 76 : 948-959.
- Emery P : Br J Rheumatol 1995 ; 34(Suppl 2) : 87-90.
- Machold KP, et al : J Rheumatol Suppl 1998 ; 53 : 13-19
- RheumaGuide : le service d’information pour les rhumatologues, www.rheumaguide.de/content/update-zur-behandlung-von-ra-patienten
- FAQ, Coronavirus, www.rheumaliga.ch/blog/2021/coronavirus-haeufig-gestellte-fragen?q=biologika
- Smolen JS, et al : Recommandations de l’EULAR pour la prise en charge de l’arthrite rhumatoïde avec des médicaments antirhumatismaux synthétiques et biologiques modifiant la maladie : mise à jour 2019 Ann Rheum Dis 2020 ; 79 : 685-699.
HAUSARZT PRAXIS 2021 ; 16(2) : 34-35 (publié le 19.2.21, ahead of print)