Le traitement adjuvant systémique améliore la survie et l’absence de récidive dans le cancer du sein précoce. Les analyses génétiques de la tumeur peuvent aider à choisir le traitement. Un suivi de soutien est également utile des années après la fin du traitement adjuvant.
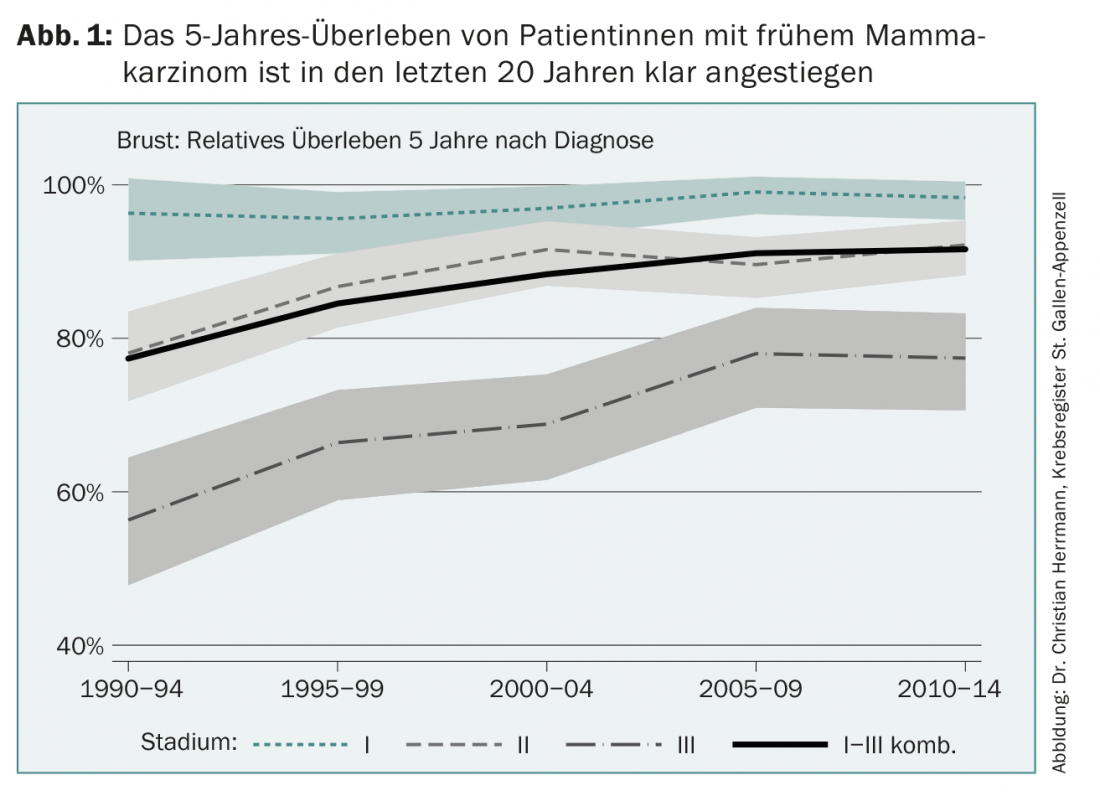
Le traitement adjuvant du cancer du sein précoce a fait de grands progrès depuis ses débuts il y a un peu plus de 40 ans. Aujourd’hui, plus de 80% des femmes atteintes d’un cancer du sein en Europe peuvent être guéries (Fig. 1). Ce progrès est dû à plusieurs facteurs, notamment l’amélioration du dépistage, les programmes de dépistage par mammographie, les nouvelles options de chirurgie et de radiothérapie, mais aussi le développement continu des traitements médicamenteux systémiques supplémentaires, appelés adjuvants. Cette réussite est le résultat d’études internationales randomisées et de leur mise en œuvre dans la pratique clinique quotidienne, un processus qui est loin d’être évident. Dans certains pays d’Asie, par exemple, la survie à long terme après un cancer du sein nouvellement détecté n’est aujourd’hui que d’environ 40%, pour diverses raisons.
Les conférences de Saint-Gall sur le traitement du cancer du sein précoce, organisées régulièrement et désormais à intervalles de deux ans, illustrent bien l’évolution scientifique depuis les années 80. Ces congrès sont toujours accompagnés d’un consensus d’experts en cancer du sein de renommée internationale, qui est suivi dans le monde entier et fait l’objet d’une publication importante.
Dans les réunions interdisciplinaires des tumorboards réguliers, les directives reconnues sont mises en œuvre dans le cadre d’une planification thérapeutique optimisée et individualisée, une procédure institutionnalisée dans les centres du sein qui contribue de manière significative à l’amélioration des résultats thérapeutiques.
Le 15e congrès de Saint-Gall sur le thème du traitement primaire du cancer du sein précoce s’est tenu pour la deuxième fois à Vienne du 15 au 18 mars 2017, sous le thème de la planification individualisée des traitements. Celle-ci doit être aussi peu invasive que possible, mais aussi forte que nécessaire (“de-escalating and escalating treatments for early stage breast cancer”). Les recommandations consensuelles formulées par la suite peuvent être consultées dans les Annals of Oncology [1]. Les années précédentes, l’accent avait été mis sur la personnalisation du traitement en fonction des différentes biologies des tumeurs. Les recommandations générales doivent en outre être adaptées aux valeurs individuelles, aux souhaits et aux possibilités des patientes concernées, ainsi qu’aux possibilités économiques. Dans le consensus, le panel note également que les essais randomisés ne peuvent pas fournir des réponses adéquates dans tous les cas individuels et à toutes les questions cliniques pertinentes.
Avec l’augmentation de la survie à long terme des patientes atteintes d’un cancer du sein (“survivors”), d’autres aspects prennent de l’importance, par exemple les conséquences à long terme des thérapies et les questions sociales telles que la réinsertion professionnelle.
La possibilité et la pertinence d’un traitement systémique supplémentaire dépendent en premier lieu de la biologie du carcinome, mais aussi du staging, et donc de la probabilité d’une rechute ou d’une métastase.
La biologie moléculaire permet de distinguer différents types de carcinomes mammaires, une classification qui, en pratique, peut être effectuée de manière similaire à l’aide de méthodes immunohistochimiques largement répandues, conformément à des recommandations consensuelles antérieures [2]. Ces sous-types sont appelés Luminal A, Luminal B, HER 2 positif et triple négatif et présentent des comportements différents avec des recommandations de traitement correspondantes.
Thérapies à base d’hormones
En cas de détection de récepteurs d’œstrogènes dans les cellules tumorales par immunohistochimie, une hormonothérapie adjuvante est recommandée, souvent comme seul traitement systémique dans le cas des tumeurs luminal A ou en plus d’une chimiothérapie, selon la constellation. Une faible expression des récepteurs d’œstrogènes suffit également pour cette indication.
Chez les femmes ménopausées, l’un des inhibiteurs de l’aromatase, le létrozole, l’anastrozole ou l’exémestane, est préférable au tamoxifène en raison d’une efficacité légèrement supérieure. En cas de problèmes de tolérance ou de comorbidités, le tamoxifène peut être utilisé comme alternative en raison de son profil d’effets secondaires différent, en particulier lorsque le risque de récidive est faible.
Des études cliniques ont montré qu’une hormonothérapie adjuvante de dix ans, qu’il s’agisse de tamoxifène [3], d’un inhibiteur de l’aromatase [4] ou d’une séquence, est légèrement supérieure à la durée de traitement de cinq ans qui était jusqu’à présent la norme. Cette durée de traitement plus longue a une signification clinique, surtout chez les femmes présentant un risque accru de récidive.
Chez les femmes préménopausées, le tamoxifène en monothérapie reste une bonne option thérapeutique reconnue. Un traitement supplémentaire par agoniste de la LHRH ou un inhibiteur de l’aromatase et un agoniste de la LHRH sont légèrement plus efficaces, comme l’ont montré des études randomisées, mais ils sont associés à des effets secondaires considérablement plus importants [5]. Cela se justifie généralement en cas de risque de récidive plus élevé, par exemple chez les femmes de moins de 35 ans, en cas de tumeurs avec un moins bon degré de différenciation et en cas d’atteinte d’au moins quatre ganglions lymphatiques axillaires ; des situations qui ont généralement aussi conduit au choix d’une chimiothérapie adjuvante supplémentaire.
Chimiothérapie pour le cancer du sein avec récepteurs positifs
Une chimiothérapie adjuvante supplémentaire pour les tumeurs à récepteurs positifs est indiquée en cas de risque de récidive plus élevé, ce qui est généralement déjà le cas pour le type Luminal B.
Le risque de récidive peut être déduit de la biologie et dépend en outre du stade de la tumeur, notamment du nombre de ganglions lymphatiques axillaires atteints. Les facteurs importants sont le degré de différenciation et le taux de prolifération, qui peut être mesuré par immunohistochimie à l’aide du marqueur Ki-67. La standardisation et la reproductibilité de ce facteur quantitatif ont constitué un défi pour les pathologistes.
Un autre paramètre pronostique intéressant est le degré d’infiltration de la tumeur par les lymphocytes. Un nombre plus élevé de TIL (lymphocytes infiltrant les tumeurs) indique une réponse immunitaire antitumorale plus prononcée et est associé à un meilleur pronostic. Cependant, ce facteur n’est actuellement pas encore suffisamment standardisé pour être utilisé dans les décisions thérapeutiques de routine.
Il existe également des possibilités basées sur Internet qui permettent d’obtenir une indication sur le pronostic à l’aide d’un algorithme basé sur des données cliniques/pathologiques, ce qui peut être une aide pour conseiller les patientes (www.adjuvantonline.com ou Predict www.predict.nhs.uk). Ce dernier algorithme prend également en compte le degré de prolifération Ki-67 et le statut HER 2.
Des tests génétiques validés et reproductibles sur le matériel tumoral peuvent influencer davantage la décision de recourir ou non à une chimiothérapie adjuvante supplémentaire. Cela vaut surtout pour les cancers du sein à récepteurs positifs avec pas ou peu d’atteinte des ganglions lymphatiques axillaires, lorsque le résultat du test indique un très bon pronostic et permet donc de renoncer à une chimiothérapie supplémentaire. Il existe plusieurs tests concurrents bien établis à la disposition des cliniciens, comme Oncotype®, Endopredict® ou Mammaprint®. L’utilisation de tels tests dans ces situations est explicitement soutenue par le Consensus de Saint-Gall.
Tumeurs HER 2 positives
Une année de traitement par trastuzumab, actuellement disponible sous forme sous-cutanée, en plus d’une chimiothérapie et éventuellement d’un traitement antihormonal, améliore substantiellement la survie sans récidive. La chimiothérapie peut être un traitement à base d’anthracyclines et de taxanes, mais dans le cas de petites tumeurs avec un faible risque de récidive, elle peut être limitée aux taxanes seuls.
En situation préopératoire, l’administration combinée des anticorps anti-HER-2 trastuzumab et pertuzumab permet en outre d’améliorer substantiellement la réponse [6]. Cela a également suggéré une utilisation adjuvante postopératoire. Les données très attendues des études Aphinity ont été présentées au congrès de l’ASCO 2017 et ont certes montré une amélioration statistiquement significative de l’absence de récidive, mais en chiffres absolus dans une petite fourchette de 1% [7]. Ce traitement supplémentaire coûteux n’apportera donc probablement un bénéfice supplémentaire cliniquement pertinent en situation adjuvante que pour un groupe restreint de patients présentant un risque accru de récidive.
Carcinomes triple-négatifs
Ces tumeurs, qui n’expriment pas les récepteurs des œstrogènes et de la progestérone et ne surexpriment pas les récepteurs HER 2, constituent un groupe biologiquement hétérogène. Si un traitement adjuvant est choisi, seule une chimiothérapie est envisageable, généralement une combinaison d’anthracyclines/alkylants et de taxanes.
Les cancers du sein avec des mutations BRCA 1 ou 2 sont plus fréquents, mais ne sont pas toujours des cancers triples négatifs. Chez ces patientes, une chimiothérapie à base de platine peut être choisie. En dehors des études actuellement en cours, l’utilisation des inhibiteurs de la PARP ne se justifie pas (encore ?) dans cette situation.
Traitements néoadjuvants
Il n’y a certes pas d’avantage de survie lorsqu’un traitement systémique nécessaire est administré avant une opération du cancer du sein (donc néoadjuvant). Toutefois, l’opération doit alors porter uniquement sur la zone résiduelle de la tumeur, et non sur son extension initiale. Si l’examen du ganglion sentinelle réalisé après la chimiothérapie ne révèle pas d’atteinte tumorale, le curage axillaire peut être évité. L’avantage d’un traitement néoadjuvant est donc la possibilité d’un traitement chirurgical moins invasif, qui peut même éventuellement être réalisé en conservant le sein malgré une tumeur initialement importante.
Un traitement néoadjuvant donne également du temps pour la planification de l’opération, ce qui peut être important chez les femmes suspectées de mutations BRCA, afin de pouvoir réaliser le conseil génétique et l’analyse génétique, puis de discuter de l’option d’une mastectomie, éventuellement même bilatérale.
Le consensus recommande des traitements néoadjuvants pour les cancers du sein HER 2 positifs et triples négatifs.
Thérapies antirésorptives
En se basant sur les études autrichiennes qui indiquent que le zolédronate ou le dénosumab protègent non seulement contre l’ostéoporose, mais réduisent également le risque de récidive [8,9], le panel de consensus a accepté qu’en cas de statut hormonal post-ménopausique, un traitement supplémentaire par bisphosphonates (pas encore dénosumab) soit indiqué.
Thérapies de soutien
De nombreuses patientes sont très réceptives aux recommandations nutritionnelles. Le fait de pouvoir contribuer soi-même à la guérison dans un domaine généralement très discuté et de garder le contrôle du traitement, du moins dans certains domaines, est motivant. Bien qu’il n’existe pas de véritable régime alimentaire espéré par les patientes ayant un effet sur une tumeur existante, des conseils nutritionnels sont utiles. Tant la chimiothérapie que les traitements (anti)hormonaux peuvent parfois entraîner une prise de poids marquée. Un conseil proactif est donc utile pour cette raison, ainsi qu’une information équilibrée sur le fait qu’un régime sans sucre, sans lactose ou sans gluten est une mesure non prouvée dans le traitement du cancer. Cependant, l’obésité a une efficacité prouvée dans le développement du cancer et les patientes atteintes d’un cancer du sein sans obésité peuvent espérer une réduction de la mortalité [10] et du taux de rechute.
Un autre aspect important est une activité physique suffisante. Il existe de plus en plus de données indiquant que l’activité physique peut réduire le taux de récidive [11]. Une orientation appropriée et des indications sur les offres régionales doivent être fournies.
En 2010, la Suisse comptait déjà près de 300 000 “survivants” de différents types de tumeurs, dont le cancer du sein constitue le groupe le plus important [12]. En raison de l’augmentation continue de ces chiffres, ils seraient aujourd’hui environ 350 000. Il existe des programmes spéciaux, comme celui de la Ligue contre le cancer de Suisse orientale, qui conseillent les femmes dans ces domaines après la fin du traitement de la tumeur. Un autre service important est le soutien psycho-oncologique. Il faut également veiller à prévenir activement l’ostéoporose, en particulier sous inhibiteurs de l’aromatase (évaluation de la densité osseuse, apport suffisant de calcium et de vitamine D, et si nécessaire de Prolia®).
Après un traitement adjuvant intensif, un nombre considérable de patientes souffrent de symptômes souvent durables de fatigue (fatigue), mais aussi d’une diminution de la capacité de concentration, de difficultés à trouver ses mots et d’oublis (“chemo brain”). Ces troubles ne doivent pas être simplement étiquetés comme psychogènes. Il existe des preuves qui indiquent des changements organiques mesurables dans le cerveau et qui ont présenté des processus inflammatoires dans le cerveau comme étant causaux [13].
Perspectives
D’autres nouveaux médicaments feront leur entrée dans le traitement adjuvant, notamment peut-être les inhibiteurs des kinases 4 et 6 cycline-dépendantes (palbociclib) et les inhibiteurs de PARP chez les patientes présentant des mutations BRCA. Le traitement par nératinib des patientes atteintes d’un cancer HER 2 positif après trastuzumab a permis de réduire le taux de récidive [14]. Les nouvelles immunothérapies constituent un espoir potentiel pour les cancers du sein triple négatifs.
Dans les traitements néoadjuvants modernes du cancer du sein HER 2 positif, une réponse complète sans tumeur résiduelle peut être observée lors de l’opération dans plus de la moitié des situations. La question de savoir s’il est possible de renoncer totalement à la chirurgie dans de telles situations fera l’objet d’études cliniques. Dans ce cas, le traitement médicamenteux ne serait plus un traitement adjuvant, mais le traitement principal du cancer du sein précoce.
Messages Take-Home
- Le traitement adjuvant systématique améliore de manière significative la survie et l’absence de récidive dans le cancer du sein précoce.
- Une équipe de traitement interdisciplinaire avec des tumor boards réguliers est un facteur important pour une recommandation thérapeutique optimale.
- Les analyses génétiques de la tumeur peuvent aider à choisir un traitement adjuvant ou conduire à l’élimination des chimiothérapies.
- Un accompagnement de soutien, même des années après la fin du traitement adjuvant, représente une partie importante du traitement (“survivorship programme”).
Littérature :
- Curigliano G, et al : De-escalating and Escalating Treatments for Early Stage Breast Cancer : The St. Gallen International Expert Consensus Conference on the Primary Therapy of Early Breast Cancer 2017. Annals of Oncology 2017 ; 28(8) : 1700-1712.
- Goldhirsch A, et al : Strategies for sub-types – dealing with the diversity of breast cancer : highlights of the St Gallen International Expert Consensus on the Primary Therapy of Early Breast Cancer 2011. Ann Oncol 2011 ; 22(8) : 1736-1747.
- Davies C, et al : Effets à long terme de la poursuite du tamoxifène en adjuvant pendant 10 ans versus son arrêt à 5 ans après le diagnostic d’un cancer du sein avec récepteurs d’œstrogènes positifs : ATLAS, un essai randomisé. Lancet 2013 ; 381(9869) : 805-816.
- Goss PE, et al : Extending Aromatase-Inhibitor Adjuvant Therapy to 10 Years. N Engl J Med 2016 ; 375(3) : 209-219.
- Pagani O, et al : Adjuvant exemestane with ovarian suppression in premenopausal breast cancer. N Engl J Med 2014 ; 371 : 107-118.
- Gianni L, et al : 5-year analysis of neoadjuvant pertuzumab and trastuzumab in patients with locally advanced, inflammatory, or early-stage HER2-positive breast cancer (NeoSphere) : a multicentre, open-label, phase 2 randomised trial. Lancet Oncol 2016 ; 17(6) : 791-800.
- von Minckwitz G, et al : Adjuvant pertuzumab and trastuzumab in Early HER2-Positive Breast Cancer. N Engl J Med 2017 ; 377 : 122-131.
- Gnant M, et al : Zoledronic acid combined with adjuvant endocrine therapy of tamoxifen versus anastrozol plus ovarian function suppression in premenopausal early breast cancer : final analysis of the Austrian Breast and Colorectal Cancer Study Group Trial 12. Ann Oncol 2015 ; 26 : 313-320.
- Gnant M, et al : Adjuvant denosumab in breast cancer (ABCSG-18) : a multicentre, randomised, double-blind, placebo-controlled trial. Lancet 2015 ; 386 : 433-443.
- Chan DS, et al : Body mass index and survival in women with breast cancer – systematic literature review and meta-analysis of 82 follow-up studies. Annals Oncology 2014 ; 25(10) : 1901-1914.
- Dieli-Conwright CM : Réduction du risque de récidive du cancer du sein : une évaluation des effets et des mécanismes de l’alimentation et de l’exercice. Curr Breast Cancer Rep 2016 ; 8(3) : 139-150.
- Herrmann C : Cancer survivors in Switzerland : a rapidly growing population to care for. BMC Cancer 2013 ; 13 : 287.
- Morant R : Déficit cognitif associé à la chimiothérapie. Info @ oncologie 2016 ; 6 : 14-17.
- Chan A, et al : Neratinib après traitement adjuvant à base de trastuzumab chez les patientes atteintes d’un cancer du sein HER2-positif (ExteNET) : un essai de phase 3, multicentrique, randomisé, en double aveugle, contrôlé par pl acébo. Lancet Oncology 2016 ; 17 : 367-377.
InFo ONKOLOGIE & HÉMATOLOGIE 2017 ; 5(4) : 10-13