Il y a 400 millions de personnes atteintes de BPCO dans le monde. Il s’agit de la quatrième cause de mortalité mondiale. Lors de la remise à niveau 2017 de la médecine interne à Zurich, les dernières connaissances en matière de diagnostic et de traitement fondés sur des preuves ont été présentées.
Il y a 400 millions de personnes atteintes de BPCO dans le monde. Il s’agit de la quatrième cause de mortalité mondiale [1]. En Suisse, on compte 300 000 personnes atteintes, avec une prévalence de 2,5% chez les 30-39 ans et de 8% chez les >70 ans. Les facteurs de risque comprennent, outre le tabac, l’exposition aux particules de poussière (par exemple dans l’agriculture) et l’exposition aux particules de fumée du chauffage au bois. Pour un traitement aussi spécifique que possible, adapté aux besoins individuels, les lignes directrices diagnostiques et thérapeutiques ont été adaptées à l’état actuel de la recherche. L’importance des bronchodilatateurs (LAMA = anticholinergiques à longue durée d’action/LABA = β-2-agonistes à longue durée d’action) a fortement augmenté au cours des dernières années, alors que les stéroïdes inhalés (CSI) sont moins souvent utilisés qu’auparavant, a rapporté le professeur Robert Thurnheer, médecin-chef du service de diagnostic médical de l’hôpital cantonal de Münsterlingen.
Phénotypage selon la “Global Initiative for Chronic Obstructive Lung Disease” (GOLD)
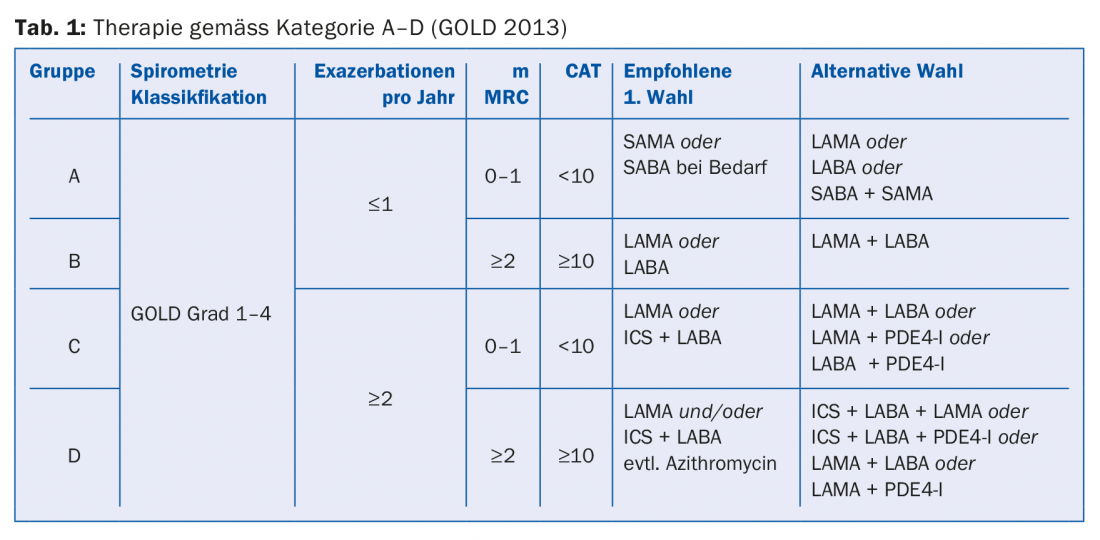
La classification A-D actuellement en vigueur (tab. 1) n’est plus basée sur la fonction pulmonaire, mais sur les symptômes et le risque d’exacerbation, et sert de base à un traitement fondé sur des preuves. Les outils de diagnostic utilisés sont les questionnaires “CAT” (test d’évaluation de la BPCO) et “mMRC” (dépistage de la dyspnée). Pour les patients du groupe A (peu de symptômes, pas d’exacerbations), un bronchodilatateur (LABA ou LAMA) peut être utilisé. Chez les patients du groupe B (symptômes mais pas d’exacerbation), un bronchodilatateur doit également être utilisé. Si les symptômes persistent, il faut passer à une préparation combinée (Anoro® ou Spiolto® ou Ultibro®). Si les exacerbations sont plus fréquentes, il est recommandé d’associer un stéroïde inhalé (CSI) conformément aux lignes directrices GOLD. Pour les patients du groupe C (exacerbations), le premier choix est une monothérapie par LAMA. Si les exacerbations persistent, il convient de passer à un traitement combiné : LABA et LAMA ou LABA et CSI. Le traitement du groupe D peut également se faire selon un schéma progressif (tab. 1), le professeur Thurnheer recommandant la prudence en ce qui concerne l’utilisation prophylactique des macrolides en raison des risques d’effets secondaires (p. ex. surdité de l’oreille interne, syndromes du QT long, résistances, manque de données à long terme).
Bronchodilatation : quels sont les avantages thérapeutiques et comment obtenir les meilleurs effets ?
En résumé, les arguments suivants plaident en faveur de l’efficacité de la bronchodilatation (LAMA, LABA) : amélioration de la fonction pulmonaire [2], diminution de l’hyperinflation [3], amélioration des symptômes [4], diminution du taux d’exacerbation [4]. Pour les groupes A et B, il importe peu que les LABA ou les LAMA soient utilisés en premier. Pour les groupes C et D, il est recommandé d’utiliser LAMA en premier. Dans l’étude POET, LAMA (Spiriva®) s’est montré supérieur au salmétérol (Serevent®) en termes de prévention des exacerbations [5].
Selon de nouvelles connaissances, un début de traitement aussi précoce que possible (c.-à-d. au stade 2 de la fonction pulmonaire = VEMS 50-80% théorique) a des effets positifs ; par exemple, des études ont montré que l’utilisation de tiotropium (Spiriva®), la diminution du VEMS (volume expiratoire forcé à la première seconde d’expiration) après deux ans est moins prononcée que dans la condition placebo [6] et les patients sont moins touchés par l'”hyperinflation” (hyperinflation dynamique) à l’effort, même à un stade précoce.
Plusieurs études cliniques [7,8] ont montré que les combinaisons de LAMA et de LABA (Anoro®, Spiolto®, Ultibro®) sont supérieures aux monothérapies (LAMA ou LABA) en ce qui concerne les cibles suivantes : amélioration de la fonction pulmonaire, réduction des symptômes, diminution du taux d’exacerbation. L’étude SPARK, par exemple, a montré que l’Ultibro® avait de meilleurs effets que les substances individuelles respectives [7]. L’utilisation d’un traitement combiné est surtout recommandée pour les patients atteints de BPCO qui ne répondent pas suffisamment à une monothérapie à faible dose par LAMA ou LABA [9] et pour les patients atteints de BPCO sévère et présentant des symptômes de dyspnée [10,11].
Selon le Compendium, il faut toujours commencer par une monothérapie et n’utiliser une préparation combinée qu’en cas d’absence d’effets, mais selon les directives, un traitement primaire avec une préparation combinée est également autorisé. La décision d’utiliser l’une des trois préparations combinées (Anoro®, Ultibro®, Spiolto®) peut être prise en fonction de l’efficacité mais aussi de la manipulation.
Corticostéroïdes inhalés (CSI) : controverse sur les bénéfices thérapeutiques
Contrairement à l’asthme, où les stéroïdes inhalés (CSI) constituent le traitement de base, l’utilisation des CSI dans la BPCO fait l’objet de controverses.
Dans l’étude FLAME [12], les bronchodilatateurs combinés (LABA+LAMA) ont permis d’obtenir une réduction significativement plus importante des exacerbations par rapport aux LABA+ICS. Dans l’étude WISDOM [8], la suppression des CSI n’a pas entraîné d’augmentation de la fréquence des exacerbations, bien que les valeurs du VEMS se soient détériorées à long terme chez les patients sans CSI [8]. Dans un sous-groupe de patients atteints de BPCO présentant une éosinophilie (>2% d’éosinophilie sanguine) et un risque accru d’exacerbation, les CSI ont entraîné une réduction du taux d’exacerbation [13,14]. Chez les patients atteints de BPCO et présentant un risque cardiovasculaire élevé, l’étude SUMMIT (n=16 485, 43 pays) a montré que l’utilisation de CSI n’entraînait pas de réduction du taux de mortalité, mais une légère diminution du “taux de déclin” de la fonction pulmonaire [15].
Les effets de l’utilisation combinée de bronchodilatateurs et de CSI (“triple thérapie”) peuvent être résumés comme suit en l’état actuel de la recherche [16]: pas d’influence sur la mortalité et les critères cardiovasculaires, peu d’influence sur la fonction pulmonaire, une certaine réduction des exacerbations [17,18], mais nettement plus de pneumonies (effet secondaire des CSI).
Traitement de la BPCO avancée : “Treatable traits” et mesures comportementales
La préparation Prolastin® peut être utilisée comme substitut en cas de déficit en α-1-antitrypsine (inhibiteur de protéase), bien que des effets positifs n’aient été démontrés jusqu’à présent que pour des critères de structure pulmonaire. Daxas® (principe actif : roflumilast) entraîne une légère amélioration de la fonction pulmonaire et une diminution légèrement significative du taux d’exacerbation, mais des effets secondaires peuvent également survenir : Perte de poids, risque accru de troubles du sommeil, troubles de l’humeur [19]. Le mépolizumab (p. ex. Nucala®) est déjà utilisé avec succès chez les asthmatiques atteints d’éosinophilie et peut également avoir des effets positifs en termes de réduction du taux d’exacerbation en cas de BPCO et d’éosinophilie, bien que le produit ne soit actuellement pas encore autorisé pour cette indication chez les patients BPCO [20].
En ce qui concerne l’oxygénothérapie en cas d’hypoxémie sévère, le professeur Thurnheer a mentionné qu’un avantage en termes de survie n’est significatif qu’après environ quatre ans de traitement et qu’en cas d’hypoxémie légère seulement, aucun effet n’a été observé en termes de qualité de vie subjective, de risque d’hospitalisation et d’exacerbation [21].
En ce qui concerne les mesures comportementales, outre l’aide au sevrage tabagique, la physiothérapie et les conseils nutritionnels (souvent la malnutrition calorique due à l’emphysème et à l’hypertrophie musculaire) ont fait leurs preuves. En cas d’exacerbation, il est recommandé de mettre en place un plan d’action. Par exemple, en voyage, il convient de prendre des stéroïdes systémiques (cinq doses quotidiennes de 40 mg) [22] et d’avoir des antibiotiques en réserve en cas de symptômes bronchiques (par ex. co-amoxicilline, tétracycline, etc.). Les autres mesures mentionnées sont le contrôle de la technique d’inhalation, la vaccination annuelle contre la grippe et la vaccination unique contre le pneumocoque (Prevenar-13® chez les enfants).
Source : Médecine interne Update Refresher, 5-9 décembre 2017, Zurich
Littérature :
- Bridevaux P-O, et al : Prevalence of airflow obstruction in smokers and never-smokers in Switzerland. European Respiratory Journal 2010 ; 36 : 1259-1269.
- Tashkin DP, et al : Réponse aux bronchodilatateurs chez les patients atteints de BPCO. European Respiratory Journal 2008 ; 31 : 742-750.
- Dellaca RL, et al : Effet de la bronchodilatation sur la limitation du débit expiratoire et la mécanique pulmonaire au repos dans la BPCO. European Respiratory Journal 2009 ; 33 : 1329-1337.
- Jones PW, et al : Correlating changes in lung function with patient outcomes in chronic obstructive pulmonary disease : a pooled analysis. Respir Res 2011 ; 12 : 161.
- Vogelmeier C, et al : Tiotropium versus salmeterol pour la prévention des exacerbations de la BPCO (POET). N Engl J Med 2011 ; 364 : 1093-1103.
- Zhou Y, et al : Tiotropium in Early-Stage Chronic Obstructive Pulmonary Disease. N Engl J Med 2017 ; 377 : 923-935.
- Wedzicha JA, et al : Analyse des exacerbations de la bronchopneumopathie chronique obstructive avec le bronchodilatateur double QVA149 comparé au glycopyrronium et au tiotropium (SPARK) : étude randomisée, en double aveugle, en groupes parallèles. Lancet Respir Med 2013 ; 1 : 199-209.
- Magnussen H, et al : Withdrawal of inhaled glucocorticoids and Exacerbations of COPD. N Eng J Med 2014 ; 371 : 1285-1294.
- Donohue JF, et al : Efficacité et sécurité de l’umeclidinium/vilanterol 62.5/25 mcg en une fois dans la BPCO. Respir Med 2013 ; 107(10) : 1538-1546.
- Kessler R, et al : Symptom variability in patients with severe COPD ; a pan European cross-sectional study. Eur Respir J 2011 ; 37 : 264-272.
- Price D, et al : Impact des symptômes nocturnes dans la BPCO, une étude en vie réelle dans cinq pays européens. Int J Chron Obstruct Pulmon Dis 2013 ; 8 : 595-603.
- Wedzicha JA, et al : Indacaterol-Glycopyrronium versus Salmeterol-Fluticasone pour la BPCO. N Engl J Med 2016 ; 374(23) : 2222-2234.
- Vedel-Krogh S, et al. : Eosinophiles sanguins et exacerbations dans la maladie pulmonaire obstructive chronique. L’étude de la population générale de Copenhague. AJRCCM 2016 ; 93(9) : 965-974.
- Pascoe S, et al. : Blood eosinophil count, exacerbations, and response to the addition of inhalated fluticasone furoate to vilanterol in patients with chronic obstructive pulmonary disease : a secondary analysis of data from two parallel randomised controlled trials. Lancet Respir Med 2015 ; 3 : 435-442.
- Vestbo J, et al : Fluticasone furoate and vilanterol and survival in chronic obstructive pulmonary disease with heighted cardiovascular risk (SUMMIT) : a double-blind randomised controlled trial. Lancet 2016 ; 387 : 1817-1826.
- Vogelmeier CF, et al : Stratégie mondiale pour le diagnostic, la prise en charge et la prévention des maladies pulmonaires chroniques et obstructives 2017 Rapport : GOLD Executive Summary. Eur Respir J 2017 ; 49 : 1700214.
- Vestbo J, et al : Single inhaler extrafine triple therapy versus long-acting muscarinic antagonist therapy for chronic obstructive pulmonary disease (TRINITY). Lancet 2017 ; 389 : 1919-1929.
- Singh D, et al : Single inhaler triple therapy versus inhaled corticosteroid plus long-acting β2-agonist therapy for chronic obstructive pulmonary disease (TRILOGY) : a double-blind, parallel group, randomised controlled trial. Lancet 2016 ; 388 : 936-973.
- Chong J, Leung B, Poole P, Black PN : Inhibiteurs de la phosphodiestérase 4 pour la maladie pulmonaire obstructive chronique. Cochrane Database Syst Rev 2011 ; (5) : CD002309.
- Pavord ID, et al : Mepolizumab for Eosinophilic Chronic Obstructive Pulmonary Disease. N Engl J Med 2017 ; 377 : 1613-1629.
- LTOT Trial Research Group : A Randomized Trial of Long-Term Oxygen for COPD with Moderate Desaturation. N Engl J Med 2016 ; 375(17) : 1617-1627.
- Leuppi JD, et al : Short-term vs conventional glucocorticoid therapy in acute exacerbations of chronic obstructive pulmonary disease : the REDUCE randomized clinical trial. JAMA 2013 ; 309(21):2223-2231.
PRATIQUE DU MÉDECIN DE FAMILLE 2018 ; 13(1) : 41-43











