Le cancer bronchique est la première cause de mortalité liée au cancer dans le monde. Avec le développement des inhibiteurs de points de contrôle immunitaires, le paysage thérapeutique a considérablement changé.
Le diagnostic et le traitement du cancer bronchique est un domaine qui évolue rapidement et qui présente un intérêt clinique considérable en raison de l’incidence et de la mortalité élevées de ces tumeurs dans le monde. L’évolution rapide des connaissances en biologie moléculaire et en immunologie, ainsi que les progrès réalisés dans le domaine du diagnostic moléculaire, sont des facteurs moteurs du développement d’un traitement personnalisé des tumeurs (“precision medicine”). Cette évolution est loin d’être terminée.
Dans cet article, nous nous concentrons sur les innovations actuelles dans le traitement du cancer bronchique, en mettant l’accent sur le traitement systémique des stades avancés de la tumeur en première ligne de traitement. Il s’agit d’approches thérapeutiques telles que nous les pratiquons actuellement dans notre institution. Nous ne prétendons pas à l’exhaustivité ou à la validité absolue.
Principes de base
En 2018, le cancer bronchique présentait – à égalité avec les tumeurs du sein – la plus forte incidence (11,6%) et la plus forte mortalité (18,4%) de toutes les maladies tumorales dans le monde [1]. Entre 2011 et 2015, le cancer bronchique était la troisième cause de mortalité par cancer en Suisse en termes d’incidence (environ 4300 nouveaux cas par an) et la première cause de mortalité par cancer [2]. Le taux de survie relative à 5 ans pour le cancer du poumon en Suisse était de 15% pour les hommes et de 19% pour les femmes [3]. Le tabac reste la principale cause du cancer du poumon [4]. Environ 20% des cancers bronchiques surviennent chez les “non-fumeurs” (<100 cigarettes au total). L’exposition à des substances toxiques inhalées (par exemple le radon, l’amiante, les vapeurs de goudron) en est la cause principale [5].
Cancer du poumon à petites cellules
Dans 10 à 15% des cancers bronchiques nouvellement diagnostiqués, il s’agit de cancers bronchiques à petites cellules (SCLC, Small Cell Lung Cancer). La distinction entre le stade limité de la maladie (LD, stade I-III) et le stade avancé de la maladie (ED, stade IV) est importante sur le plan thérapeutique. Ce dernier cas est beaucoup plus fréquent en raison de la biologie agressive de la tumeur. La médiane de survie globale (Overall-Survival, OS) est de 15 à 20 mois pour le LD-SCLC et de 8 à 13 mois pour le ED-SCLC [6]. La plupart des CPC présentent des mutations inactivantes des gènes suppresseurs de tumeur TP53 et RB1, tandis que les mutations “traitables” des récepteurs tyrosine kinases sont généralement absentes (à la différence des cancers du poumon non à petites cellules, NSCLC). Les normes thérapeutiques actuelles, qui dépendent du stade, peuvent être résumées comme suit :
Stade I : en plus de la chirurgie, une chimiothérapie adjuvante à base de platine apporte un avantage en termes d’OS (66,0 versus 42,1 mois) au stade I [7].
Stade II, III : la chirurgie plus la chimiothérapie est une option au stade II ; alternativement, la chirurgie peut être abandonnée et une radiochimiothérapie définitive peut être effectuée. Il s’agit du traitement de choix, même au stade III, et il devrait, si possible, être effectué simultanément [8,9].
Stade IV : un traitement systémique palliatif est le traitement de choix pour l’ED-SCLC. Malgré une très bonne réponse thérapeutique initiale, la survie globale médiane n’est que de 10 mois. Les protocoles standard sont le cisplatine et l’étoposide ou le carboplatine et l’étoposide [10]. Les protocoles diffèrent surtout en termes d’effets secondaires, moins en termes d’effets sur les tumeurs [11]. La radiothérapie des tumeurs résiduelles thoraciques n’est pas un standard, mais une option individuelle en cas de très bonne réponse thérapeutique à la chimiothérapie et de rémission complète des métastases extrathoraciques [12].
L’atezolizumab, un inhibiteur du ligand 1 de mort programmée (PD-L1) (inhibiteur de point de contrôle immunitaire, ICI), utilisé en association avec la chimiothérapie et ensuite en traitement d’entretien, apporte un avantage de survie en première ligne par rapport à la chimiothérapie seule (12,3 vs. 10,3 mois, HR 0,7, 95% CI 0,54-0,91), comme démontré dans l’étude de phase III IMpower133. [13]. L’étude de phase III CASPIAN sur le durvalumab et la chimiothérapie a également donné des résultats positifs, comme l’a récemment annoncé le fabricant [14]. Il existe donc désormais deux nouvelles approches pour l’ED-SCLC en matière de chimio-immunothérapie combinée, à condition que les préparations soient encore approuvées par les autorités pharmaceutiques pour cette indication.
L’irradiation prophylactique du cerveau entier (PCI) est considérée comme “standard” dans de nombreuses directives pour les stades II-IV après une bonne réponse à la chimiothérapie [15,16]. Une étude japonaise a toutefois remis en question ce standard, car elle n’a montré aucun avantage de survie pour la PCI par rapport aux contrôles par résonance magnétique du crâne seul [17]. Ces données semblent déjà conduire à un abandon partiel du standard actuel dans la pratique clinique quotidienne [18]. L’influence de l’immunothérapie sur l’indication de l’ICP n’est pas encore claire.
De nombreux patients atteints de SCLC présentent une récidive ou une progression dans les 6 à 12 mois. La raison en est probablement la présence de “cellules souches cancéreuses” résistantes au cisplatine [19]. La suite du traitement dépend de l’état du patient, de l’ampleur de la récidive tumorale, du traitement antérieur et de l’intervalle sans traitement [15–17]. En présence d’une situation réfractaire ou d’une récidive résistante au platine, le topotécan est supérieur au traitement de soutien seul [20] et équivalent à une polychimiothérapie (cyclophosphamide, doxorubicine et vincristine) en termes de taux de réponse global (Overall-Response-Rate, ORR), de survie sans progression (Progression-Free-Survival, PFS) et de SG, mais avec une meilleure tolérance [21]. Le topotécan administré par voie intraveineuse et perorale est à peu près équivalent en termes d’efficacité et de tolérance [22]. Les patients en bon état général (ECOG 0-2) présentant une “récidive sensible aux platines” peuvent être traités à nouveau par cisplatine/carboplatine et étoposide [23].
L’utilisation d’inhibiteurs de points de contrôle immunitaires après l’échec de la chimiothérapie n’est pas (encore) un standard aujourd’hui, selon nous. Les meilleures données disponibles à ce jour concernent le pembrolizumab (pour les tumeurs PDL1-positives) [24] et le nivolumab [25].
Cancer du poumon non à petites cellules
Le cancer du poumon non à petites cellules (NSCLC, environ 85-90% de tous les cancers bronchiques) est un terme clinique générique pour les adénocarcinomes (50-60%), les carcinomes épidermoïdes (20-25%), les carcinomes à grandes cellules, les carcinomes adénosquameux, les carcinomes neuroendocrines (à l’exception du carcinome pulmonaire à petites cellules) et les carcinomes sarcomatoïdes.
Stade I/II : le traitement de choix aux stades I et II est la chirurgie radicale selon les normes oncologiques (en général une lobectomie avec dissection systématique des ganglions lymphatiques médiastinaux). A partir d’un diamètre de la tumeur de 4 cm, une chimiothérapie adjuvante comprenant 4 cycles d’une combinaison contenant du platine est indiquée. En cas de contre-indication à la chirurgie, la radiothérapie stéréotaxique constitue une alternative.
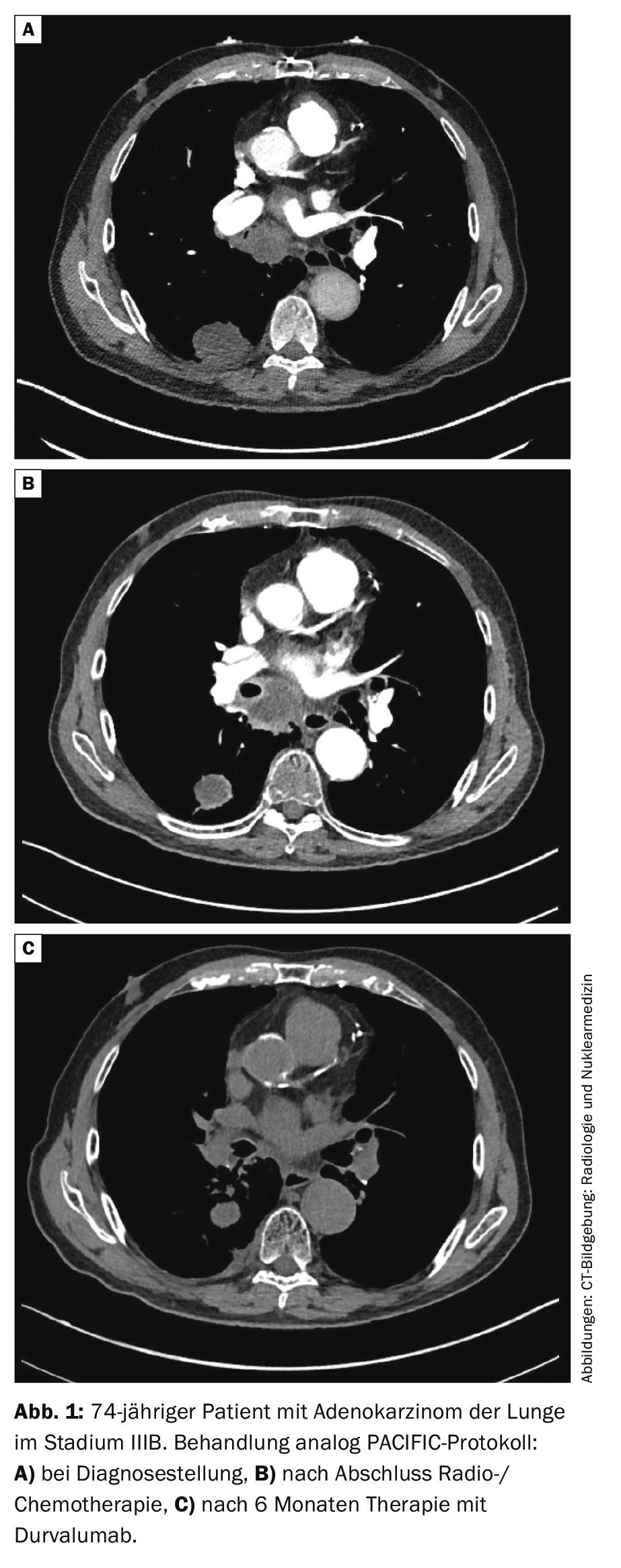
Stade III : pour les tumeurs résécables de stade III, une chimiothérapie est indiquée en plus de la chirurgie. Elle peut être effectuée avant (néoadjuvant) ou après (adjuvant) l’opération. L’utilité d’une radiothérapie supplémentaire (“traitement trimodal”) est controversée. L’étude suisse de phase III SAKK16/00 s’est révélée négative en ce qui concerne l’irradiation préopératoire [26]. La radiothérapie postopératoire (PORT) n’a pas montré de bénéfice clair dans une méta-analyse rétrospective [27], les données de l’étude randomisée LungART sont encore attendues. Les NSCLC de stade III non résécables sont traités par radiochimiothérapie, puis suivis d’une immunothérapie d’un an avec l’anticorps PD-L1 Durvalumab en “consolidation”. La base est l’étude prospective randomisée de phase III PACIFIC [28, 29]. Dans l’étude, le taux de survie à 2 ans était de 66,3% avec le durvalumab, contre 55,6% avec le placebo (HR 0,68, 99,73% IC 0,47-0,997, p=0,0025). La PFS médiane a été significativement prolongée avec durvalumab par rapport au placebo (17,2 contre 5,6 mois, HR 0,51, IC 95% 0,41-0,63, p<0,001). La consolidation par durvalumab est donc aujourd’hui considérée comme la norme (Fig. 1).
Stade IV : En dehors des stades dits “oligométastatiques”, où la chirurgie et la radiothérapie peuvent être utilisées en intention curative, la plupart des CBNPC de stade IV sont traités en intention palliative par des médicaments uniquement. On distingue la chimiothérapie, la thérapie ciblée et l’immunothérapie. Le choix du traitement dépend du sous-type histologique, de la présence ou non de mutations pilotes (pour les tumeurs non squameuses) et de l’expression de PD-L1 dans la tumeur. Le traitement de la pathologie moléculaire est la base d’un traitement optimal (fig. 2).
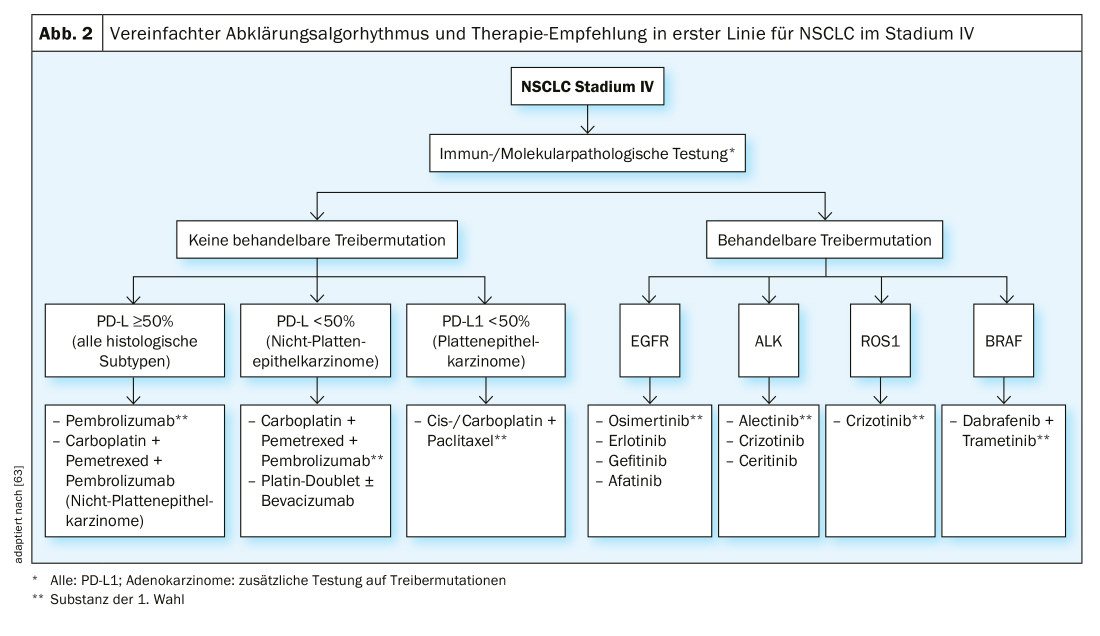
En l’absence de “mutations pilotes” traitables, le traitement est principalement basé sur le statut d’expression de PD-L1. Pour les NSCLC (quel que soit le sous-type histologique) avec une expression de PD-L1 ≥50%, le traitement par pembrolizumab, un inhibiteur de PD-L1, est supérieur à la chimiothérapie conventionnelle en termes d’OS et de PFS selon l’étude KEYNOTE 024 [30]. Pour les adénocarcinomes pulmonaires avec une expression de PD-L1 ≤ 50%, une combinaison de chimiothérapie et de pembrolizumab est préférable à une chimiothérapie seule, comme dans l’étude KEYNOTE 189 [31]. Dans l’étude, le taux de réponse au traitement était de 48% avec l’ajout de pembrolizumab et de 19% sans pembrolizumab. Le taux de survie à 12 mois était de 69% pour pembrolizumab + chimiothérapie et de 49% pour le groupe chimiothérapie seule. Une alternative est l’anticorps PD-L1 atezolizumab en combinaison avec le carboplatine, le paclitaxel et le bevacizumab, sur la base des résultats des études IMpower130 et -150 [32,33].
Pour les carcinomes épidermoïdes avec une expression de PD-L1 ≤50%, selon l’étude KEYNOTE 407, une combinaison de pembrolizumab et de chimiothérapie est associée à un avantage en termes d’OS et de PFS [34].
Si aucun inhibiteur de point de contrôle immunitaire n’a été utilisé en première ligne de traitement, leur utilisation est indiquée en deuxième ligne. L’utilisation du nivolumab est associée à un avantage statistiquement significatif en termes d’ORR, d’OS et de PFS, indépendamment de l’expression de PD-L1 sur les cellules tumorales, par rapport au docétaxel [35].
Le traitement de deuxième ligne par l’atezolizumab a été comparé au docetaxel ; indépendamment de l’histologie du CBNPC, un avantage en termes d’OS a été constaté en faveur de l’atezolizumab [36,37]. Le pembrolizumab a été étudié pour les tumeurs dont l’expression de PD-L1 est d’au moins 1%, et a montré un avantage significatif sur le docetaxel en termes d’OS [38]. Le traitement par les inhibiteurs de points de contrôle immunitaires doit être poursuivi tant qu’une réponse est démontrée ou tant que le patient tolère le traitement sans développer d’effets secondaires graves.
Mutations du pilote : Dans un nombre important de CBNPC, on trouve une mutation d’un protooncogène vers un oncogène, qui code pour une tyrosine kinase de récepteur activateur (RTK). Cette mutation provoque une augmentation de la prolifération cellulaire, de la résistance à l’apoptose, de l’angiogenèse et de la métastase. De telles mutations sont appelées mutations pilotes. Il s’agit généralement de mutations somatiques et non de mutations germinales [39]. Ces découvertes ont conduit au développement d’inhibiteurs de tyrosine kinase (ITK) oraux, dont l’action repose sur une inhibition plus ou moins sélective de la voie de transduction du signal correspondante. Compte tenu de la probabilité de pré-test, le dépistage de la présence de mutations est actuellement obligatoire pour les CBNPC non squameux de stade IV, mais pas pour les carcinomes épidermoïdes et les CBNPC. Pour des raisons de temps, nous testons en deux étapes dans notre institution. La première étape comprend des tests rapides pour EGFR, ALK, ROS1, KRAS et BRAF. Si le résultat est négatif, nous testons dans un deuxième temps HER2, MET, RET, NTRK1-3 et d’autres marqueurs. Nous allons maintenant aborder le traitement ciblé des NSCLC de stade IV avec des mutations pilotes classiques.
EGFR : des mutations activatrices du proto-oncogène “epidermal growth factor receptor” (EGFR) sont présentes dans 13 à 15% des adénocarcinomes pulmonaires en Europe centrale, avec une prévalence élevée chez les non-fumeurs (plus de 50% selon les études) [40]. Dans environ 90% des cas, il s’agit soit d’une délétion de l’exon 19, soit d’une mutation ponctuelle de l’exon 21 L858R [41]. Le traitement standard en première ligne est un EGFR-TKI. Ce traitement s’accompagne d’un avantage statistiquement significatif en termes de PFS par rapport à la chimiothérapie à base de platine [42]. Les ITK disponibles sont le gefitinib et l’erlotinib (première génération), l’afatinib et le dacomtinib (deuxième génération) et l’osimertinib (troisième génération). Sous EGFR-TKI de première génération, une résistance au traitement apparaît en moyenne après 10-14 mois, dans 50-60% des cas en raison d’une deuxième mutation de l’EGFR (T790M) [43]. L’osimertinib, un TKI présentant une bonne disponibilité au niveau du SNC et une bonne efficacité en présence d’une mutation T790M de l’EGFR, a été évalué contre le gefitinib et l’erlotinib dans le cadre de l’étude FLAURA. Les données publiées en 2017 ont démontré un avantage statistiquement significatif en termes de SSP en faveur de l’osimertinib (18,9 mois avec l’osimertinib contre 10,2 mois avec le gefitinib et l’erlotinib respectivement, (HR 0,46 ; IC à 95% 0,37-0,57 ; p<0,001) [44]. Une meilleure efficacité contre les métastases cérébrales et une meilleure tolérance ont été démontrées pour l’osimertinib. Les dernières données de l’étude FLAURA, qui seront présentées en septembre lors du congrès annuel de l’ESMO 2019, montrent pour la première fois un avantage statistiquement significatif de l’osimertinib en termes de survie après [45]. L’osimertinib s’établira ainsi définitivement comme traitement de première intention pour tous les patients atteints de NSCLC à EGFR muté, indépendamment de T790M ou de métastases cérébrales. L’association d’un EGFR-TKI et d’une chimiothérapie, principalement dans le cas d’un NSCLC muté EGFR, n’est pas considérée comme un standard à l’heure actuelle, mais a fait l’objet de plusieurs études. L’étude japonaise de phase III NEJ009 a comparé le géfitinib à géfitinib + chimiothérapie (carboplatine et pemetrexed), montrant un avantage statistiquement significatif en termes de SSP (21 vs. 11 mois ; HR 0,49, IC à 95% 0,39-0,63) et d’OS (52 vs. 39 mois ; HR 0,70, IC à 95% 0,52-0,93), mais associé à un taux plus élevé de grade 3 Toxicité (65% vs. 31%) [46]. D’autres études (avec l’erlotinib et le gefitinib) confirment ces résultats. La combinaison de l’EGFR-TKI erlotinib avec l’anticorps VEGFR bevacizumab a apporté un avantage en termes de PFS, mais pas d’OS, par rapport à une monothérapie par erlotinib [47].
ALK : Des translocations du proto-oncogène de la kinase du lymphome anaplasique (ALK) sont présentes dans 3 à 5% des adénocarcinomes pulmonaires [48], à nouveau plus fréquemment chez les non-fumeurs [49]. Les ITK ALK disponibles sont le crizotinib, le céritinib, l’alectinib, le brigatinib et la lorlatinineb. La molécule de choix en première ligne de traitement est l’alectinib, en raison de sa bonne compatibilité avec le SNC et de sa supériorité par rapport au crizotinib dans l’étude ALEX [50,51]. Le choix de l’ALK-TKI dans d’autres lignées dépend notamment de la disponibilité, de l’atteinte cérébrale et des mutations de résistance [52].
ROS1 : des translocations du proto-oncogène 1 ROS (ROS1) sont présentes dans 1 à 2% des adénocarcinomes pulmonaires, là encore plus fréquemment chez les non-fumeurs. En raison de la similitude structurelle des kinases ALK et ROS1, de nombreux inhibiteurs ALK, à l’exception de l’alectinib, sont également adaptés à l’inhibition de ROS1. Le traitement des tumeurs pulmonaires mutées ROS1 par crizotinib est le traitement de choix [53]. Le lorlatinib a montré une très bonne efficacité dans une étude de phase II, notamment en cas de résistance au crizotinib [54]. Le céritinib, l’entrectinib et le repotrectinib sont d’autres inhibiteurs puissants de ROS1.
BRAF : la mutation ponctuelle de BRAF est présente dans 1 à 2 % des adénocarcinomes pulmonaires, tant chez les fumeurs que chez les non-fumeurs. Dans environ deux tiers des cas, il existe une mutation V600E typique qui peut être traitée. Dans ce cas, le traitement de choix est une combinaison de dabrafenib et de trametinib, à la fois chez les patients naïfs de traitement et chez les patients prétraités [55,56]. Cependant, les CBNPC avec BRAF V600E répondent également à la chimiothérapie et à l’immunothérapie. Pour les mutations BRAF autres que V600E, une thérapie ciblée n’est actuellement pas recommandée en dehors des études.
KRAS : en présence d’une mutation activatrice du proto-oncogène Kirsten ras (KRAS), ces NSCLC n’étaient jusqu’à présent pas considérés comme pouvant être traités de manière ciblée et étaient soumis à une chimio-immunothérapie. KRAS a tout de même été testé, car un résultat positif rendait superflue la recherche d’autres mutations du pilote. En 2019, les premiers résultats d’un essai clinique avec l’inhibiteur spécifique de KRAS G12C AMG510 ont été rapportés [57]. Ces résultats sont très encourageants et des études de suivi sont maintenant ouvertes dans de nombreux centres pour recruter un grand nombre de patients. D’autres inhibiteurs de KRAS sont également en cours de développement.
RET : Les translocations “Rearranged during transfection” (RET) sont trouvées dans environ 1-2% des adénocarcinomes pulmonaires. Des ITK peu sélectifs comme le cabozantinib ont montré une certaine efficacité, bien que très limitée dans le temps [58]. Les inhibiteurs RET hautement sélectifs comme LOXO-292 et BLU-667 représentent donc une avancée majeure dans le traitement des tumeurs pulmonaires mutées RET. LOXO-292 est étudié dans l’étude LIBRETTO-001 (NCT03157128). Les premiers résultats ont montré un taux de réponse de 65%, avec une très bonne tolérance [59]. De nouvelles données seront présentées lors du congrès annuel de l’IASLC en septembre 2019. Les centres participants sont notamment Lucerne (CH) et Cologne (DE). L’inhibiteur RET BLU-667 est étudié dans l’étude ARROW (NCT03037385). Le taux de réponse préliminaire était de 56% [60]. Le centre participant est, entre autres, Heidelberg (DE).
NTRK : Les fusions de l’un des proto-oncogènes “neurotrophic receptor thyrosin kinase 1-3” (NTRK 1-3) sont présentes dans 1% des NSCLC. L’inhibiteur de TRK larotrectinib (LOXO-101) a montré jusqu’à présent un ORR de 75% dans les études de phase I-II avec une réponse continue et une très bonne tolérance [61]. Autorisé jusqu’à présent aux États-Unis, il n’a pas encore été autorisé en Europe et en Suisse. Entrectinib (RXDX-101), un autre inhibiteur de TRK, a montré un ORR de 57% dans les tumeurs solides avec une fusion NTRK prouvée dans l’analyse combinée de trois études de phase I-II, avec également une très bonne tolérance [62].
Conclusion
Les développements actuels dans les domaines de l’immunothérapie et de la thérapie ciblée montrent que le potentiel de ces approches dans le cancer bronchique est loin d’être épuisé. L’utilité de ces traitements en situation palliative n’est plus à démontrer et des études cliniques sont également en cours en situation adjuvante. Indépendamment de cela, des efforts accrus doivent également être déployés dans les domaines de la prévention et du dépistage précoce afin de parvenir à une diminution du nombre de cancers bronchiques (en particulier des stades métastatiques).
Messages Take-Home
- Le cancer bronchique est la première cause de mortalité liée au cancer dans le monde et le tabagisme en est la principale cause.
- La nouvelle norme de traitement du cancer bronchique à petites cellules (CPPC) de stade IV est la combinaison de la chimiothérapie (carboplatine et
- étoposide) avec l’inhibiteur de point de contrôle immunitaire atezolizumab.
- Les patients atteints de cancer bronchique non à petites cellules (CBNPC) de stade III bénéficient d’une immunothérapie de consolidation par durvalumab après une radiothérapie/chimiothérapie définitive.
- La recherche de mutations pilotes (principalement EGFR, ALK, ROS1 et BRAF) et du degré d’expression de PD-L1 dans les CBNPC non squameux à un stade avancé est essentielle pour le choix du traitement.
- Les NSCLC avec des mutations traitables doivent être traités en priorité de manière ciblée ; le traitement des NSCLC sans détection d’une mutation pilote traitable est principalement basé sur le statut d’expression de PD-L1.
Littérature :
- Bray F, et al : Global cancer statistics 2018 : GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin, 2018. 68(6) : p. 394-424.
- www.bfs.admin.ch/bfs/de/home/statistiken/kataloge-datenbanken/tabellen.assetdetail.6466432.html.
- Arndt V : Rapport suisse sur le cancer 2015 : état des lieux et développements. 2016 : Office fédéral de la statistique (OFS).
- Forman D, et al. : La charge mondiale et régionale du cancer. World cancer report, 2014. 2014 : 16-53.
- Sun S, Schiller JH, Gazdar AF : Le cancer du poumon chez les never smokers – une maladie différente. Nat Rev Cancer, 2007. 7(10) : 778-790.
- van Meerbeeck JP, Fennell DA, De Ruysscher DK : Small-cell lung cancer. Lancet, 2011. 378(9804) : 1741-1755.
- Yang CF, et al : Role of Adjuvant Therapy in a Population-Based Cohort of Patients With Early-Stage Small-Cell Lung Cancer. J Clin Oncol, 2016. 34(10) : 1057-1064.
- Warde P, Payne D : L’irradiation thoracique améliore-t-elle la survie et le contrôle local dans le carcinome à cellules sèches du poumon de stade limité ? Une méta-analyse. J Clin Oncol, 1992. 10(6) : 890-895.
- Pignon JP, et al : A Meta-Analysis of Thoracic Radiotherapy for Small-Cell Lung Cancer. New England Journal of Medicine, 1992. 327(23) : 1618-1624.
- Mascaux C., et al : A systematic review of the role of etoposide and cisplatin in the chemotherapy of small cell lung cancer with methodology assessment and meta-analysis. Lung Cancer, 2000. 30(1) : 23-36.
- Rossi A, et al : Chimiothérapie à base de carboplatine ou de cisplatine dans le traitement de première ligne du cancer du poumon à petites cellules : la méta-analyse COCIS des données individuelles des patients. J Clin Oncol, 2012. 30(14) : 1692-1698.
- Slotman BJ, et al : Use of thoracic radiotherapy for extensive stage small-cell lung cancer : a phase 3 randomised controlled trial. Lancet, 2015. 385(9962) : 36-42.
- Horn L, et al : Atezolizumab de première ligne plus chimiothérapie dans le cancer du poumon à petites cellules de stade avancé. N Engl J Med, 2018. 379(23) : 2220-2229.
- www.astrazeneca.com/media-centre/press-releases/2019/imfinzi-improves-overall-survival-at-interim-analysis-in-the-phase-iii-caspian-trial-in-1st-line-extensive-stage-small-cell-lung-cancer-27062019.html.
- Auperin A, et al. : Irradiation crânienne prophylactique pour les patients atteints de cancer du poumon à petites cellules en rémission complète. Prophylactic Cranial Irradiation Overview Collaborative Group. N Engl J Med, 1999. 341(7) : 476-484.
- Slotman B, et al : Prophylactic cranial irradiation in extensive small-cell lung cancer. N Engl J Med, 2007. 357(7) : 664-672.
- Takahashi T, et al : Prophylactic cranial irradiation versus observation in patients with extensive-disease small-cell lung cancer : a multicentre, randomised, open-label, phase 3 trial. Lancet Oncol, 2017. 18(5) : 663-671.
- Gjyshi O, et al : Evolving Practice Patterns in the Use of Prophylactic Cranial Irradiation for Extensive-Stage Small Cell Lung CancerProphylactic Cranial Irradiation for Extensive-Stage Small Cell Lung CancerProphylactic Cranial Irradiation for Extensive-Stage Small Cell Lung Cancer. JAMA Network Open, 2019. 2(8) : e199135-e199135.
- Böttger F, et al : Tumor Heterogeneity Underlies Differential Cisplatin Sensitivity in Mouse Models of Small-Cell Lung Cancer. Cell reports, 2019. 27(11) : 3345-3358. e4.
- O’Brien ME, et al : Phase III trial comparing supportive care alone with supportive care with oral topotecan in patients with relapsed small-cell lung cancer. J Clin Oncol, 2006. 24(34) : 5441-5447.
- von Pawel J, et al : Topotecan versus cyclophosphamide, doxorubicine, et vincristine pour le traitement du cancer du poumon à petites cellules récidivant. J Clin Oncol, 1999. 17(2) : 658-667.
- Eckardt JR, et al : Open-label, multicenter, randomized, phase III study comparing oral topotecan/cisplatin versus etoposide/cisplatin as treatment for chemotherapy-naive patients with extensive-disease small-cell lung cancer. J Clin Oncol, 2006. 24(13) : 2044-2051.
- Garassino MC, et al : Outcomes of small-cell lung cancer patients treated with second-line chemotherapy : a multi-institutional retrospective analysis. Lung Cancer, 2011. 72(3) : 378-83.
- Chung HC, et al : Abstract CT073 : Pembrolizumab après deux ou plusieurs lignes de traitement antérieur chez des patients atteints de cancer du poumon à petites cellules en phase avancée (SCLC) : Résultats des études KEYNOTE-028 et KEYNOTE-158. Cancer Research, 2019. 79(13 Supplément) : CT073-CT073.
- Ready N, et al : Third-Line Nivolumab Monotherapy in Recurrent SCLC : CheckMate 032. J Thorac Oncol, 2019. 14(2) : 237-244.
- Pless M., et al : Induction chemoradiation in stage IIIA/N2 non-small-cell lung cancer : a phase 3 randomised trial. The Lancet, 2015. 386(9998) : 1049-1056.
- Burdett S, et al : Radiothérapie postopératoire pour le cancer du poumon non à petites cellules. Cochrane database of systematic reviews, 2016(10).
- Antonia SJ, et al : Durvalumab after chemoradiotherapy in Stage III Non-Small-Cell Lung Cancer. N Engl J Med, 2017. 377(20) : 1919-1929.
- Antonia SJ, et al : Overall Survival with Durvalumab after Chemoradiotherapy in Stage III NSCLC. N Engl J Med, 2018. 379(24) : 2342-2350.
- Reck M, et al : Pembrolizumab versus chimiothérapie pour le cancer du poumon non à petites cellules PD-L1 positif. N Engl J Med, 2016. 375(19) : 1823-1833.
- Gandhi L, et al : Pembrolizumab plus chimiothérapie dans le cancer du poumon non à petites cellules métastatique. N Engl J Med, 2018. 378(22) : 2078-2092.
- Socinski, M.A., et al : Atezolizumab for First-Line Treatment of Metastatic Nonsquamous NSCLC. N Engl J Med, 2018. 378(24) : 2288-2301.
- West H., et al. : Atezolizumab en association avec le carboplatine plus chimiothérapie nab-paclitaxel par rapport à la chimiothérapie seule en tant que traitement de première ligne pour le cancer du poumon métastatique non squamous non-small-cell (IMpower130) : un essai de phase 3, multicentrique, randomisé, en ouvert. Lancet Oncol, 2019. 20(7) : 924-937.
- Paz-Ares L, et al : Pembrolizumab plus chimiothérapie pour le cancer du poumon non à petites cellules malpighien. N Engl J Med, 2018. 379(21) : 2040-2051.
- Vokes EE, et al : Nivolumab versus docetaxel dans le cancer du poumon non à petites cellules avancé précédemment traité (CheckMate 017 et CheckMate 057) : mise à jour à 3 ans et résultats chez les patients présentant des métastases hépatiques. Ann Oncol, 2018. 29(4) : 959-965.
- Rittmeyer A, et al : Atezolizumab versus docetaxel chez les patients atteints de cancer du poumon non à petites cellules (CPNC) précédemment traités : un essai randomisé contrôlé multicentrique de phase 3, en ouvert. Lancet, 2017. 389(10066) : 255-265.
- Fehrenbacher L, et al : Updated Efficacy Analysis Including Secondary Population Results for OAK : A Randomized Phase III Study of Atezolizumab versus Docetaxel in Patients with Previously Treated Advanced Non-Small Cell Lung Cancer. J Thorac Oncol, 2018. 13(8) : 1156-1170.
- Herbst RS, et al : Pembrolizumab versus docetaxel pour le cancer du poumon avancé non à petites cellules PD-L1-positif précédemment traité (KEYNOTE-010) : un essai contrôlé randomisé. Lancet, 2016. 387(10027) : 1540-1550.
- Alexandrov LB, et al : Signatures des processus mutationnels dans le cancer humain. Nature, 2013. 500(7463) : 415.
- Shi Y, et al : Une étude épidémiologique moléculaire prospective des mutations de l’EGFR chez les patients asiatiques atteints de cancer du poumon non à petites cellules en phase avancée de l’histologie de l’adénocarcinome (PIONEER). J Thorac Oncol, 2014. 9(2) : 154-162.
- Mitsudomi T, Yatabe Y : Récepteur du facteur de croissance épidermique en relation avec le développement tumoral : gène EGFR et cancer. The FEBS journal, 2010. 277(2) : 301-308.
- Lee CK, et al : Impact de l’inhibiteur de l’EGFR dans le cancer du poumon non à petites cellules sur la survie sans progression et la survie globale : a meta-analysis. J Natl Cancer Inst, 2013. 105(9) : 595-605.
- Wu SG, Shih J-Y, Management of acquired resistance to EGFR TKI-targeted therapy in advanced non-small cell lung cancer. Cancer moléculaire, 2018. 17(1): 38.
- Soria JC, et al : Osimertinib in untreated EGFR-mutated advanced non-small-cell lung cancer. New England journal of medicine, 2018. 378(2) : 113-125.
- Tagrisso améliore significativement la survie globale dans l’essai FLAURA de phase III pour le cancer du poumon non à petites cellules muté par EGFR en première ligne [press release]. Wilmington, DE : AstraZeneca ; Août 9, 2019. https://bit.ly/2ZGF7gZ.
- Nakamura A, et al. : Étude de phase III comparant le gefitinib en monothérapie (G) au traitement combiné par le gefitinib, le carboplatine et le pemetrexed (GCP) pour les patients non traités (pts) atteints de cancer du poumon non à petites cellules en phase avancée (NSCLC) avec mutations de l’EGFR (NEJ009). Journal of Clinical Oncology, 2018. 36(15_suppl) : 9005-9005.
- Saito H, et al : erlotinib plus bevacizumab versus erlotinib seul chez les patients atteints de cancer du poumon avancé non squameux à cellules non malignes EGFR-positif (NEJ026) : analyse intermédiaire d’une étude randomisée en ouvert de phase 3 multicentrique. Lancet Oncol, 2019. 20(5) : 625-635.
- Soda M, et al : Identification of the transforming EML4-ALK fusion gene in non-small-cell lung cancer. Nature, 2007. 448(7153) : 561.
- Shaw AT, et al : Caractéristiques cliniques et résultats des patients atteints de cancer du poumon non à petites cellules qui hébergent EML4-ALK. Journal of clinical oncology, 2009. 27(26) : 4247.
- Peters S, et al : Alectinib versus crizotinib in Untreated ALK-Positive Non-Small-Cell Lung Cancer. N Engl J Med, 2017. 377(9) : 829-838.
- Hida T, et al. : Alectinib versus crizotinib chez les patients atteints de cancer du poumon non à petites cellules ALK-positif (J-ALEX) : un essai randomisé de phase 3 en ouvert. Lancet, 2017. 390(10089) : 29-39.
- Ryser CO, Diebold J, Gautschi O : Treatment of anaplastic lymphoma kinase-positive non-small cell lung cancer : update and perspectives. Curr Opin Oncol, 2019. 31(1) : 8-12.
- Shaw AT, et al : Crizotinib in ROS1-rearranged non-small-cell lung cancer. New England Journal of Medicine, 2014. 371(21) : 1963-1971.
- Ou S, et al. : OA02. 03 Activité clinique du lorlatinib chez les patients atteints de cancer du poumon avancé non à petites cellules ROS1+ : cohorte d’étude de phase 2 EXP-6. Journal of Thoracic Oncology, 2018. 13(10) : S322-S323.
- Planchard D, et al : Dabrafenib plus trametinib chez les patients atteints de cancer du poumon non à petites cellules métastatique BRAF(V600E)-mutant précédemment traité : un essai de phase 2 multicentrique en ouvert. Lancet Oncol, 2016. 17(7) : 984-993.
- Planchard D, et al : Dabrafenib plus trametinib chez les patients atteints de cancer du poumon non à petites cellules métastatique BRAF(V600E)-mutant précédemment non traité : un essai de phase 2 en ouvert. Lancet Oncol, 2017. 18(10) : 1307-1316.
- Fakih M, et al. : Étude de phase 1 évaluant la sécurité, la tolérance, la pharmacocinétique (PK) et l’efficacité de l’AMG 510, un nouvel inhibiteur de petite molécule KRASG12C, dans les tumeurs solides avancées. Journal of Clinical Oncology, 2019. 37(15_suppl) : 3003-3003.
- Gautschi O, et al : Targeting RET in Patients With RET-Rearranged Lung Cancers : Results From the Global, Multicenter RET Registry. J Clin Oncol, 2017. 35(13) : 1403-1410.
- Drilon AE, et al : A phase 1 study of LOXO-292, a powerful and highly selective RET inhibitor, in patients with RET-altered cancers. Journal of Clinical Oncology, 2018. 36(15_suppl) : 102-102.
- Gainor JF, et al : Activité clinique et tolérance de BLU-667, un inhibiteur RET très puissant et sélectif, chez des patients (pts) atteints de cancer du poumon non à petites cellules (NSCLC) avancé par fusion RET+. Journal of Clinical Oncology, 2019. 37(15_suppl) : 9008-9008.
- Drilon A, et al. : Efficacité du larotrectinib dans les cancers TRK fusion-positifs chez l’adulte et l’enfant. New England Journal of Medicine, 2018. 378(8) : 731-739.
- Demetri GD, et al. : LBA17Efficacité et sécurité de l’entrectinib chez les patients atteints de tumeurs à fusion NTRK positive (NTRK-fp) : analyse groupée de STARTRK-2, STARTRK-1 et ALKA-372-001. Annals of Oncology, 2018. 29(suppl_8).
- “DeVita”, Hellman and Rosenberg’s Cancer : Principles & Practice of Oncology, 11th edition ; Wolters Kluwer, 2019.
InFo ONKOLOGIE & HÉMATOLOGIE 2019 ; 7(4) : 12-17