Les bases du diagnostic du carcinome urothélial sont l’urétrocystoscopie, la cytologie de rinçage de la vessie et la tomodensitométrie avec phase d’excrétion. Les techniques d’amélioration de l’image augmentent la précision diagnostique de l’urétrocystoscopie et peuvent ainsi améliorer la survie sans récidive du carcinome urothélial superficiel de la vessie et du haut appareil urinaire. La TEP/TDM au FDG n’offre pas d’avantage pertinent dans le diagnostic primaire des métastases ganglionnaires du carcinome urothélial invasif. Malgré une imagerie de pointe, 25% des patients devant subir une cystectomie pour un carcinome urothélial invasif et considérés comme négatifs au niveau des ganglions lymphatiques en préopératoire (cN0) présentent des métastases ganglionnaires (pN+). Une lymphadénectomie pelvienne étendue doit donc impérativement être réalisée dans le cadre de la cystectomie, même au stade cN0.
Le carcinome urothélial est le sixième type de cancer le plus fréquent dans le monde occidental [1] et l’un des plus coûteux d’un point de vue économique [2]. Outre les coûts des interventions chirurgicales, qui sont loin d’être négligeables, notamment en raison du taux élevé de récidive du cancer de la vessie, les examens diagnostiques sont également une cause majeure de ces coûts élevés. Dans ce contexte, il convient de porter un regard critique sur les diagnostics en constante évolution. Les différentes options de diagnostic du carcinome urothélial sont examinées ci-dessous.
Analyse d’urine
Outre l’anamnèse (macrohématurie ?), la première étape du diagnostic est l’analyse d’urine. Le test à la bandelette a une sensibilité très élevée pour la microhématurie (jusqu’à 97%), mais peut être faussement positif en cas d’urine alcaline, d’hémolyse, de myoglobinurie, après éjaculation ou à cause d’oxydants (dont la béthadine). C’est pourquoi, en cas de test à la bandelette positif, le résultat doit toujours être confirmé par un examen microscopique de l’urine. Il est également important de minimiser les analyses d’urine faussement positives en recueillant correctement les urines (urine à jet moyen, éventuellement urine à usage unique par cathéter chez la femme).

Si une tumeur de la vessie est suspectée, une cytologie urinaire doit être effectuée. La cytologie urinaire la plus sensible est celle obtenue par cytologie de rinçage de la vessie, qui consiste à prélever des cellules de la paroi vésicale à l’aide d’un cathéter à usage unique, suivi d’un rinçage de la vessie avec une solution physiologique. La cytologie urinaire présente une grande sensibilité, en particulier pour le diagnostic des tumeurs de la vessie mal différenciées (haut grade : G3/4). En cas de carcinome in situ (CIS), la sensibilité de la cytologie de la vessie peut même atteindre 97% et est considérée comme suffisante pour initier une immunothérapie par BCG intravésical en l’absence de tumeur solide. La cytologie urinaire ne permet toutefois pas de déterminer l’origine des cellules tumorales (vessie ou voies urinaires supérieures).
Bien que de nombreux systèmes de marqueurs de tumeurs de la vessie soient disponibles sur le marché (notamment UroVysion FISH, Immunocyt/uCyt +, Bladder Tumor Antigen, Nuclear Matrix Protein 22), aucun ne s’est encore établi dans la pratique clinique quotidienne, que ce soit pour le diagnostic primaire ou comme marqueur dans le cadre du suivi [3]. Pour les tumeurs bien différenciées (bas grade : G1/2), la sensibilité est certes plus élevée (50-80%) que celle de la cytologie, mais la spécificité est aussi nettement plus faible. Les modifications bénignes de la muqueuse de la vessie, en particulier, peuvent donner lieu à des résultats faussement positifs.
Examens sanguins
Bien que l’anémie par hémorragie soit un résultat fréquent chez les patients atteints d’un carcinome urothélial invasif, l’analyse sanguine ne permet pas de diagnostiquer un carcinome urothélial en raison de l’absence de marqueurs tumoraux spécifiques du carcinome urothélial.
Uréthrocystoscopie (examen de la vessie)
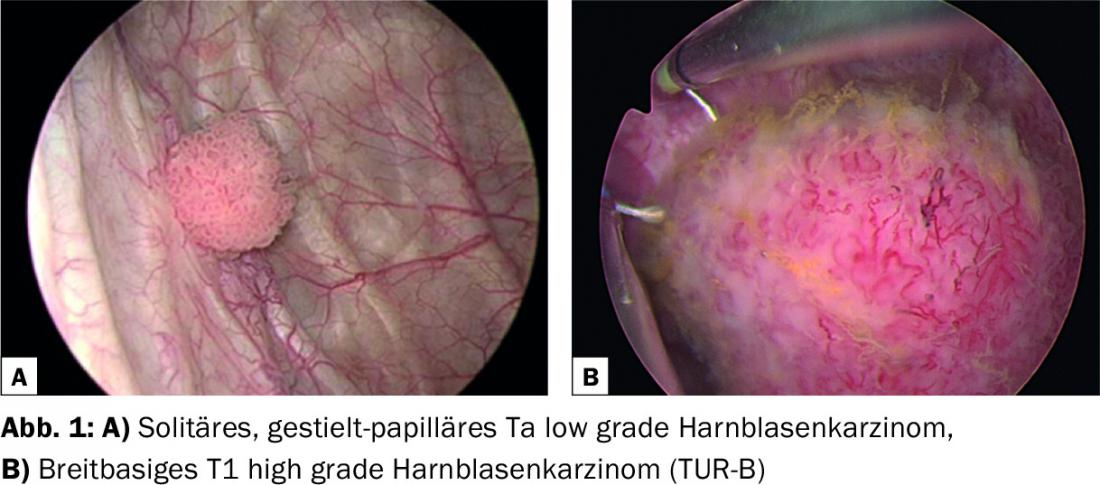
La pierre angulaire de tout diagnostic de cancer urothélial est l’urétrocystoscopie. (Fig.1). En cas de résultats positifs, la confirmation histologique se fait par résection transurétrale (TUR-B) sous anesthésie spinale ou sous intubation. (Fig. 1b). Les parties exophytiques et la base de la tumeur, qui doit impérativement contenir du muscle de la paroi vésicale, sont alors enlevées et généralement envoyées séparément pour évaluation histologique. Dans le cadre du TUR-B, un examen bimanuel est également effectué pour évaluer la présence d’une croissance tumorale dépassant les limites de l’organe (≥cT3). La fixation de la vessie aux structures voisines ou à la paroi pelvienne laisse supposer une croissance dépassant les limites de l’organe. Il a été démontré que, malgré le développement massif des diagnostics radiologiques, la palpation bimanuelle offre une amélioration supplémentaire pour la détection de l’hypertrophie des organes [4].
Procédures cystoscopiques d’amélioration de l’image
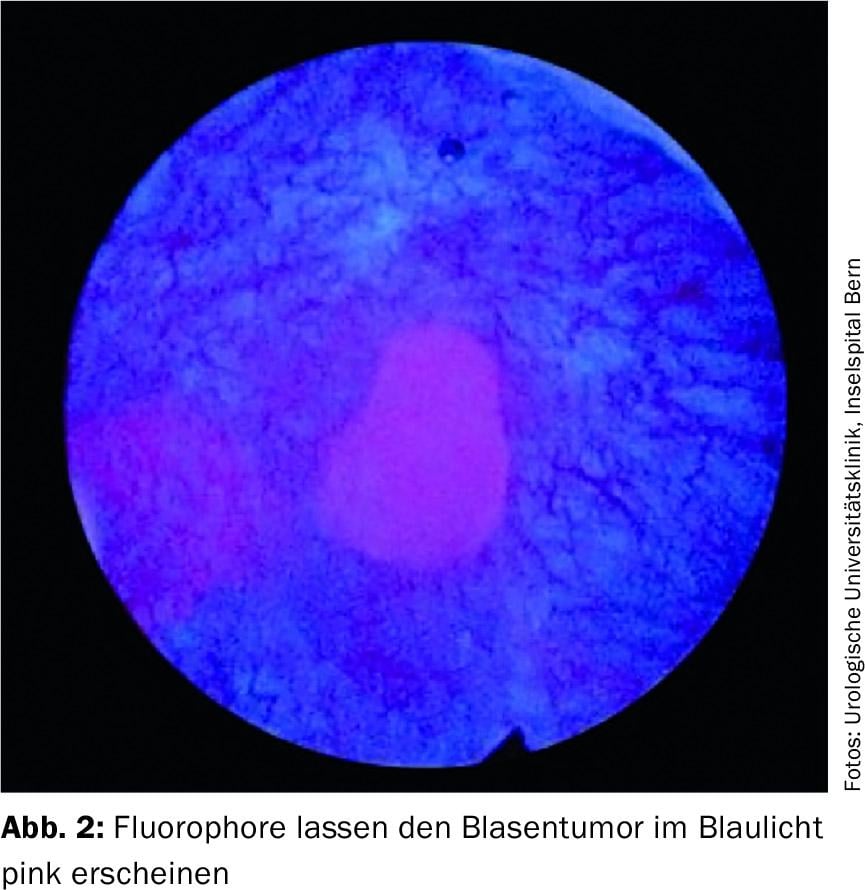
Le diagnostic photodynamique (PDD) permet de mieux détecter le carcinome urothélial pendant l’urétrocystoscopie. Il s’agit d’instiller un colorant fluorescent dans la vessie via une sonde vésicale 1 à 2 heures avant l’intervention prévue. L’accumulation des fluorophores dans les cellules malignes fait que celles-ci deviennent roses sous l’effet de la lumière bleue (Fig. 2). Le PDD montre un taux de détection amélioré, en particulier en présence d’un CIS. Ainsi, la PDD a permis de montrer une diminution du taux de récidive à 12 mois [5]. Toutefois, les résultats à long terme concernant le taux de survie et le taux de progression font défaut. En outre, l’inconvénient potentiel du PDD est le taux élevé de faux positifs.
D’autres méthodes permettant d’améliorer le diagnostic endoscopique sont le Narrow band imaging (NBI) et le Storz Professional Image Enhancement System (SPIES), deux méthodes qui, grâce à des filtres (bleu/vert) ainsi qu’à une amplification optique, permettent d’obtenir un meilleur contraste entre la zone tumorale hyperperfusée et la muqueuse vésicale normale pendant l’urétrocystoscopie (fig. 3) [6]. Il semble qu’il y ait un avantage possible en termes de survie sans récidive pour le carcinome urothélial non invasif de la vessie par rapport à la cystoscopie standard en lumière blanche, mais pas en termes de survie sans progression [7]. Le NBI et le SPIES donnent des résultats similaires [8]. Comme il s’agit de procédures purement basées sur la technologie de l’image, les coûts supplémentaires sont très modérés, c’est pourquoi ce type de diagnostic devrait s’établir à l’avenir.

Une nouvelle approche consiste à combiner des anticorps spécifiques de la tumeur (dont le CD47) avec des fluorophores. Ces anticorps conjugués sont instillés dans la vessie puis éliminés par lavage. Les zones tumorales peuvent ensuite être détectées par urétrocystoscopie à lumière bleue. Les premiers résultats montrent une sensibilité (83%) et une spécificité (>90%) très élevées [9].
Généralités sur l’imagerie
L’échographie peut donner les premiers indices d’une tumeur de la vessie. Cependant, comme la spécificité et surtout la sensibilité sont faibles, l’échographie ne fait pas partie du diagnostic standard du carcinome urothélial, contrairement à la tomodensitométrie (TDM ; y compris la phase d’excrétion) ou à l’imagerie par résonance magnétique (IRM). Le scanner est généralement préféré à l’IRM car, en phase d’excrétion, le scanner permet de mieux préciser le haut appareil urinaire (second carcinome urothélial extravésical ?).
Imagerie de la tumeur primaire
Pour déterminer s’il s’agit d’un carcinome urothélial superficiel ou invasif, le TUR-B diagnostique est supérieur à toute imagerie non invasive disponible à ce jour. Cependant, le TUR-B seul et la palpation bimanuelle sous-estiment une extension extravésicale (≥T3) dans environ 40% des cas [1]. En ce qui concerne l’évaluation de l’extension extravésicale, l’IRM dynamique à contraste amélioré semble offrir un avantage diagnostique de 10 à 33% par rapport à la tomodensitométrie [10], avec une précision de 40 à 67% pour l’évaluation de la profondeur d’invasion par IRM [10,11]. L’imagerie RM multiparamétrique n’a pas permis d’améliorer significativement la précision du staging tumoral (52-85%) [11]. La meilleure prédiction du stade histologique définitif de la tumeur peut être obtenue en combinant l’imagerie et la palpation bimanuelle (sensibilité 66% ; spécificité 89%) [4].
Imagerie des ganglions lymphatiques
25% des patients considérés comme ayant des ganglions lymphatiques négatifs (cN0) par scanner ou IRM préopératoire se révèlent être des ganglions lymphatiques positifs (pN+) après lymphadénectomie pelvienne étendue. Si l’on considère que les examens moléculaires des ganglions lymphatiques révèlent en outre la présence de cellules tumorales dans les ganglions lymphatiques chez jusqu’à 30% des patients pN0, il faut partir du principe qu’avec le seul examen par scanner, environ 30 à 40% des métastases des ganglions lymphatiques sont manquées [12]. Ce sont surtout les petites métastases (<6 mm) qui passent souvent inaperçues, alors que les ganglions lymphatiques agrandis de manière réactive sont souvent mal interprétés comme positifs. Il est donc évident que de nouvelles techniques d’imagerie sont nécessaires.
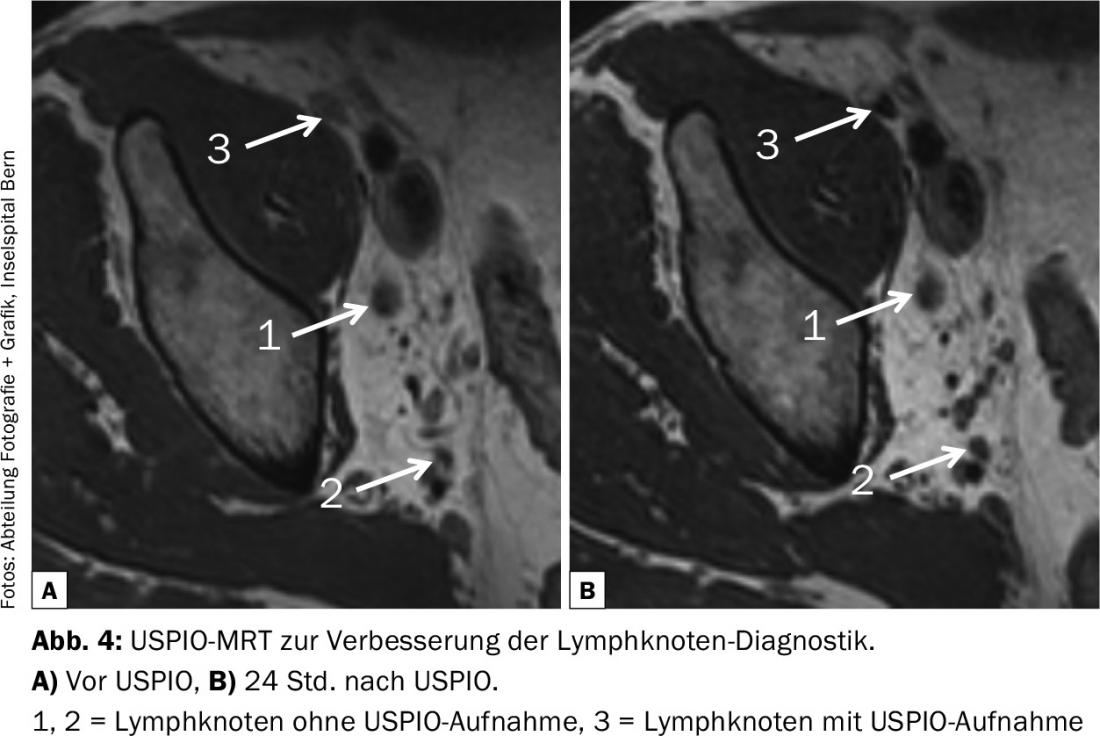
Une amélioration peut être obtenue par IRM pondérée par la diffusion (sensibilité : 64-79%, spécificité 79-85%), en particulier lorsqu’elle est combinée avec une IRM USPIO (ultrasmall supermagnetic particles of iron oxide), où ces particules de fer “supermagnétiques” sont utilisées comme agent de contraste (Fig. 4) [13]. Cet examen complexe permet d’améliorer le taux de détection des métastases dans les ganglions lymphatiques non hypertrophiés, mais 25 à 35% des ganglions positifs ne sont toujours pas détectés en préopératoire. C’est pourquoi, dans le cadre d’une cystectomie, une lymphadénectomie pelvienne précise et étendue doit toujours être réalisée malgré une imagerie négative. D’autant plus que le drainage lymphatique dans le carcinome urothélial de la vessie varie d’un patient à l’autre, comme cela a été démontré par des examens SPECT-CT [14]. C’est l’une des raisons pour lesquelles le concept de ganglion sentinelle ne fonctionne pas dans le cas du cancer urothélial – avec le fait que le tissu métastatique dans les ganglions lymphatiques ou les vaisseaux lymphatiques empêche l’absorption du traceur radioactif et conduit à des voies de contournement lymphatiques secondaires.
PET-CT
Dans le cas du carcinome urothélial, la tumeur primaire et les métastases présentent toutes deux une consommation accrue de glucose, la TEP/TDM au fluorodésoxyglucose (FDG) semble donc prometteuse pour le diagnostic. Alors que les résultats initiaux en 2010 montraient des résultats prometteurs pour le diagnostic des métastases ganglionnaires (sensibilité de 46%, spécificité de 97%), les données récemment publiées par Aljabery et al. a été décevante : la TEP/TDM au FDG n’a montré aucun avantage en termes de sensibilité (41% vs. 41%) ou de spécificité (86% vs. 89%) par rapport à la TDM ordinaire [15,16].
Diagnostics supplémentaires
Pour compléter le staging, il est recommandé de réaliser à la fois un scanner thoracique et une scintigraphie du squelette, car les sites de prédilection de la métastase hématogène dans le carcinome urothélial sont les poumons et les os [3].
Conclusion
Malgré d’importants progrès techniques, l’urétrocystoscopie combinée à la cytologie de la vessie reste la pierre angulaire du diagnostic du carcinome de la vessie. La diversité des systèmes de marqueurs tumoraux pour l’analyse de l’urine ne peut masquer le fait que la sensibilité et la spécificité de ces systèmes sont toutes deux trop faibles pour permettre un diagnostic pertinent. Les techniques d’imagerie récentes peuvent certes améliorer le diagnostic de stade, mais elles sont loin de pouvoir prédire avec une forte probabilité ne serait-ce que la propagation extravésicale (≥ T3). En outre, bien que les techniques d’imagerie modernes permettent d’améliorer légèrement la détection des métastases ganglionnaires, 25% des patients positifs pour les ganglions lymphatiques sont encore considérés à tort comme négatifs en préopératoire. C’est pourquoi une lymphadénectomie pelvienne étendue doit toujours être réalisée dans le cadre de la cystectomie, indépendamment du statut ganglionnaire préopératoire.
Littérature :
- Rais-Bahrami S, et al : Rôle contemporain de l’imagerie avancée pour le staging du cancer de la vessie. Urol Oncol 2016 ; 34(3) : 124-33.
- Svatek RS, et al : The economics of bladder cancer : costs and considerations of caring for this disease. Eur Urol 2014 ; 66(2) : 253-62.
- Lignes directrices de l’EAU sur le cancer de la vessie, 2015.
- Rozanski AT, et al. : L’examen sous anesthésie est-il encore nécessaire pour le staging du cancer de la vessie à l’ère de l’imagerie moderne ? Bladder Cancer 2015 ; 1(1) : 91-96.
- O’Brian T, et al. : Essai randomisé prospectif de résection transurétrale de tumeur de la vessie assistée par photodynamique hexylaminolévulinate (TURBT) plus mitomycine C intravésicale à dose unique contre TURBT à lumière blanche conventionnel plus mitomycine C dans le cancer de la vessie non invasif des muscles nouvellement présenté. BJU Int 2013 ; 112(8) : 1096-1104.
- Cauberg EC, et al : Narrow band imaging cystoscopy improves the detection of non-muscle-invasive bladder cancer. Urologie 2010 ; 76(3) : 658-663.
- M. H : Essai randomisé de cystoscopie à bande étroite versus cystoscopie à lumière blanche pour la résection transurétrale (de deuxième intention) de tumeurs de la vessie. Eur Urol 2015 ; 67(4) : 605-608.
- Lee JY, et al : A network meta-analysis of therapeutic outcomes after new image technology-assisted transurethral resection for non-muscle invasive bladder cancer : 5-aminolaevulinic acid fluorescence vs hexylaminolevulinate fluorescence vs narrow band imaging. BMC Cancer 2015 ; 15 : 566.
- Pan Y, et al. : Imagerie moléculaire endoscopique du cancer de la vessie humaine à l’aide d’un anticorps CD47. Sci Transl Med 2014 ; 6(260) : 260.
- Barentsz JO, et al : Stadification primaire du carcinome urinaire de la vessie : le rôle de l’IRM et une comparaison avec le scanner. Eur Radiol 1996 ; 6 : 129-133.
- De Leon AD : Role of multiparametric MR imaging in malignancies of the urogenital tract. Magn Reson Imaging Clin N Am 2016 ; 24(1) : 187-204.
- Paik ML, et al : Limitations of computerized tomography in staging invasive bladder cancer before radical cystectomy. J Urol 2000 ; 163 : 1693-1696.
- Birkhäuser FD, et al : Combined ultrasmall superparamagnetic particles of iron oxide-enhanced and diffusion-weighted magnetic resonance imaging facilitates detection of metastases in normal-sized pelvic lymph nodes of patients with bladder and prostate cancer. Eur Urol 2013 ; 64(6) : 953-960.
- Roth B, et al : Une nouvelle technique multimodale cartographie avec précision les sites d’atterrissage lymphatiques primaires de la vessie. Eur Urol 2010 ; 57(2) : 205-211.
- Swinnen G, et al : FDG-PET/CT pour le staging préopératoire des ganglions lymphatiques du cancer invasif de la vessie. Eur Urol 2010 ; 57(4) : 641-647.
- Aljabery F, et al : PET/CT versus conventional CT for detection of lymph node metastases in patients with locally advanced bladder cancer. BMC Urol 2015 ; 15 : 87.
InFo ONKOLOGIE & HÄMATOLOGIE 2016 ; 4(5) : 14-17