La fibrillation auriculaire est le trouble du rythme cardiaque le plus fréquent dans le monde occidental. Le traitement interventionnel donne des résultats prometteurs. L’isolation des veines pulmonaires (PVI) joue un rôle clé. En outre, il y a des nouveautés comme ce qu’on appelle la “cartographie à haute densité” ou la localisation et la visualisation des rotors.
La FA est le trouble du rythme cardiaque le plus fréquent dans le monde occidental, avec une prévalence de 1,5 à 2 %. On estime qu’elle touche actuellement 34 millions de personnes dans le monde [1]. La cohorte Framingham a été étudiée en termes de risque de FA au cours de la vie et a révélé que 25% des hommes et des femmes >développeront une FA au cours de leur vie [2]. En raison du vieillissement de la population, la prévalence de la FA devrait doubler au cours des 50 prochaines années. La FA est associée à un risque accru d’accidents vasculaires cérébraux, d’insuffisance cardiaque, d’hospitalisations, mais aussi à une mortalité accrue et constitue donc un enjeu médical, économique et social particulièrement important. Outre le traitement pharmacologique, souvent inefficace et associé à des effets secondaires indésirables, le traitement interventionnel par cathéter de la FA s’est imposé comme le traitement de référence pour le contrôle du rythme dans les directives actuelles en raison de son efficacité [3]. Des études multicentriques randomisées (CABANA, EAST) sont en cours pour déterminer si le traitement interventionnel de la FA entraîne, outre une amélioration de la morbidité, une réduction de la mortalité [3].
Ablation de la fibrillation auriculaire
Après des ponctions veineuses inguinales et une ou deux ponctions transseptales à travers le septum auriculaire de l’oreillette droite à l’oreillette gauche, une reconstruction électro-anatomique tridimensionnelle de l’oreillette gauche est généralement réalisée aujourd’hui pour l’ablation par radiofréquence la plus couramment utilisée (Fig. 1), ce qui permet de réduire considérablement la durée de la fluoroscopie. Dans de nombreux centres, cette reconstruction est assistée par un scanner ou une imagerie par résonance magnétique réalisés au préalable. Une attention particulière doit être accordée à la reconstruction des veines pulmonaires (PV), de l’oreillette gauche (LAA) et de l’annulus mitral (MA). Une angiographie sélective de la PV peut être utile à cet égard. Les systèmes de cartographie tridimensionnelle permettent de créer des cartes de tension électrique (voltage) et d’activation, ce qui permet de recueillir des informations précieuses sur la présence d’un substrat pathologique dans l’oreillette gauche ainsi que sur les mécanismes et l’origine des troubles du rythme auriculaire. Les cathéters de diagnostic pour la dérivation de signaux électriques et la stimulation sont généralement placés dans le sinus coronaire et dans les PV. L’ablation de la FA se fait sous héparinisation thérapeutique. Les complications de l’ablation de la FA sont rares dans l’ensemble, les plus fréquentes étant les complications inguinales dans environ 2 à 4 % des cas (hémorragie, fistule artério-veineuse/anévrisme), suivies des épanchements péricardiques/tamponnades péricardiques (environ 1 à 2 %) et des accidents ischémiques transitoires/accidents vasculaires cérébraux (<1 %). La complication la plus redoutée est une fistule iatrogène entre l’œsophage et l’oreillette gauche (fistule atrio-œsophagienne), qui ne se manifeste généralement que quelques semaines après l’ablation, qui est globalement très rare (<0,5%), mais qui est souvent mortelle [3].
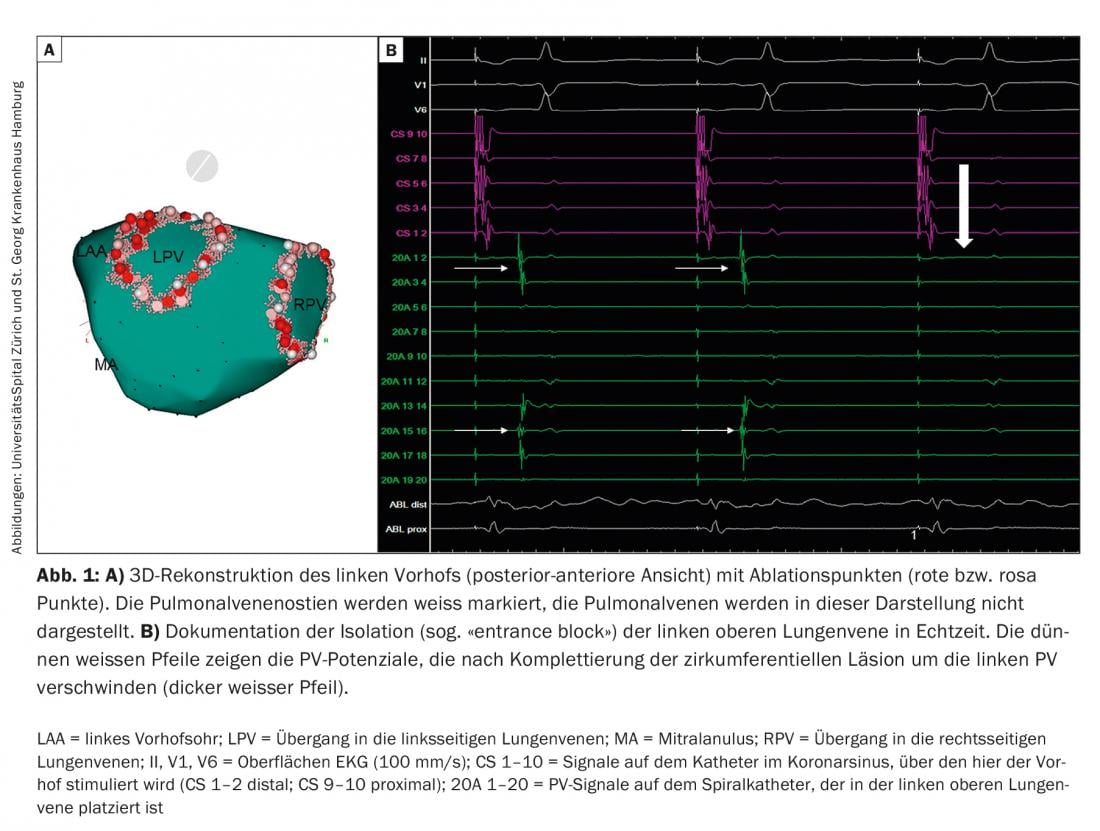
Fibrillation auriculaire paroxystique (FAP) : les foyers ectopiques sont responsables du déclenchement (appelé trigger) de la FA [4]. Comme les PV sont reliées à l’oreillette gauche par des fibres myocardiques, les actions électriques peuvent être transmises aux oreillettes par ces fibres et y déclencher des FA. Cette découverte a radicalement changé notre compréhension de la FA et nos stratégies thérapeutiques. Alors qu’au 20e siècle, le traitement de la FA par la chirurgie cardiaque visait à éliminer ou à réduire le substrat de la FA, c’est-à-dire le tissu auriculaire qui maintient la FA, les stratégies thérapeutiques actuelles, en particulier pour le FAP, visent à éliminer les déclencheurs. Comme ces déclencheurs se produisent le plus souvent dans les PV, l’isolation des veines pulmonaires (IVP) est devenue la principale stratégie thérapeutique invasive actuelle de la FA. Aujourd’hui, la PVI électrique circonférentielle “wide-area” par courant de radiofréquence (Fig. 1), ou l’isolation électrique de la PV par ballon froid (cryoballon ; Fig. 2) ou ballon laser, constituent la pierre angulaire du traitement interventionnel de la FA. En particulier chez les patients atteints de FAP, l’IPV peut conduire à un rythme sinusal stable chez la majorité des patients pendant quelques années. Cela vaut pour les jeunes adultes <45 ans [5], mais aussi pour les patients >80 ans. Cependant, pour certains patients, plusieurs interventions sont nécessaires. Notre expérience a montré qu’une absence à long terme de tachycardie auriculaire (TA) sur une période de suivi médiane de cinq ans après une intervention était présente chez 47% des patients. Toutefois, après plusieurs interventions (1 en médiane, fourchette de 1 à 3), ce chiffre a pu être augmenté à 80% [6]. Après une période de suivi médiane de dix ans, l’absence de FA/AT après plusieurs ablations est d’environ 63%. Il est important de noter que la raison principale de la FA récurrente est la reconnexion électrique de la PV à l’oreillette gauche, même lorsqu’une seule PV présente une reconnexion électrique. Cette reconnexion électrique de la PV se retrouve chez jusqu’à 92% des patients atteints de FA qui sont orientés vers une nouvelle PVI. Dans ces cas, la ré-isolation de la PV peut conduire à un contrôle clinique de la FA chez 81% des patients. Cependant, chez 14% de ces patients, d’autres déclencheurs de FA ne provenant pas des PV ont également été identifiés.
Actuellement, il existe peu de données suggérant d’autres cibles d’ablation empiriques en plus des PV chez les patients atteints de FAP. Il en va de même pour les re-procédures de traitement des PAF au cours desquelles les PV ont été ré-isolées. Cependant, l’élimination supplémentaire de déclencheurs extérieurs à la PV, tels que ceux de la veine cave supérieure, de la paroi postérieure de l’oreillette gauche ou de la crista terminalis, peut parfois améliorer le résultat de l’IVP en cas de PAF.
Fibrillation auriculaire persistante : Plus la FA est persistante, plus les changements structurels (“remodelage”) des oreillettes sont prononcés. Cela conduit à un cercle vicieux : la FA conditionne la FA (“atrial fibrillation begets atrial fibrillation”) [7]. L’excitation électrique chaotique et les contractions non coordonnées des oreillettes entraînent des modifications des propriétés électriques du myocarde auriculaire, une contractilité réduite, une dilatation et une fibrose auriculaire. Cela favorise le maintien de la FA. Alors que l’activité focale des PV joue un rôle décisif dans le déclenchement du PAF, elle passe au second plan en cas de FA persistante. Par conséquent, les taux de réussite publiés de l’IPV en cas de FA persistante sont généralement inférieurs à ceux de la PAF, mais restent nettement meilleurs que ceux d’un traitement purement médicamenteux. De nouvelles stratégies thérapeutiques ont été développées pour améliorer les résultats de l’ablation par cathéter de la FA persistante. Celles-ci sont basées sur de multiples théories sur les mécanismes d’apparition de la FA (persistante). L’une des théories les plus anciennes est l’hypothèse dite des “ondelettes multiples”. Celle-ci stipule que la FA est créée et maintenue par plusieurs ondes d’excitation indépendantes et chaotiques qui se déplacent dans les deux oreillettes. Étant donné que le maintien de la FA nécessite un minimum d’ondes simultanées et une certaine masse critique de tissu auriculaire excitable, diverses techniques chirurgicales ont été développées (par exemple, l’opération de Cox-Maze), qui consistent à pratiquer plusieurs incisions transmurales dans les deux oreillettes afin d’empêcher la réentrée intra-auriculaire. Cette technique a été adaptée des décennies plus tard pour l’ablation endocardique par cathéter de la FA persistante.
Une autre hypothèse concernant l’apparition d’une FA persistante est basée sur ce que l’on appelle les CFAE (électrogrammes auriculaires fractionnés complexes). Les CFAE représentent certaines régions des oreillettes où il y a un retard dans l’excitation électrique (“slow conduction”), ce qui peut entraîner une microréentrée locale. Par conséquent, ces régions se prêtent également à l’ablation par cathéter.
La stratégie d’ablation par étapes (“stepwise ablation approach”) vise non seulement à éliminer les déclencheurs dans les PV, mais aussi à modifier le substrat dans le LA. Dans ce cas, les PV sont d’abord isolés par énergie radiofréquence, puis une ablation CFAE est réalisée. Des lésions linéaires sont ensuite appliquées au toit du LA et au MA jusqu’à ce que le point final de terminaison de la FA ou de transition vers un AT soit atteint et que ce dernier soit déchargé et converti en un rythme sinusal. Il est important de noter que les lacunes dans les lésions linéaires peuvent entraîner un retard dans la conduction de l’excitation dans ces zones et, par conséquent, une réentrée et des AT iatrogènes. C’est pourquoi la détection d’un bloc de conduction électrique le long de la ligne appliquée dans les deux directions (appelé bloc bidirectionnel) est très importante. Dans deux études récemment publiées qui ont suivi cette approche, le taux de liberté de la FA/AT après une procédure et une moyenne de 2,1 procédures était respectivement de 17/20% et 56/63% après un suivi de cinq ans. Les principaux facteurs prédictifs de FA/AT récurrents étaient l’absence de conversion de la FA en rythme sinusal pendant l’ablation, un diamètre auriculaire gauche ≥50 mm, une FA prolongée >18 mois et une cardiopathie structurelle [8].
Notre stratégie pour la FA persistante consiste d’abord à effectuer une PVI circonférentielle “wide-area”. Une modification supplémentaire du substrat n’est effectuée que si le patient ne peut pas être mis en rythme sinusal (même par électrocardioversion). Après un suivi de cinq ans, le taux de réussite de cette stratégie chez les patients présentant une FA de longue durée après une première intervention était de 20%, et de 45% après une médiane de deux interventions. Il est important de noter que les patients présentant une FA persistante <2 ans ont notamment obtenu de bons résultats à long terme.
La plus grande étude multicentrique randomisée sur l’ablation de la FA persistante (STAR AF 2), récemment publiée, a comparé trois stratégies d’ablation. 589 patients sélectionnés pour une première ablation par radiofréquence en raison d’une FA médicamenteuse réfractaire persistante (<3 ans) ont été randomisés dans les bras de traitement suivants : PVI seule (groupe 1) vs. PVI + ablation CFAE (groupe 2) vs. PVI + ablation CFAE + lésions linéaires (groupe 3). Après une période d’observation de 18 mois, aucune différence statistiquement significative n’a été mise en évidence entre les bras de traitement.
Que disent les guidelines ?
Les lignes directrices européennes actuelles sur la FA de 2016 citent l’ablation par cathéter de la FA symptomatique dans des centres expérimentés comme une méthode cliniquement établie, qui doit généralement être réalisée après une tentative infructueuse de traitement par antiarythmiques (recommandation de classe IA pour la FAP et IIa B pour la FA persistante). L’objectif principal est l’IVP, qui peut être obtenue à l’aide d’un courant de radiofréquence ou d’un ballon cryogénique (IIa). B). Chez les patients symptomatiques, principalement ceux atteints de FAP sans cardiopathie structurelle majeure ou de FAP persistante avec suspicion de tachycardiomyopathie, l’ablation par cathéter est également recommandée comme alternative au traitement médicamenteux anti-arythmique en raison des bons taux de réussite et des faibles complications (IIa B). En cas de cardiopathie structurelle, il est noté qu’une ablation plus étendue du LA peut être nécessaire. L’ablation de l’isthme de l’oreillette droite doit être effectuée dans le cadre de l’ablation de la FA si un flutter auriculaire dépendant de l’isthme a été documenté avant ou pendant la procédure (IB). L’ablation par cathéter doit être suivie d’une administration d’héparine et d’un chevauchement d’anticoagulants oraux pendant au moins deux mois (IIa). B). En périprocédure, les nouveaux anticoagulants oraux (NOAC) peuvent également être utilisés. Ensuite, les facteurs de risque d’AVC doivent servir de base à la décision de poursuivre ou non l’anticoagulation (IIa C). La poursuite permanente de l’anticoagulation doit être envisagée chez les patients présentant un ou deux facteurs de risque d’AVC non significatifs et cliniquement pertinents (par ex. B. Score CHA2DS2-VASc ≥2) (IIa B).
La décision de recourir à la chirurgie cardiaque pour traiter des formes plus complexes de FA après plusieurs échecs de traitement interventionnel doit être prise sur recommandation d’une équipe AF-Heart. Une équipe de FA cardiaque doit être composée au minimum d’un électrophysiologiste interventionnel, d’un chirurgien cardiaque expérimenté dans l’ablation chirurgicale de la FA et d’un anesthésiste cardiaque [3].
Développements modernes dans la thérapie interventionnelle
pression de contact (“contact force”) : La re-conduction de la PV après une isolation réussie (reconnexion) est l’un des principaux défis de la PVI. Cela est notamment dû à des lésions insuffisantes pendant la procédure d’indexation. On sait que la pression de contact (“contact force”, CF) exercée par l’extrémité du cathéter sur les tissus à scléroser est très importante pour pouvoir placer des lésions transmurales. Les études initiales qui ont examiné ces nouveaux cathéters avec la possibilité de mesurer la FC et une pointe de cathéter refroidie ont pu démontrer leur sécurité pour l’ablation de la FA. Il a également été démontré que les résultats dépendaient du niveau de la mucoviscidose. Une mucoviscidose moyenne <10 g était significativement plus souvent associée à des arythmies récurrentes, tandis que des résultats supérieurs à la moyenne étaient obtenus avec une mucoviscidose >20 g (le risque de complications augmentait toutefois à >40 g). Lors d’une seconde procédure de diagnostic après une première ablation par cathéter de mucoviscidose, les lésions tissulaires incomplètes étaient inversement corrélées à la mucoviscidose et au produit de la mucoviscidose par la durée de l’ablation (appelée intégrale force-temps, FTI). L’étude EFFICAS I a conduit à une adaptation des recommandations, qui indiquent une CF optimale de 20 g pendant l’ablation et un minimum de 400 gs (FTI) par lésion d’ablation.
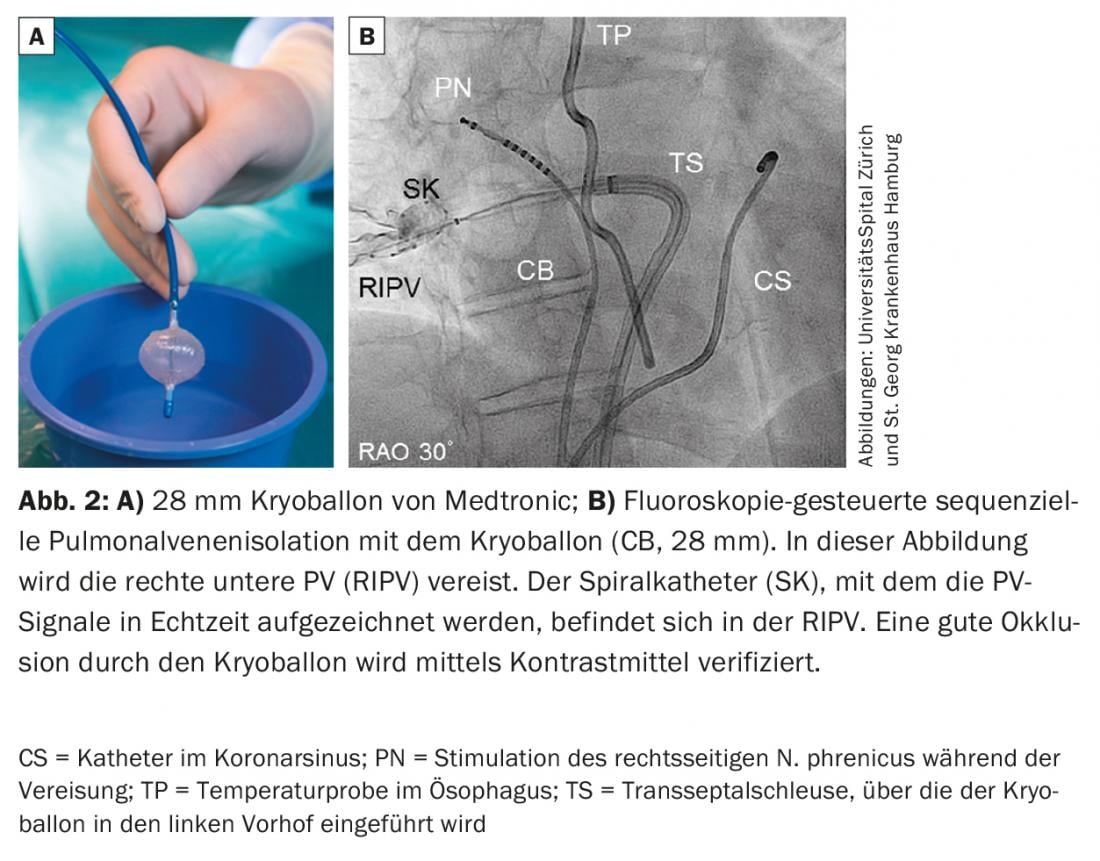
Ballon cryogénique : le ballon cryogénique (Fig. 2) a été introduit en 2006 et s’est avéré être un système sûr et efficace pour l’IVP. L’IVP électrique est obtenue en plaçant le cathéter à ballonnet à l’ostium de chaque PV et en le refroidissant à l’azote liquide jusqu’à -55°C, ce qui gèle les tissus à la jonction entre l’oreillette gauche et la PV (généralement pendant 180-240 s par PV). Le cathéter à ballonnet est introduit dans le LA par une longue gaine orientable. Un cathéter de cartographie circulaire multipolaire est introduit via la lumière du cathéter à ballonnet pour dériver les signaux des PV. Avec l’introduction de la deuxième génération, les résultats à long terme ont été significativement améliorés par rapport à la première génération pour atteindre une liberté de AF/AT de >80% à un an et >70% à deux ans après une procédure d’indexation. Une complication caractéristique du cryoballon est la parésie du nerf phrénique droit. La paralysie phrénique est généralement réversible en moins d’un an, mais elle persiste chez 2,5% des patients. Le taux de parésie phrénique pouvait être réduit si le glaçage était effectué avec une pression de contact réduite, si le cathéter à ballonnet était positionné plus en antral et si le nerf phrénique était stimulé pendant le glaçage de la PV droite afin de détecter à temps les troubles de la motilité et une réduction de l’activité électrique du diaphragme droit. Plusieurs études (y compris la plus grande étude prospective randomisée multicentrique récemment publiée sur l’ablation de la FA [9]) ont montré que l’efficacité et la sécurité du ballon cryogénique pour l’IVP sont équivalentes à celles de la technologie plus ancienne de l’ablation par radiofréquence.
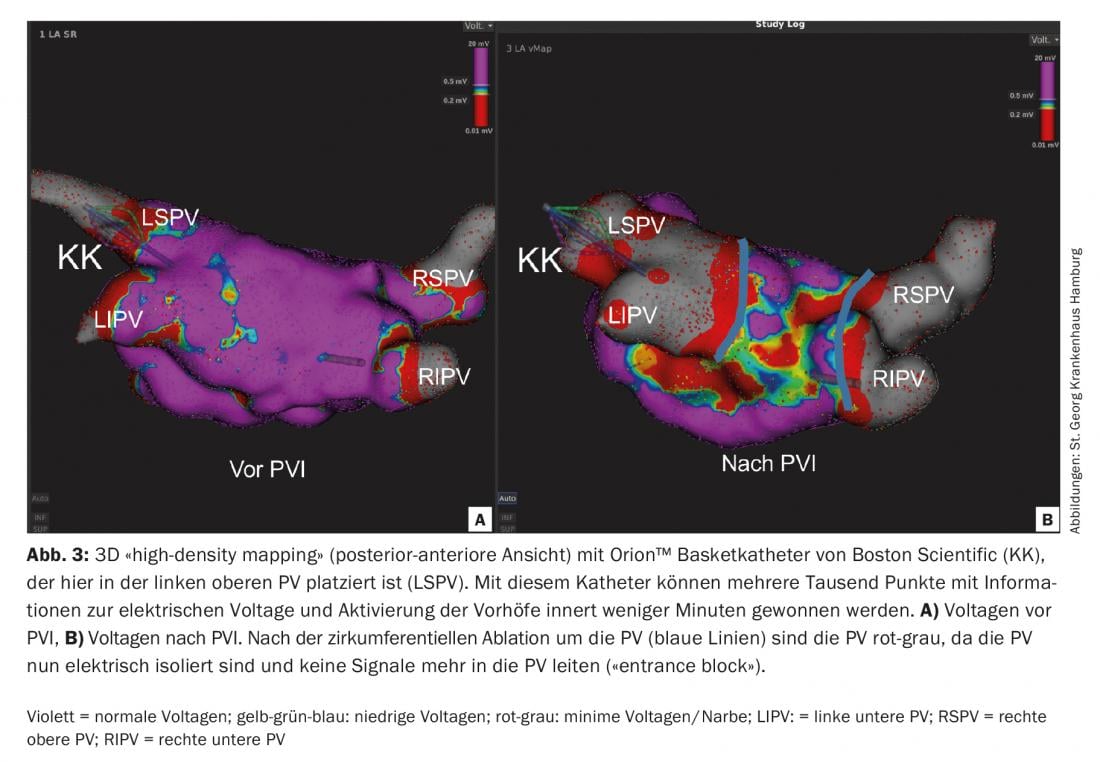
“Cartographie à haute densité” : Grâce à la cartographie dite “haute densité”, il est depuis peu possible, en quelques minutes, d’obtenir des résultats fiables avec des cathéters de diagnostic multipolaires (par ex. Orion™ de Boston Scientific, ou Pentaray® de Biosense Webster) de créer une carte électro-anatomique en 3D des oreillettes avec plusieurs milliers de points sans avoir recours aux rayons X (Fig.3). Ces cartes 3D fournissent des informations très précises sur les potentiels de tension et l’activation électrique du myocarde, ce qui peut s’avérer très utile pour l’ablation des tachycardies auriculaires de réentrée. [10].
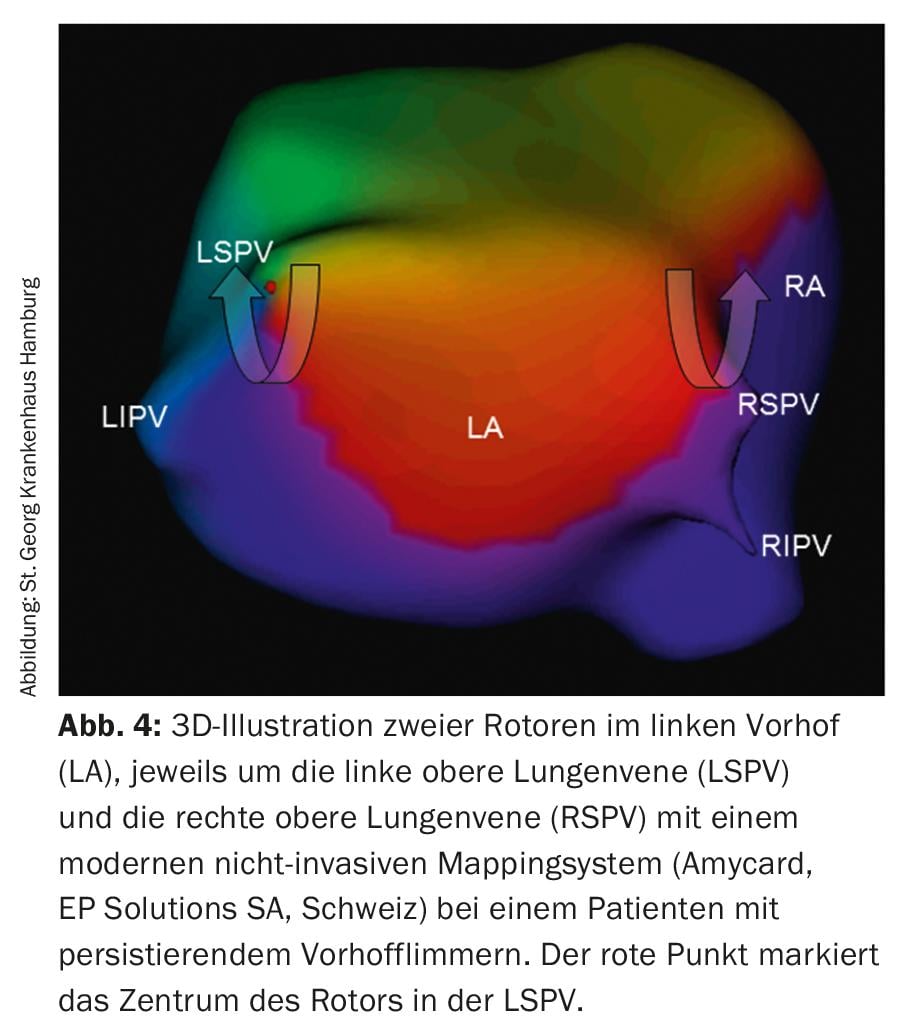
Ablation des rotors : un nouveau concept concernant les causes de la FA persistante est représenté par les rotors (fig. 4) dans les oreillettes, qui initient et maintiennent la FA – comme un ouragan – et peuvent donc également être la cible d’une ablation par cathéter. Actuellement, il existe divers systèmes qui doivent permettre de localiser et de visualiser les rotors. Il faudra toutefois attendre les résultats à long terme de cette nouvelle technologie.
Contrôle des facteurs de risque : l’étude “Aggressive Risk factor REduction STudy for Atrial Fibrillation” (ARREST-AF) a adopté une approche totalement différente pour améliorer le pronostic à long terme après l’ablation de la FA. Dans ce cadre, 149 patients atteints de FA et présentant un indice de masse corporelle d’au moins 27 kg/m2 ainsi qu’au moins un facteur de risque cardiaque supplémentaire ont été mis au repos. 61 ont choisi de participer à une gestion rigoureuse des facteurs de risque sous la supervision de médecins d’une clinique spécialisée, tandis que les 88 autres sujets ont simplement été informés de la gestion rigoureuse des facteurs de risque. Pendant la période de suivi de 3,5 ans, ces mesures ont entraîné une amélioration significative du profil de risque dans le groupe avec gestion des facteurs de risque par rapport au groupe témoin, d’une part, et le succès de l’ablation a duré plus longtemps, d’autre part : 33 vs 10% d’absence d’arythmie après une seule ablation, 87 vs 18% après plusieurs ablations [11].
Messages Take-Home
- La fibrillation auriculaire (FA) est le trouble du rythme cardiaque le plus fréquent dans le monde occidental, avec une prévalence de 1,5 à 2 %, et représente donc une
- important défi clinique et socio-économique.
- Le traitement interventionnel de la FA donne des résultats prometteurs, l’isolation des veines pulmonaires (PVI) jouant un rôle clé.
- L’un des défis du traitement par cathéter de la FA est la création de lésions permanentes transmurales. De nouvelles techniques telles que le ballon de froid (cryoablation) ou les cathéters à capteurs de contact devraient améliorer cette situation.
- Les chances de succès d’une IVP sont particulièrement bonnes en cas de FA paroxystique (PAF) et de FA persistante de courte durée (<3 mois), mais les FA persistantes de plus longue durée peuvent également être traitées avec succès par une ablation par cathéter.
- Des études sont en cours pour déterminer si le traitement interventionnel entraîne une réduction de la mortalité en plus de l’amélioration de la morbidité.
Conflits d’intérêts : Ardan Saguner : Lecture honorarium de Boston Scientific ; Educational grants de Biosense Webster, Biotronik, Boston Scientific, et St. Jude Medical.
Littérature :
- Chugh SS, et al : Épidémiologie mondiale de la fibrillation auriculaire : une étude sur la charge mondiale de la maladie 2010. Circulation 2014 ; 129(8) : 837-847.
- Lloyd-Jones DM, et al : Lifetime risk for development of atrial fibrillation : the Framingham Heart Study. Circulation 2004 ; 110(9) : 1042-1046.
- Kirchhof P, et al : 2016 ESC Guidelines for the management of atrial fibrillation developed in collaboration with EACTS. Eur Heart J 2016 ; 37(38) : 2893-2962.
- Haissaguerre M, et al : Initiation spontanée de la fibrillation auriculaire par des battements ectopiques provenant des veines pulmonaires. N Engl J Med 1998 ; 339(10) : 659-666.
- Saguner AM, et al. : Catheter ablation of atrial fibrillation in very young adults : a 5-year follow-up study. Europace 2016 ; euw378.
- Ouyang F, et al : Résultats à long terme de l’ablation par cathéter dans la fibrillation auriculaire paroxystique : leçons tirées d’un suivi de 5 ans. Circulation 2010 ; 122(23) : 2368-2377.
- Wijffels MC, et al : La fibrillation auriculaire provoque une fibrillation auriculaire. Une étude chez des chèvres endormies et chroniquement instrumentées. Circulation 1995 ; 92(7) : 1954-1968.
- Scherr D, et al. : Five-year outcome of catheter ablation of persistent atrial fibrillation using termination of atrial fibrillation as a procedural endpoint. Circ Arrhythm Electrophysiol 2015 ; 8(1) : 18-24.
- Kuck KH, et al : Cryoballon ou ablation par radiofréquence pour la fibrillation auriculaire paroxystique. N Engl J Med 2016 ; 374(23) : 2235-2245.
- Saguner AM, et al. : Première expérience clinique avec un nouveau système de cartographie électro-anatomique haute résolution pour les procédures d’ablation de l’oreillette gauche. Clin Res Cardiol 2016 ; 105(12) : 992-1002.
- Pathak RK, et al : Étude de réduction du facteur de risque agressif pour la fibrillation auriculaire et implications pour le résultat de l’ablation. Journal of the American College of Cardiology 2014 ; 64(21) : 2222-2231.
CARDIOVASC 2017 ; 16(4) : 24-29