Avec l’utilisation clinique croissante des CAR-T cells, les aspects pratiques de la thérapie sont un sujet de plus en plus important. Quels patients doivent recevoir un traitement par cellules CAR-T en dehors des essais cliniques ? Quelle est la meilleure façon de gérer les effets secondaires ? Et comment maximiser l’efficacité de la thérapie ? Ces questions et d’autres ont été abordées lors d’un débat d’experts au congrès de l’European Hematology Association (EHA) de cette année.
Deux produits CAR-T-Cell sont actuellement autorisés en Suisse, Axicaptagen Ciloleucel et Tisagenlecleucel, et trois sont déjà sur le marché aux États-Unis. La dernière autorisation de mise sur le marché de Lisocaptagen maraleucel a été accordée par la Food and Drug Administration des États-Unis en février 2021. Et les recherches sur d’autres produits se poursuivent activement, les études cliniques battent leur plein. Il n’est donc pas étonnant que diverses questions relatives à la mise en œuvre pratique des thérapies CAR-T cell se posent de plus en plus.
Sélection des patients : un exercice d’équilibriste
Les différentes caractéristiques des patients et des maladies jouent un rôle important dans la sélection des candidates appropriées. La sélection constitue la première étape critique pour la réussite de la thérapie. Il s’agit d’exclure les patients dont les chances de succès sont faibles ou dont le risque de toxicité est trop élevé. Et pourtant, il ne faut priver personne de cette thérapie qui pourrait potentiellement en bénéficier. Par exemple, dans le cas du lymphome diffus à grandes cellules B (DLBCL), même parmi les patients non éligibles à une transplantation, on trouve quelques candidats qui se prêtent à un traitement par cellules CAR-T en troisième ligne de traitement – malgré l’âge généralement plus élevé et le nombre plus important de comorbidités dans ce groupe de patients. Les données actuelles montrent que les résultats chez les patients de plus de 65 ans sont comparables à ceux des patients plus jeunes. Hormis une légère augmentation de la neurotoxicité, aucun effet négatif lié à l’augmentation de l’âge des patients n’a été démontré à ce jour.
Contrairement à l’âge, le statut de performance semble avoir un impact significatif sur les chances de succès du traitement avec des cellules CAR-T. Les chercheurs ont constaté que le statut de performance était plus important que l’âge. Les experts présents au congrès de l’EHA ont été unanimes sur ce point. Étant donné qu’un mauvais statut de performance s’avère de manière constante être une condition défavorable pour le traitement, les cellules CAR-T ne doivent pas être utilisées chez les patients dont le statut ECOG (Eastern Cooperative Oncology Group) est ≥3. Pour la plupart des essais cliniques, la condition préalable est un statut ECOG de 0 à 1. Et même dans le cadre commercial, il existe différentes directives dans différents pays.
Il existe encore beaucoup d’incertitudes quant au rôle des comorbidités dans la sélection des patients. Mais dans l’ensemble, les thérapies CAR-T-cell sont mieux tolérées que les greffes de cellules souches et sont donc moins exigeantes pour les fonctions organiques du cœur, des poumons et des reins. Selon les connaissances actuelles, les comorbidités ne jouent qu’un rôle mineur dans le risque d’effets secondaires. Des maladies secondaires au moins légères à modérées ne posent pas de problème pour un traitement avec des cellules CAR-T et ne devraient pas être considérées comme un critère d’exclusion. Pour certaines patientes qui ne sont pas éligibles à une transplantation en raison de leurs comorbidités, les CAR-T cells représentent donc une nouvelle option potentiellement curative.
Outre les caractéristiques des patientes – en particulier le score de performance – qui doivent être prises en compte dans la sélection de candidates appropriées, différents aspects de la maladie jouent également un rôle dans la sélection des patientes pour les thérapies CAR-T-Cell. En particulier, une activité proliférative élevée, un volume tumoral important, des signes d’un environnement tumoral pro-inflammatoire et une implication du SNC sont considérés comme des facteurs défavorables. (encadré). La réduction de la charge tumorale avant le début du traitement par CAR-T-Cell – ce que l’on appelle le bridging – est à cet égard un sujet important sur lequel nous pouvons probablement attendre des nouvelles à l’avenir.

les effets secondaires : Action ou réaction ?
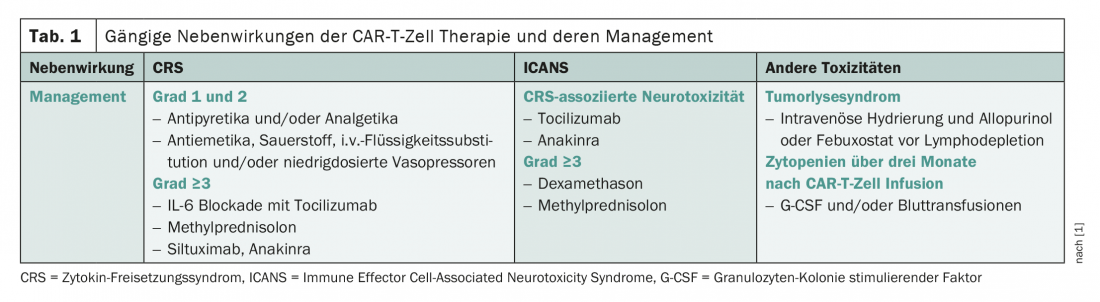
Le spectre des effets secondaires des CAR-T cells se caractérise par le syndrome de libération de cytokines (CRS), une réaction inflammatoire systémique, ainsi que par la neurotoxicité (tableau 1) [1]. Alors que le SRC survient classiquement dans les premiers jours du traitement, les lésions nerveuses surviennent généralement dans les phases ultérieures du traitement. Les complications qui ont été étudiées de manière moins détaillée jusqu’à présent sont par exemple le syndrome de lyse tumorale et les cytopénies. Ces derniers ont été plutôt sous-estimés jusqu’à présent, mais se sont souvent révélés problématiques dans la pratique clinique quotidienne. Le profil des effets secondaires varie quelque peu en fonction du produit .
De même, les patientes ayant une charge tumorale plus importante présentent généralement un risque de toxicité plus élevé. Les lésions nerveuses sont plus fréquentes chez les patients âgés. En connaissant ces facteurs de risque, il est possible de stratifier les risques et donc de prendre des mesures en temps utile. Celles-ci consistent notamment à réserver des places dans l’unité de soins intensifs et à administrer du tocilizumab ou des stéroïdes à titre prophylactique.
La prophylaxie médicamenteuse du SRC et de la neurotoxicité ne fait pas l’unanimité. Ainsi, certaines études montrent que si les effets secondaires peuvent être atténués, l’effet sur le contrôle de la maladie n’est pas négligeable. Ainsi, selon Pere Barba de l’hôpital Vall d’Hebron de Barcelone, chaque cas devrait être évalué individuellement quant à la pertinence d’une prophylaxie. Par exemple, il déconseille la prophylaxie par tocilizumab pour les lisocaptagen maraleucel en raison du faible risque de SRC. Globalement, les toxicités sont aujourd’hui traitées de manière de plus en plus agressive. Alors qu’auparavant, un traitement spécifique n’était généralement administré qu’à partir d’effets indésirables médicamenteux de presque troisième degré, toutes les toxicités sont désormais traitées à partir d’un degré 2, c’est-à-dire d’une ampleur modérée. En cas de CRS, le tocilizumab est particulièrement utilisé, tandis qu’en cas de neurotoxicité, les stéroïdes occupent le rôle principal dans le traitement. L’effet de cette utilisation antérieure de stéroïdes sur l’efficacité de la thérapie CAR-T-cell est un sujet très débattu. En outre, l’augmentation du risque d’infection ne doit pas être négligée. Dans ce contexte de tensions, la meilleure approche, selon Barba, consiste à administrer un traitement agressif au début, mais à arrêter les stéroïdes dès que possible. Malheureusement, certains patients connaissent un nouvel épisode de neurotoxicité pendant le sevrage, appelé “deuxième vague”.
A l’avenir, le produit pourrait être modifié pour améliorer la gestion des effets secondaires ; des études sont en cours à ce sujet. En cas de toxicité grave, les cellules CAR-T pourraient par exemple être “désactivées” au moyen d’anticorps. L’avenir dira si cette approche permet d’éviter des conséquences thérapeutiques graves. Les experts présents au congrès de l’EHA se sont montrés plutôt sceptiques à ce sujet. Le dommage est alors souvent déjà installé et la cascade inflammatoire déclenchée.
Avant la perfusion : optimiser les conditions
Avant de pouvoir perfuser les cellules CAR-T, des étapes importantes sont prévues, à savoir des thérapies de pontage pour réduire la charge tumorale, la leucaphérèse et la lymphodéplétion, qui peuvent avoir un impact considérable sur le succès du traitement. En ce qui concerne la stratégie optimale de contrôle de la maladie avant la thérapie CAR-T-Cell, il existe actuellement une grande incertitude et les données sont insuffisantes. Il semble clair qu’un traitement de pontage est nécessaire pour la plupart des patients, car une charge élevée de la maladie entraîne indiscutablement un moins bon résultat et un risque accru de toxicité. Les experts présents au congrès de l’EHA se sont accordés à dire que la progression de la maladie devait être évitée dans la mesure du possible, même si cela passait par une chimiothérapie à haute dose. Dans une étude rétrospective qui a comparé différentes méthodes de pontage en termes de survie globale et de survie sans progression chez des patients atteints de DLBCL, la radiothérapie a obtenu les meilleurs résultats [2]. Cependant, cette analyse n’a porté que sur une centaine de patients et était de nature rétrospective.
Afin d’assurer la propagation, le maintien et la fonction des cellules CAR-T de la manière la plus efficace possible, les cellules immunitaires cytotoxiques endogènes et les cellules immunosuppressives sont éliminées au cours de la procédure dite de “lymphodéplétion”. Ce processus entraîne notamment la libération de cytokines endogènes qui favorisent la prolifération des lymphocytes T. Les études utilisent généralement une combinaison de fludarabine et de cyclophosphamide, administrée sur trois jours. Il est également possible d’utiliser la bendamustine. La question de savoir si une chimiothérapie lymphodéplétante doit être administrée aux patients qui présentent déjà une lymphopénie, par exemple après une greffe de cellules souches, est un sujet de discussion. Cela devrait se clarifier avec l’utilisation croissante des cellules CAR-T, tout comme la question de savoir si de meilleurs régimes de lymphodéplétion sont possibles.
Pour obtenir des cellules T propres au patient par leucaphérèse, le timing est le facteur décisif. En particulier, le prélèvement doit être effectué à une distance suffisante de la chimiothérapie de pontage. Cela est d’une importance capitale pour la qualité du produit. En règle générale, il faut compter deux semaines d’écart avec la chimiothérapie et trois jours à une semaine d’écart avec l’administration de stéroïdes. Mais ce n’est pas seulement le timing de la phase de prétraitement qui est d’une grande importance pour le succès de la thérapie CAR-T-Cell, mais aussi sa durée totale. Actuellement, il faut environ deux mois entre le premier contact et la perfusion des cellules CAR-T, ce qui est trop long si l’on considère que la maladie progresse pendant ce temps. Une étude récemment publiée montre par exemple que sur 108 patients initialement éligibles pour un traitement par CAR-T-Cell, seuls 52 ont finalement reçu le produit [3]. Bien qu’une tendance à la réduction du temps d’attente soit désormais perceptible, il existe encore une marge de progression. L’augmentation de la demande pose des exigences de plus en plus élevées en termes d’infrastructures et de pipelines, qui doivent encore être mis en place dans de nombreux endroits. Ces exigences ne peuvent être satisfaites que par une collaboration efficace entre les cliniques, les centres et l’industrie.
Source : Expert/Round Table session “How to best help patients succeed with CAR T cell therapies ?” dans le cadre du congrès virtuel de l’EHA, 11.06.2021, Claire Roddie, Londres, Royaume-Uni et Pere Barba, Barcelone, Espagne.
Littérature :
- Yáñez L, Sánchez-Escamilla M, Perales MA : CAR T Cell Toxicity : Current Management and Future Directions. Hémisphère. 2019 ; 3(2) : e186.
- Pinnix CC, et al : Bridging therapy prior to axicabtagene ciloleucel for relapsed/refractory large B-cell lymphoma. Blood Adv. 2020 ; 4(13) : 2871-2883.
- Carpio C, et al. : Processus de sélection et causes de la non-éligibilité au traitement par cellules CAR-T CD19 chez les patients atteints de lymphome non hodgkinien agressif à cellules B en rechute/réfractaire dans un centre européen. Leuk Lymphoma (lymphome leucémique). 2021 : 1-4.
InFo ONKOLOGIE & HÄMATOLOGIE 2021 ; 9(4) : 26-27 (publié le 20.9.21, ahead of print)