Le traitement de la polyarthrite rhumatoïde (PR) a fait de grands progrès au cours des 20 dernières années. La plupart des pays européens ont mis en place des programmes de recherche et de développement dans le domaine de l’immunothérapie et de la chimiothérapie, tant en ce qui concerne l’éventail des médicaments disponibles que l’évolution de la rapidité d’action et des taux de réponse. Des études cliniques de phase III ont été publiées en 2019, en particulier sur les inhibiteurs JAK, et leurs résultats ont été présentés lors du Rheuma-Update à Wiesbaden.
Les recommandations de mise à jour 2019 de la European League Against Rheumatism (EULAR) ne présentent que peu de différences par rapport aux éditions précédentes. La recommandation d’utiliser au maximum un deuxième bloqueur de TNF en cas d’échec du traitement par le premier bloqueur de TNF est pertinente. Les inhibiteurs JAK continuent d’être positionnés sur les csDMARD ou les produits biologiques après un échec thérapeutique. Andrea Rubbert-Roth, Clinique de rhumatologie, Hôpital cantonal de Saint-Gall. Toutefois, aucune donnée n’est disponible à ce sujet. La récente approbation de l’upadacitinib et bientôt du filgotinib soulève la question d’une stratégie de transition optimale pour les inhibiteurs JAK.
Quatre inhibiteurs de JAK disponibles pour la PR
L’année dernière, le peficitinib a reçu une autorisation de mise sur le marché au Japon. Il existe donc actuellement quatre inhibiteurs de JAK autorisés pour le traitement de la PR, même si le peficitinib n’est pas encore autorisé aux États-Unis ou en Europe. L’experte s’est surtout penchée sur la question des différences spécifiques aux substances en termes d’efficacité et de profil de sécurité. Compte tenu de la difficulté d’utilisation (nécessité de refroidir, administration parentérale), force est de constater que les médicaments biologiques ne représentent pas la forme de traitement optimale pour tous les patients, d’autant plus que seule une minorité obtient une rémission clinique continue. En revanche, la douleur, les limitations fonctionnelles, la fatigue et la dépressivité représentent une charge de morbidité importante pour les personnes concernées.
Les études se concentrent sur la sélectivité des inhibiteurs de JAK, c’est-à-dire sur l’inhibition des différentes isoformes à une concentration intracellulaire donnée. Le rapport optimal entre l’efficacité et les effets secondaires, tels que l’anémie, est ainsi recherché. Le programme d’études cliniques de phase III pour le tofacitinib et le baricitinib est terminé, tandis que pour l’upadacinitib, il faut attendre les résultats d’une étude en tête de liste avec l’abatacept chez des patients atteints de PR qui n’ont pas suffisamment répondu à un traitement biologique antérieur.
Tofacitinib
En ce qui concerne le tofacitinib, il n’y a pas beaucoup de nouveautés en termes d’efficacité, car il est disponible depuis de nombreuses années aux États-Unis et est bien connu. En Suisse, le tofacitinib est également autorisé depuis 2013. Une nouvelle analyse post-hoc concernant les patients séropositifs et séronégatifs a montré une réponse comparable dans les deux groupes. Les taux de rémission de DAS28 étaient légèrement inférieurs à ceux des patients atteints de CCP.
Dans l’analyse, les données de cinq études de phase III ont été regroupées et des sous-groupes ont été définis sur la base de la sérologie : RF+CCP+, RF+CCP-, RF-CCP+ et RF-CCP-. Au final, les patients atteints de RF+CCP+ étaient plus susceptibles d’obtenir une réponse ACR-20, -50 ou -70 que les patients atteints de RF-CCP. Ce résultat a été démontré pour les réponses ACR-20 et -50 à la fois pour le tofacitinib 5 mg deux fois par jour et pour le tofacitinib 10 mg deux fois par jour. En revanche, la réponse à l’ACR-70 n’était meilleure qu’avec la dose la plus élevée [1].
Une autre étude a porté sur le risque d’événements cardiovasculaires sous tofacitinib. L’évaluation d’une étude de phase IV récente comparant le tofacitinib aux bloqueurs du TNF (adalimumab, étanercept) chez des patients de plus de 50 ans présentant au moins un facteur de risque supplémentaire d’événements cardiovasculaires a montré que le risque d’événements thromboemboliques associé au tofacitinib doit être considéré comme accru.
Le risque d’embolie pulmonaire était nettement plus élevé sous tofacitinib à la dose de 10 mg et également plus élevé sous 5 mg deux fois par jour que dans les études précédentes. De même, la mortalité globale était plus élevée sous 10 mg deux fois par jour que sous 5 mg deux fois par jour. En conséquence, l’EMA a émis une recommandation selon laquelle le tofacitinib ne devrait pas être utilisé chez les patients présentant un risque thromboembolique élevé. Les patients atteints de PR âgés de plus de 65 ans ne doivent être traités par tofacitinib que s’il n’existe pas d’alternative thérapeutique. Le professeur Rubbert-Roth a commenté qu’elle trouvait “inhabituelle” la recommandation de l’EMA basée sur une étude qui n’a pas encore été présentée et discutée scientifiquement et qu’elle espérait que cela se produirait bientôt.
Baricitinib
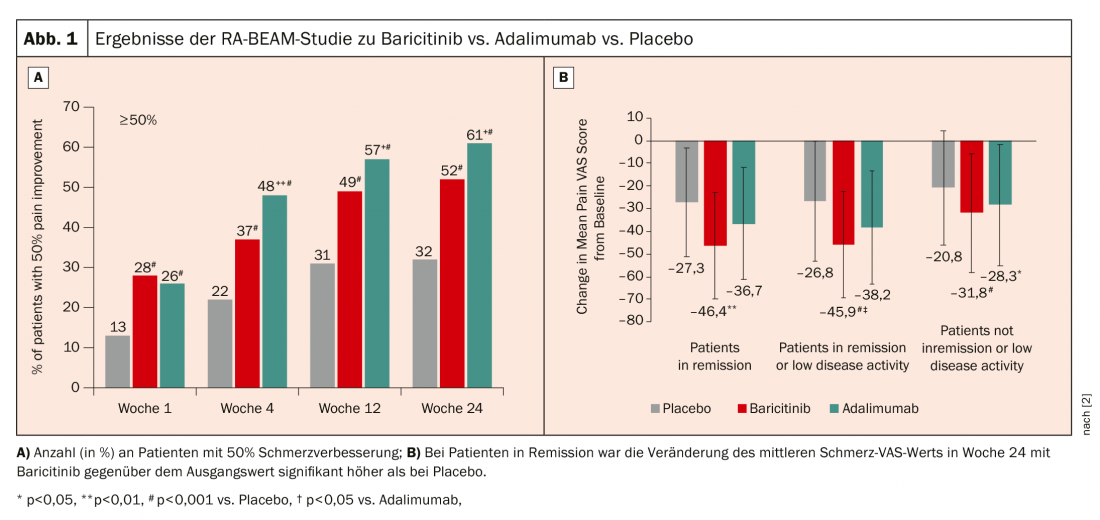
Le baricitinib est autorisé en Suisse depuis 2017 à la dose de 4 mg (2 mg chez les patients âgés ou en cas d’insuffisance rénale). L’étude RA-BEAM a comparé le baricitinib 4 mg + MTX à l’adalimumab + MTX et au placebo + MTX [2]. Ici, il s’est avéré que l’amélioration de 50% de la douleur est meilleure sous baricitinib (Fig.1A). Si l’on ne considère que les patients en rémission ou en faible activité, le baricitinib a un effet significatif sur la douleur. (Fig.1B). La rhumatologue ne peut que spéculer sur les raisons de ce phénomène : “Il est possible que les récepteurs de la douleur utilisent également les JAK pour leur signalisation, ce qui leur confère des effets spécifiques sur la douleur”. L’effet positif a également été observé lors du passage de l’adalimumab au baricitinib après une semaine. 16 déterminer.
En ce qui concerne la réponse vaccinale sous baricitinib, le PCV13 et le tétanos toxoïde (TT) ont été testés. 106 patients de l’étude RA-BEYOND recevant 2 mg ou 4 mg de baricitinib (avec ou sans MTX) ont été vaccinés contre le PCV13 et le tétanos. Au total, 68% des patients ont présenté une réponse vaccinale suffisante contre le pneumocoque et 43% ont obtenu une augmentation de plus de 4 fois des titres vaccinaux contre le tétanos. Une augmentation de plus de 2 fois après le PCV13 a été atteinte par 74 % des patients [3].
Upadacitinib
Selon le professeur Rubbert-Roth, l’une des études les plus importantes de l’année dernière est SELECT-COMPARE, qui a comparé upadacitinib vs adalimumab vs placebo chez des patients MTX-IR souffrant de PR active [4]. Dans cette étude, il était possible de passer de l’upadacitinib à l’adalimumab et vice versa (aux semaines 14, 18, 22 et 26) en cas d’amélioration de moins de 20% des articulations douloureuses et gonflées (critères d’évaluation coprimaires ACR20 et DAS28-CRP <2,6) après les semaines 12.
L’étude menée sur 1629 patients atteints de PR active malgré le MTX a montré que l’upadacitinib (autorisé en Suisse depuis le printemps 2020) est statistiquement plus efficace que l’adalimumab : 71% des patients ont obtenu une réponse ACR20 sous upadacitinib, contre seulement 63% sous adalimumab et 36% sous placebo. 29% des patients ont obtenu une rémission selon le DAS28-CRP, contre seulement 18% sous adalimumab et 6% sous placebo. Parmi les effets secondaires, le zona et l’augmentation des CK étaient plus fréquents avec l’upadacitinib, et des thromboembolies veineuses (TEV) sont survenues chez 3 patients sous adalimumab contre 2 patients sous upadacitinib. En regardant les non-répondeurs, on a pu voir que 13% ont atteint la rémission en passant de l’upadacitinib à l’adalimumab, tandis qu’inversement, le passage de l’adalimumab à l’upadacitinib a donné les résultats escomptés chez 26%.
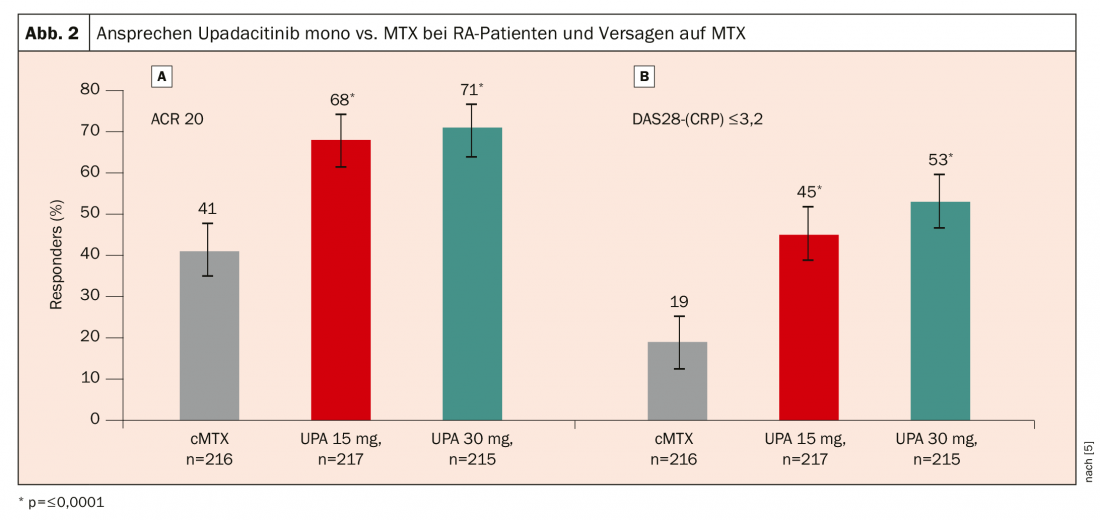
Dans l’étude SELECT-MONOTHERAPY, 648 patients atteints de PR active malgré le MTX ont été randomisés pour poursuivre soit le traitement par MTX, soit l’upadacitinib 15 mg ou 30 mg en monothérapie [5]. Là encore, l’upadacitinib a permis d’obtenir une réponse significativement meilleure : après 14 semaines, 68% des patients sous upadacitinib 15 mg et 71% sous upadacitinib 30 mg ont obtenu une réponse ACR20, contre 41% seulement des patients ayant poursuivi le traitement par MTX (figure 2).
Filgotinib et peficitinib
Le filgotinib est considéré comme un inhibiteur sélectif de JAK1, le programme d’études de phase III FINCH1, -2 et -3 a été publié ou présenté lors des congrès internationaux en 2019. FINCH2 a évalué pendant 24 semaines l’efficacité et la sécurité du filgotinib (100 mg ou 200 mg par jour) par rapport à un placebo chez 449 patients atteints de PR active malgré un traitement stable par csDMARD et un échec antérieur du traitement ou une intolérance sous traitement biologique (bDMARD) [6]. 23,4% des patients avaient reçu au moins trois bDMARD antérieurs, le critère d’évaluation principal étant l’obtention d’une réponse ACR20 à 12 semaines. Le résultat ici : 66% ont atteint le critère d’évaluation primaire sous filgotinib 200 mg, 57,5% sous filgotinib 100 mg et 31,1% des patients sous placebo. Chez les patients en échec thérapeutique à au moins trois bDMARD, la réponse ACR20 a été de 70,3% sous 200 mg de filgotinib, de 58,8% sous 100 mg et de 17,6% sous placebo. “Il s’agira certainement aussi d’une substance qui fera bientôt l’objet d’une autorisation de mise sur le marché”, a évalué le professeur Rubbert-Roth à propos de ces chiffres.
En revanche, l’experte ne semble pas aussi convaincue par le peficitinib, qui sera autorisé au Japon en 2019. Elle a simplement fait référence à une étude dans laquelle l’inhibiteur Pan-JAK a été considéré par rapport à un placebo pendant 52 semaines chez des patients atteints de PR active malgré des DMARD conventionnels, mais sans enregistrement de la progression radiographique. 507 patients ont été randomisés. Le peficitinib a permis d’obtenir une réponse ACR20 à 12 semaines de 57,7% sous peficitinib 100 mg et de 74,5% sous peficitinib 150 mg contre 30,7% sous placebo (p<0,001). Cependant, un bras comparatif ouvert avec l’étanercept a montré que ce dernier avait systématiquement obtenu de meilleurs résultats que le peficitinib, avec une réponse ACR20 de 83,5%.
Source : Rheuma-Update, Wiesbaden (D)
Littérature :
- Bird P, Hall S, Nask P, et al. : RMD open 2019 ; 5 : e000742 ; doi:10.1136/rmdopen-2018-000742. (Epub ahead of print)
- Fautrel B, Kirkham B, Pope JE, et al : J Clin Med 2019 ; 8 : 1394-408.
- Winthrop K, Bingham CO, Komocsar WJ, et al : Arthritis Res Ther 2019 ; 21 : 102-112.
- Fleischmann R, Pangan AL, Song ICH, et al : Arthritis Rheumatol 2019 ; 71 (11) : 1788-1800.
- Smolen JS, Pangan AL, Emery P, et al : Lancet 2019 ; 393 : 2303-2311.
- Genovese MC, Kalunian K, Gottenberg JE, et al : JAMA 2019 ; 322 (4) : 315-325.
InFo DOULEUR & GERIATRIE 2020 ; 2(1) : 32-35 (publié le 5.7.20, ahead of print)