Les essais cliniques interventionnels peuvent être classés en phase I, II et III. Jusqu’ici, tout va bien. Mais qu’est-ce que cela signifie exactement ? Voici un bref rappel pour tous ceux qui ne travaillent pas directement dans la recherche clinique et dont les études remontent à un certain temps.
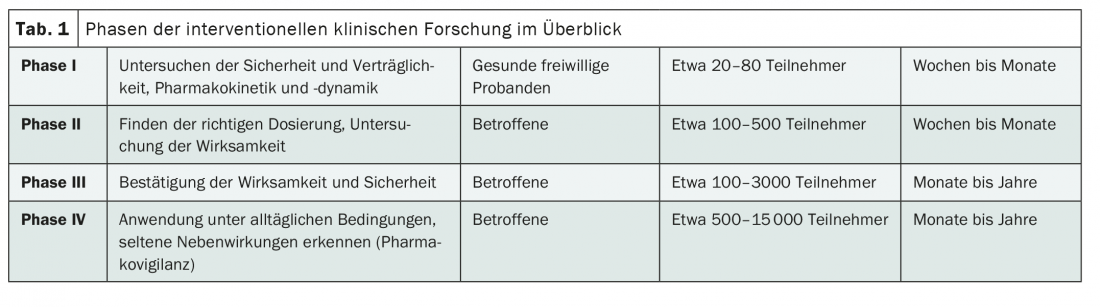
Chaque étude d’intervention – c’est-à-dire toute étude dans laquelle les participants reçoivent une forme active de traitement – peut être attribuée à une phase spécifique du développement de l’intervention testée, par exemple le médicament testé. (Tab.1). Il s’agit notamment de protéger les participants à l’étude contre d’éventuels effets indésirables et de permettre une caractérisation aussi précise que possible de l’intervention sur différents sujets. Cela n’a d’ailleurs rien à voir avec une randomisation, toutes les études de phase III ne sont pas automatiquement des essais randomisés contrôlés.
Pas à pas de I à III
Classiquement, les essais précliniques d’une intervention – comme son nom l’indique – sont suivis d’une étude de phase I. Les résultats de cette étude sont présentés dans le tableau ci-dessous. L’intervention ou le médicament est testé pour la première fois chez l’homme. L’examen de la compatibilité est au cœur de cette démarche [1]. La plupart du temps, une étude de phase I implique quelques dizaines de sujets sains. La pharmacocinétique et la pharmacodynamie à différentes doses sont étudiées en détail. Il s’agit ainsi de recueillir les premières informations sur les effets secondaires chez l’homme et les doses appropriées [1].
Ce n’est que dans un deuxième temps que l’on s’intéresse à l’efficacité. Il s’agit de la première fois que des personnes malades sont impliquées, ce qui rend indispensable la collaboration des entreprises pharmaceutiques et des organisations de recherche clinique avec les hôpitaux. La plupart du temps, environ 100 à 500 patients sont inclus – avec ou sans groupe de contrôle, en aveugle ou non [1].
Dans des études cliniques beaucoup plus importantes, les études de phase III, l’intervention est ensuite idéalement testée sur plusieurs milliers de patients. Il s’agit de vérifier si l’efficacité et la tolérance peuvent être reproduites dans une grande population d’étude. Les analyses de sous-groupes sont également importantes, car elles permettent d’identifier les patients qui bénéficient le plus de l’intervention et ceux qui en bénéficient le moins. Souvent, les études de phase III sont des études comparatives avec des thérapies existantes et/ou un placebo [1]. Ce sont également les plus parlantes. Plus le développement d’une intervention est avancé et plus l’étude est grande, plus il est important de bien planifier en amont. Les critères d’évaluation doivent être déterminés et l’analyse statistique doit être aussi précise que possible. En effet, il n’est généralement pas possible, par exemple, de rattraper une collecte de données auprès de plus de 1000 patients.
En fonction de l’intervention et de la maladie, il est parfois difficile de mener des études de phase III. C’est notamment le cas pour des maladies très rares. Il existe également des cas où les études randomisées contrôlées de phase III sont difficilement justifiables d’un point de vue éthique – par exemple, lorsqu’une efficacité clinique élevée est déjà visible dans la deuxième phase . En raison de ce problème, les médicaments sont régulièrement autorisés avant la fin des études de phase III correspondantes, un sujet brûlant actuellement en oncologie. Souvent, c’est l’inclusion dans un essai clinique qui permet d’accéder à un médicament (non approuvé). Cela peut sauver des vies, mais c’est aussi une loterie – et une raison de référer les patients concernés à des centres spécialisés qui participent à des essais cliniques. Dans l’ensemble, le chemin entre l’étude de phase I et l’autorisation de mise sur le marché est long, avec une maigre chance de succès d’à peine 10%. Et celle-ci est divisée par deux pour le développement de médicaments anticancéreux, à 5,1%. La plupart des études sont interrompues en phase II [2].
À ne pas oublier : Phase 0 et IV
Même si les phases I à III sont généralement au premier plan du développement clinique, les études de phase 0 et IV jouent également un rôle important dans l’innovation médicale. Alors que les études de phase 0 concernent l’examen de matériel humain, les études de phase IV ont lieu après l’autorisation de mise sur le marché. Ces derniers sont par conséquent limités aux indications, dosages et formes d’administration autorisés. La taille de la population permet notamment de détecter les effets secondaires rares [3].
Littérature :
- Phase clinique. www.interpharma.ch/themen/fuhrend-in-forschung-entwicklung/der-weg-eines-medikaments/klinische-phase-phase-i-ii-iii (dernier accès le 21.11.2021).
- Thomas DW, et al.: Clinical Development Success Rates 2006-2015. www.bio.org/sites/default/files/legacy/bioorg/docs/Clinical%20Development%20Success%20Rates%202006-2015%20-%20BIO,%20Biomedtracker,%20Amplion%202016.pdf (letzter Zugriff am 21.11.2021).
- Phases d’études. www.dimdi.de/dynamic/de/glossar/glossareintrag/Studienphasen (dernier accès le 21.11.2021).
- Quels sont les différents types d’essais cliniques ? www.viomedo.de/posts/welche-arten-von-klinischen-studien-gibt-es (dernier accès le 21.11.2021).
InFo ONKOLOGIE & HÉMATOLOGIE 2021 ; 9(6) : 42











