Le cancer de la prostate est le cancer le plus fréquent chez l’homme. Tous les cancers de la prostate ne se valent pas (mot-clé : stratification du risque). Tous les cancers de la prostate ne doivent pas être traités (mot-clé : surtraitement). Pour le traitement du cancer de la prostate localisé, différentes options de traitement curatif sont disponibles en fonction du profil de risque.
En Suisse, environ 6100 hommes sont confrontés chaque année à un diagnostic de cancer de la prostate. Le cancer de la prostate est donc le type de cancer le plus fréquent. Dans la plupart des cas, il s’agit initialement d’un stade tumoral localisé ou limité à un organe. L’urologue traitant dispose dans ce cas d’un grand nombre d’options thérapeutiques. Celles-ci vont de la surveillance active (“active surveillance”) à la prostatectomie radicale.
Avant de prendre une décision pour ou contre une forme de traitement, l’état général, l’espérance de vie et les caractéristiques de la tumeur (stratification du risque) doivent être évalués pour chaque patient. L’espérance de vie joue un rôle plus important que l’âge biologique dans la prise en compte des modalités de traitement. Lorsque le patient est âgé ou que son espérance de vie est réduite, les comorbidités du patient réduisent le risque de mourir du cancer de la prostate : Les patients meurent donc avec le cancer de la prostate, mais pas du cancer de la prostate.
Stratification des risques
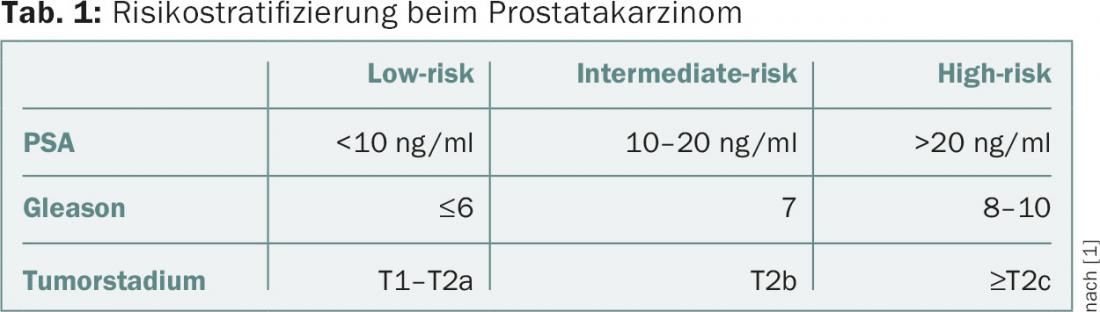
La stratification du risque de cancer de la prostate est basée sur le taux de PSA, le score bioptique de Gleason et le stade clinique. Une classification courante est celle de D’Amico et al. [1]. Ici, les patients atteints d’un cancer de la prostate localisé sont classés en trois groupes de risque (tableau 1).
Surveillance active
Le déséquilibre entre l’incidence et la mortalité du cancer localisé de la prostate indique que certains patients ne bénéficient pas d’un traitement (surtraitement). Les hommes qui ne souhaitent pas être traités immédiatement peuvent opter pour une surveillance active (AS) en présence d’une tumeur à faible risque [2]. Dans ce cas, le statut local et le taux de PSA sont contrôlés en fonction de l’évolution et des rebiopsies sont effectuées selon un schéma. La SA a deux objectifs : Premièrement, les hommes atteints d’un cancer de la prostate localisé ne doivent pas bénéficier d’un traitement curatif immédiat, mais d’un traitement précoce en cas de progression. Deuxièmement, il s’agit de réduire les risques de complications induites par le traitement (p. ex. dysfonctionnement érectile, incontinence) chez les hommes atteints de cancers à faible risque.
Si les patients sont bien sélectionnés, les résultats sont prometteurs. La survie globale des patients à long terme est la même que celle des patients qui ont reçu directement un traitement curatif. Environ 25% des patients sous SA sont soumis à un traitement curatif au cours de la période de suivi. Les arguments en défaveur du concept de SA sont la charge mentale parfois élevée des patients et l’aggravation possible du pronostic en cas de traitement retardé. Ainsi, il existe des données indiquant que les patients qui ont attendu plus de 180 jours avant d’être traités après un diagnostic de cancer de la prostate présentaient un risque de récidive postopératoire 2,7 fois plus élevé que les patients ayant subi une prostatectomie radicale dans les trois premiers mois [3].
La SA a sans aucun doute une place dans le traitement du cancer de la prostate localisé, mais il manque encore actuellement des prédicteurs fiables pour évaluer le pronostic avec certitude. Les patients doivent donc être informés et éduqués sur les avantages et les inconvénients respectifs de la SA.
Curiethérapie à faible dose
La curiethérapie à faible débit de dose (LDR) consiste à insérer des grains de métal radioactif dans la prostate par le biais du périnée à l’aide d’aiguilles creuses sous contrôle échographique. Les grains restent dans la prostate et y délivrent la dose radioactive nécessaire. L’intervention se déroule sous anesthésie et dure environ deux heures et demie à trois heures, y compris toutes les préparations, avec une durée d’hospitalisation généralement d’une seule nuit après l’opération.
La sélection des patients est d’une grande importance pour la curiethérapie. En raison de l’hétérogénéité des données, la curiethérapie LDR n’est une option thérapeutique que pour les patients présentant un carcinome à faible risque (c’est-à-dire les patients qui sont également éligibles pour une AS), une taille de prostate <50 cm3 et sans troubles mictionnels pertinents (IPSS ≤12). La survie sans maladie à cinq ans est de 71-93% et de 65-85% à dix ans [4]. Il n’existe à ce jour aucune étude randomisée comparant la curiethérapie à un autre traitement curatif du cancer localisé de la prostate.
Radiothérapie externe
La radiothérapie externe percutanée (“external beam radiation therapy”, EBRT) est une alternative thérapeutique en cas de cancer de la prostate limité à un organe. Dans des comparaisons rétrospectives, l’EBRT donne des résultats oncologiques comparables à ceux de la prostatectomie radicale pour les tumeurs bien différenciées, tandis que la prostatectomie radicale présente des avantages pour les tumeurs mal différenciées. L’EBRT est une radiothérapie individuelle guidée par l’image (CT, IRM, PET-CT) au moyen de photons, avec une utilisation optimale de l’organe cible tout en préservant au maximum les organes à risque environnants. La durée de l’EBRT est de plusieurs semaines (par exemple, 78 Gy de dose totale pour des doses uniques de 2 Gy = 39 fractions = huit semaines de thérapie).
En fonction du groupe de risque selon D’Amico et al. les patients atteints d’EBRT reçoivent soit un traitement de déprivation androgénique (ADT) néoadjuvant, concomitant ou adjuvant. Par conséquent, en raison de l’hormono-dépendance du cancer de la prostate, les résultats de l’EBRT sont difficilement comparables à ceux d’autres modalités de traitement curatif. En cas de récidive après une EBRT primaire, celle-ci peut en principe être traitée et guérie par une prostatectomie radicale de sauvetage, mais l’intervention est associée à un risque nettement plus élevé de complications graves (incontinence dans 56% des cas, dysfonction érectile dans 81% des cas) [5]. Il n’est pas clair si des seconds cancers surviennent après l’EBRT et, le cas échéant, à quelle fréquence.
Prostatectomie radicale
La prostatectomie radicale (PR) consiste à retirer la totalité de la prostate, y compris les vésicules séminales et les ampoules des vaisseaux déférents. Dans les centres de traitement, l’intervention est aujourd’hui réalisée de préférence de manière peu invasive par robot (RARP) avec le système da Vinci. Des études récentes font état d’une morbidité périopératoire moindre et d’une meilleure fonction érectile postopératoire avec le système da Vinci par rapport à la technique ouverte [6,7]. En revanche, les premières observations à long terme, avec un suivi de dix ans, indiquent une efficacité oncologique équivalente entre la chirurgie robotique assistée et la chirurgie ouverte [8].
En fonction des caractéristiques de la tumeur et de la fonction sexuelle du patient, la RP est réalisée soit en préservant les nerfs (pour préserver la fonction érectile), soit en ne préservant pas les nerfs. En fonction du profil de risque, une lymphadénectomie pelvienne est réalisée en même temps que la RP. Parmi les différentes méthodes curatives de traitement du cancer de la prostate localisé, la RP est la seule pour laquelle il existe un niveau de preuve I en termes de contrôle de la tumeur. Un autre avantage potentiel de la RP par rapport à l’EBRT réside dans le fait qu’en cas de récidive après une RP, une proportion substantielle de patients peut être guérie par une radiothérapie additive (appelée radiothérapie de sauvetage) avec une morbidité acceptable (incontinence chez 13%, dysfonction érectile chez 61%) [5].
Autres traitements
En plus des modalités de traitement établies décrites précédemment, il existe une multitude d’autres formes de traitement. Il s’agit notamment de la cryothérapie, de l’échographie focalisée de haute intensité (HIFU), de la curiethérapie interstitielle de la prostate à haute dose et des thérapies combinées (par exemple, EBRT et curiethérapie interstitielle de la prostate). Une évaluation scientifique de ces procédures n’a pas encore été réalisée et ne permet donc pas de formuler des recommandations claires.
Conclusion
Les hommes chez qui un cancer de la prostate localisé vient d’être diagnostiqué et dont l’espérance de vie est élevée peuvent aujourd’hui se voir proposer toutes les méthodes établies (EBRT, RP, curiethérapie prostatique LDR ou AS) en fonction de leur profil de risque. Le choix de la procédure optimale pour chaque patient est un défi et nécessite une coopération étroite entre toutes les disciplines concernées. Le meilleur moyen d’y parvenir est d’organiser un tumor board interdisciplinaire.
Littérature :
- D’Amico AV, et al : Biochemical outcome after radical prostatectomy, external beam radiation therapy, or interstitial radiation therapy for clinically localized prostate cancer. JAMA 1998 ; 280(11) : 969-974.
- Klotz L : Active surveillance : patient selection. Curr Opin Urol 2013 ; 23(3) : 239-244.
- Lellig K, et al. : [Active surveillance of low risk prostate cancer]. Urologue A 2014 ; 53(7) : 1031-1039.
- Mottet N, et al : Guidelines on prostate cancer. Association européenne d’urologie. Guidelines on prostate cancer. Association européenne d’urologie 2015.
- van der Poel HG, et al : Traitement séquentiel pour les cancers de la prostate localisés récurrents. Journal of Surgical Oncology 2008 ; 97(5) : 377-382.
- Ficarra V, et al : Systematic review and meta-analysis of studies reporting urinary continence recovery after robot-assisted radical prostatectomy. Eur Urol 2012 ; 62(3) : 405-417.
- Haglind E, et al. : Incontinence urinaire et dysfonction érectile après prostatectomie robotique versus radicale ouverte : un essai prospectif, contrôlé, non randomisé. Eur Urol 2015 ; 68(2) : 216-225.
- Diaz M, et al : Résultats oncologiques à 10 ans après une prostatectomie radicale robotisée. Eur Urol 2015 ; 67(6) : 1168-1176.
InFo ONKOLOGIE & HÄMATOLOGIE 2015 ; 3(11-12) : 8-10