L’incidence du cancer blanc de la peau est trois à cinq fois plus élevée chez les personnes infectées par le VIH. Les carcinomes épidermoïdes et basocellulaires apparaissent à un âge plus jeune chez les personnes infectées par le VIH, entraînent plus de récidives et sont plus souvent mortels. Le mélanome a également une incidence légèrement plus élevée chez les personnes infectées par le VIH. En outre, le pronostic est nettement moins bon que celui de la population normale. Alors que les sarcomes de Kaposi, les lymphomes non hodgkiniens et les cancers du col de l’utérus sont nettement moins fréquents sous HAART, l’incidence de la plupart des cancers non liés au SIDA a augmenté. Outre le cancer du foie, ce sont surtout le lymphome de Hodgkin et le carcinome anal qui enregistrent une forte augmentation sous HAART. Le cancer blanc de la peau et le mélanome présentent également une augmentation, bien que plus faible. L’une des raisons pour lesquelles de nombreuses tumeurs augmentent au lieu de diminuer au cours de la HAART pourrait être que les patients VIH sont souvent diagnostiqués jeunes, vivent plus longtemps avec la HAART et “grandissent” dans le groupe à risque plus élevé de tumeurs.
On sait depuis longtemps que les patients immunodéprimés, en particulier les patients ayant subi une transplantation d’organe, sont beaucoup plus susceptibles de développer un cancer de la peau que les personnes immunocompétentes. Ainsi, dans cette population, le carcinome spinocellulaire est 65 fois plus fréquent, le carcinome basocellulaire 10 fois et le mélanome 3 fois. Le risque de cancer de la peau est également plus élevé chez les personnes infectées par le VIH, même si ce n’est pas dans la même mesure.
Il est intéressant de voir comment l’incidence des différents types de cancer a changé avec la HAART (“highly active antiretroviral therapy”). Depuis l’introduction des HAART, les patients séropositifs ont un bien meilleur pronostic de survie qu’auparavant. De même, les maladies définissant le SIDA ont massivement diminué, de sorte que nous les voyons beaucoup moins dans la pratique quotidienne. Les tumeurs malignes (“AIDS-defining cancers”, ADC) font également partie des maladies définissant le SIDA. Il s’agit notamment du sarcome de Kaposi, du cancer du col de l’utérus et du lymphome non hodgkinien (tableau 1).

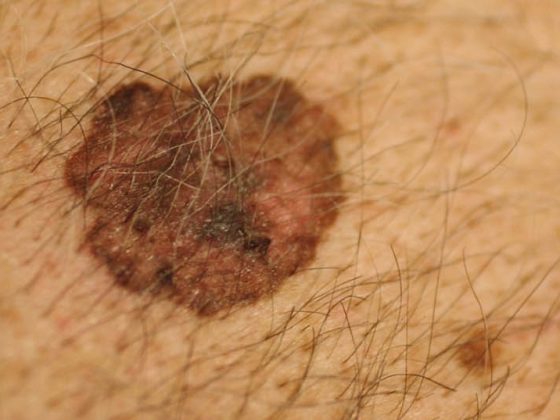
Cependant, toute une série d’autres tumeurs ont été décrites comme étant plus fréquentes chez les personnes infectées par le VIH, les tumeurs dites “non-AIDS-defining cancers” (“non-AIDS-defining cancers”, NADC) (tableau 2). Le cancer blanc de la peau (“non melanoma skin cancer”, NMSC) en fait également partie. Nous entendons par là le carcinome épidermoïde de la peau (carcinome spinocellulaire, carcinome à cellules fusiformes) et le carcinome basocellulaire (carcinome basocellulaire). Le M. Bowen (épiderme entier) et les kératoses actiniques (couche de cellules basales uniquement) sont appelés carcinomes in situ. Les autres tumeurs malignes cutanées sont le très rare carcinome à cellules de Merkel et le mélanome.

Ce rapport se concentre sur la fréquence et l’évolution des cancers définis par le SIDA et des cancers non définis par le SIDA avant et après l’ère des HAART.
Faits
Dans l’ensemble, les tumeurs ont nettement diminué sous traitement HAART, mais le risque moyen reste 1,5 à 2 fois plus élevé que dans la population normale.Dans une étude française, les types de cancer suivants ont été diagnostiqués par fréquence décroissante chez les personnes infectées par le VIH : Lymphome non hodgkinien 21,5%, sarcome de Kaposi 16,0%, carcinome pulmonaire 9,4%, carcinome anal 8,2%, lymphome hodgkinien 7,6%, NMSC 6,8% et carcinome hépatique 5,6%. Les cancers non liés au SIDA représentaient 68% de toutes les tumeurs.
Cancer de la peau blanche (NMSC)
L’incidence de la NMSC est trois à cinq fois plus élevée chez les personnes infectées par le VIH. Le rapport entre le carcinome basocellulaire et le carcinome épidermoïde est de 1:7. Cela contraste nettement avec les transplantés rénaux, pour lesquels le rapport est inversé (1,8:1). Les facteurs de risque pour le développement d’un NMSC sont les mêmes que pour la population normale, à commencer par l’exposition aux UV. On ne sait pas exactement dans quelle mesure les papillomavirus humains (HPV) contribuent au développement de carcinomes épidermoïdes chez les personnes infectées par le VIH. Les NMSC surviennent clairement à un âge plus jeune chez les personnes infectées par le VIH, sont plus susceptibles de récidiver et sont plus susceptibles d’entraîner la mort. La conséquence devrait être un traitement agressif des lésions précancéreuses dans ce collectif.
Mélanome
Le mélanome a une incidence légèrement plus élevée chez les personnes infectées par le VIH. Selon les sources, le ratio d’incidence standardisé (SIR) se situe entre 1,1 et 2,6. On se demande si cette légère augmentation est liée à une plus grande vigilance des patients vis-à-vis des lésions cutanées ou à un suivi médical plus intensif de ces patients. On peut toutefois constater que les personnes infectées par le VIH et atteintes d’un mélanome ont un pronostic nettement moins bon que les patients atteints de mélanome dans la population normale. Plus le nombre de cellules CD4 est bas, plus le pronostic est mauvais. Cependant, la profondeur de pénétration de Breslow, le principal marqueur pronostique, est indépendante du nombre de cellules CD4.
Sarcome de Kaposi
Le sarcome de Kaposi est l’une des tumeurs qui définissent le SIDA. Il s’agit d’une prolifération vasculaire. Avant l’ère des HAART, le sarcome de Kaposi entraînait généralement la mort, avec une survie médiane de 18 mois, car le sarcome de Kaposi associé au VIH est une variante agressive. Sous HAART, l’incidence a pu être massivement réduite (tableau 1). Le sarcome de Kaposi peut affecter non seulement la peau, mais aussi les organes internes. Le responsable est le virus de l’herpès humain 8 (HHV8). Le traitement consiste en premier lieu en une reconstitution immunitaire.
Carcinome anal
Le carcinome anal est associé à l’HPV. L’incidence est particulièrement élevée chez les hommes homosexuels. Les facteurs de risque sont un faible nombre de cellules CD4, une infection par des types d’HPV à haut risque (HPV-16, -18, -31 et -33) et une infection par des types d’HPV multiples. La pathogenèse est comparable à celle du cancer du col de l’utérus. Les personnes infectées par le VIH, quelles que soient leurs pratiques sexuelles, présentent une colonisation par l’HPV au niveau de l’anus deux à six fois supérieure à celle des personnes séronégatives. Les hommes homosexuels séropositifs ont dans 93% des cas un HPV dans la région anale, contre 61% pour les hommes homosexuels non séropositifs.
Lymphomes cutanés
Les lymphomes cutanés ne jouent qu’un rôle mineur en raison de leur rareté, mais ils doivent être mentionnés ici par souci d’exhaustivité. Les types possibles sont le lymphome cutané à grandes cellules T CD30+, le mycosis fongoïde et le syndrome de Sézary, ainsi que les formes cutanées du lymphome de Hodgkin.
ADC et NADC au cours de la HAART
Les HAART ont été introduites en 1996 et ont eu un impact majeur sur le développement des différentes tumeurs malignes chez les personnes infectées par le VIH. Ainsi, sous HAART, les cancers définissant le SIDA, le sarcome de Kaposi et le lymphome non hodgkinien, apparaissent massivement et le cancer du col de l’utérus est nettement moins fréquent. Dans l’étude suisse de cohorte VIH, qui recueille depuis plus de 20 ans des données prospectives sur les personnes infectées par le VIH, le SIR est passé de 136 à 14,7 pour tous les cancers définissant le SIDA.
En revanche, le SIR a augmenté pour la plupart des cancers non définis par le SIDA. Outre le cancer du foie, les lymphomes de Hodgkin et le cancer anal sont en forte augmentation sous HAART. Le cancer blanc de la peau a également augmenté, avec un SIR avant HAART de 1,7 et sous HAART de 3,3. Le mélanome présente une augmentation plus faible, de 1,2 à 2,0. Cependant, certains cancers non liés au SIDA ont également connu une diminution sous HAART, comme le myélome multiple (de 14,8 à 5,1) ou les tumeurs de la tête et du cou (de 4,3 à 2,2) (tableau 2).
Il est intéressant de comparer la fréquence des tumeurs associées à l’HPV entre les transplantés d’organes et les personnes infectées par le VIH. Dans le domaine des tumeurs cutanées, on observe une nette augmentation de la NMSC chez les transplantés d’organes, avec un SIR de 28. Chez les personnes infectées par le VIH, on obtient seulement un SIR de 4. une relation similaire est observée pour les mélanomes, dont la fréquence est à peine plus élevée chez les personnes infectées par le VIH, mais tout de même doublée ou triplée chez les transplantés d’organes. Les proportions sont inversées pour le carcinome anal, où l’on observe un SIR de 28 chez les personnes infectées par le VIH, et de 5. par ailleurs, d’autres tumeurs induites par des virus, qui résultent d’infections par le HHV8, le virus d’Epstein-Barr (EBV) ou les virus de l’hépatite B ou de l’hépatite C, ne sont pas couvertes par l’assurance maladie. C, plus souvent chez les personnes infectées par le VIH que chez les transplantés d’organes.
Discussion
La raison exacte de l’augmentation partielle du risque de cancer chez les personnes infectées par le VIH n’a finalement pas été élucidée. Il est bien connu que les lymphopénies CD4 augmentent en principe le risque de cancer. Sous HAART, les patients vivent beaucoup plus longtemps, même avec un faible nombre de cellules CD4. Il est intéressant de noter à cet égard que la durée de la maladie VIH – mais pas sa gravité – augmente le risque de cancer. Il y a également un dysfonctionnement des cellules CD4 et CD8, ce qui entraîne une diminution de la surveillance immunologique de la tumeur. Les virus oncogènes tels que HHV8, HPV, EBV ou le virus lymphotrope des cellules T humaines (HTLV1/2) peuvent proliférer plus facilement. En outre, l’infection par le VIH entraîne une prédominance des cytokines Th2. Cela a un impact consécutif sur l’angiogenèse, l’apoptose, la présentation des antigènes, l’invasion immunitaire et la transcription de différents oncogènes.
De même, certaines protéines du VIH jouent un rôle dans le développement de certaines tumeurs malignes. Ainsi, le VIH peut avoir des effets directs au niveau cellulaire, voire génétique. Le VIH peut activer des protooncogènes, interférer avec le cycle cellulaire, inactiver des gènes suppresseurs de tumeurs (p53, par exemple) et contribuer à la stabilisation ou à la modification des gènes.
Pourquoi de nombreuses tumeurs augmentent-elles au lieu de diminuer sous HAART ?
Il est intéressant de noter que les NADC augmentent uniquement chez les Caucasiens, et non chez les Africains noirs ou d’autres groupes ethniques. Il est toutefois possible qu’il y ait un biais, car la qualité des déclarations de cancer pourrait être différente. Il convient également de noter que cette augmentation n’est observée que chez les hommes infectés par le VIH, et non chez les femmes infectées par le VIH. Comme pour la population normale, le facteur de risque le plus important est l’âge. Le fait que les patients infectés par le VIH soient majoritairement jeunes, qu’ils vivent nettement plus longtemps avec une HAART et qu’ils “grandissent” ainsi dans un groupe à risque plus élevé, permet de comprendre que certains cancers survenant majoritairement à un âge avancé augmentent au cours de la HAART, ou malgré la HAART. Pour les NMSC comme le carcinome spinocellulaire, c’est probablement le facteur décisif, en raison de l’augmentation de la dose UV cumulée à un âge plus avancé. Aucun lien n’a été établi entre les facteurs histologiques défavorables (ni pour le carcinome basocellulaire ni pour le carcinome spinocellulaire) et le nombre de cellules CD4, la virémie VIH, la durée de la HAART, la durée de la maladie VIH ou le nadir CD4.
On spécule également sur le fait que les personnes infectées par le VIH ont une plus grande propension à prendre des risques et peut-être aussi un style de vie différent (moins sain). La question de savoir dans quelle mesure la thérapie proprement dite a une influence négative n’a pas encore été définitivement tranchée. Certains médicaments anti-VIH sont au moins photosensibilisants.
Perspectives
Des programmes de dépistage ont été proposés pour certains ADC et NADC (cancer anal, cancer du col de l’utérus, cancer du sein, cancers colorectaux, cancer du foie et cancer de la prostate). Il n’existe à ce jour aucune recommandation concernant le dépistage des tumeurs cutanées. Même si les tumeurs cutanées ne sont pas aussi fréquentes chez les personnes infectées par le VIH, elles apparaissent à un âge plus jeune, ce qui, par analogie avec les transplantés d’organes, justifierait un programme de dépistage.
Littérature :
- Franceschi S, et al : Br J Canc 2010 ; 103 : 416-422.
Littérature complémentaire :
- Wilkins K, et al : J Am Acad Dermatol 2006 ; 54 : 189-206.
- Deeken JF, et al : CID 2012 ; 55(9) : 1228-1235.
- Grulich AE, et al : Lancet 2007 ; 370 : 59-67.
- Silverberg MJ, et al : J Natl Cancer Inst 2013 ; 105 : 350-360.
- Guiguet M, et al : Lancet Oncol 2009 ; 10 : 1152-1159.
- Lanoy E, et al : Int J Cancer 2011 ; 129 : 467-475.
- Schulz TF : Int J Cancer 2009 ; 125(8) : 1755-1763.
- Garlassi E, et al. : J Acquir Immune Deficit Syndr 2012 ; 60(2) : e63-65.
- Hofbauer GFL, et al : Swiss Med Wkly 2009 ; 139(29-30) : 407-415.
InFo ONKOLOGIE & HÄMATOLOGIE 2015 ; 3(11-12) : 25-27
DERMATOLOGIE PRATIQUE 2016 ; 26(5) : 12-14