Tous les patients dépressifs en rémission ne bénéficient pas des antidépresseurs en termes de prévention des rechutes. De nombreux patients souhaitent arrêter de prendre leur antidépresseur, notamment en raison d’effets secondaires indésirables. Actuellement, il n’existe pas de prédicteurs permettant de savoir quel patient va rechuter et quel patient ne le fera pas. Il est possible que des biomarqueurs neurobiologiques puissent servir de prédicteurs. L’étude sur l’arrêt des antidépresseurs (AIDA) étudie les prédicteurs d’un arrêt sûr ; elle continue à rechercher des patients en rémission qui souhaitent arrêter leur antidépresseur.
Les rechutes sont un problème cliniquement très pertinent dans le traitement de la dépression. La prévalence à vie des rechutes est très élevée, avec 60% après le premier épisode et un risque qui augmente avec le nombre d’épisodes [1]. Sans médicament antidépresseur (SMA), deux tiers des patients rechutent dans les deux ans, contre environ un tiers avec un SMA [2]. Cela montre d’une part que le risque de rechute peut être réduit de 50% (de 60% à 30%) en poursuivant le traitement par ADM. D’autre part, deux tiers des patients ne bénéficient pas suffisamment du SMA, soit parce qu’ils ont rechuté malgré le SMA, soit parce qu’ils n’auraient pas rechuté même sans le SMA. Un tiers des patients sont susceptibles d’en bénéficier et de ne pas rechuter en raison de l’ADM.
Augmenter la motivation à continuer de prendre des antidépresseurs
Il est bien connu que les antidépresseurs ont des effets secondaires tels que la dysfonction sexuelle ou la prise de poids. En raison de ces effets secondaires, de nombreux patients arrêtent de prendre leurs médicaments à leur propre demande et souvent contre l’avis de leur médecin [3,4] – y compris le tiers qui bénéficierait très probablement de la poursuite de l’ADM. De plus, il existe des preuves qu’une prise prolongée d’ADM entraîne le développement d’une tolérance et pourrait, en induisant des processus de contre-régulation, augmenter artificiellement le risque de rechute après l’arrêt [5]. Un traitement individualisé avec une recommandation de traitement adaptée à chaque patient pourrait donc avoir une grande valeur clinique à long terme. Si les patients savent que la poursuite du traitement par un SMA est nécessaire pour eux personnellement afin d’éviter les rechutes, cela pourrait également augmenter leur motivation à prendre le médicament.
Comment peut-on prédire le risque de récidive ?
Pour décider si un patient donné bénéficie ou non de la poursuite d’un traitement par ADM, nous avons besoin de prédicteurs qui prédisent l’évolution de la maladie dépressive et qui distinguent les différents groupes de patients. Les prédicteurs peuvent être, par exemple, des informations cliniques, des variables génétiques, des biomarqueurs ou une combinaison de ces variables. Mais en réalité, il existe très peu de littérature et de recherche sur ce sujet. Un prédicteur du risque de rechute après l’arrêt pourrait être le type de réponse à l’ADM. Un risque accru semble exister chez les patients qui répondent lentement mais durablement aux ADM, alors que les patients qui répondent rapidement mais non durablement (dits “placebo”) ne présentent pas de risque accru de rechute après l’arrêt [6,7]. La durée du traitement est un autre facteur prédictif possible, auquel il est également fait référence dans les lignes directrices sur le traitement d’entretien [8]. Les recommandations s’appuient sur des observations de l’évolution naturelle des épisodes dépressifs. Comme un épisode dépressif dure généralement de six à neuf mois, c’est aussi approximativement la durée recommandée du traitement d’entretien [9]. Il est toutefois surprenant que les études n’aient pas encore clairement démontré que le risque de rechute après l’arrêt diminue avec la durée du traitement [2,10–12].
Un autre prédicteur potentiel est le nombre d’épisodes antérieurs. Bien qu’il soit suggéré que davantage d’épisodes augmentent le risque de rechute après l’arrêt, par exemple en raison du fait que le risque total de rechute augmente avec le nombre d’épisodes antérieurs, deux méta-analyses sur ce sujet ont abouti à des conclusions opposées [11,12].
Les biomarqueurs comme prédicteurs du risque de récidive
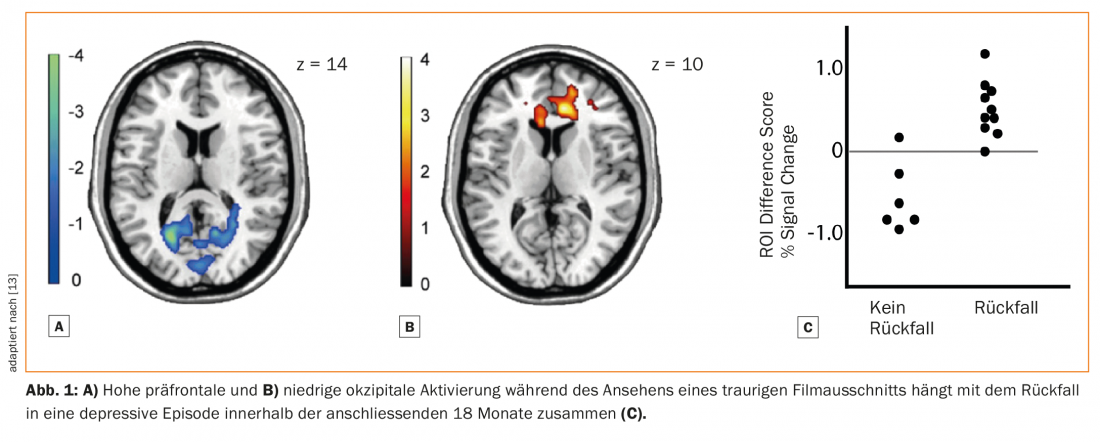
A notre connaissance, aucune étude n’a encore examiné le potentiel des biomarqueurs en tant que prédicteurs du risque de rechute après l’arrêt des ADM. Les biomarqueurs neurobiologiques n’ont été étudiés qu’en relation avec le risque général de rechute, indépendamment de la prise d’ADM. Ainsi, une étude utilisant l’IRM fonctionnelle (IRMf) a examiné l’activité cérébrale pendant que les sujets regardaient des films tristes. Une diminution de l’activité occipitale par rapport à l’activité pré-frontale médiale prédisait les rechutes (Fig. 1) [13]. Une autre étude a utilisé des stimuli qui déclenchent un sentiment de culpabilité. Ici, une connectivité accrue entre le cortex préfrontal médian et le lobe temporal antérieur prédisait les rechutes [14].
Le rôle pertinent du cortex préfrontal médian dans l’anhédonie, l’un des symptômes clés de la dépression, a également été confirmé dans des modèles animaux. Chez les rongeurs, le cortex préfrontal médian contrôle l’interaction dopaminergique du mésencéphale avec le striatum [15]. Une activité accrue du cortex préfrontal médian entraîne une réduction de la recherche de récompense, ce qui se traduit souvent par un trouble de la motivation chez les humains.
En résumé, il serait cliniquement utile d’identifier les patients qui pourraient bénéficier d’une poursuite du traitement par ADM. Alors qu’il n’existe pas encore de prédicteurs pour cela, les caractéristiques neurobiologiques ont un grand potentiel. Pour cela, il est important d’étudier les effets neurobiologiques du sevrage lui-même, qui sont encore peu compris à ce jour.

L’étude de sevrage AIDA
L’objectif de l’étude sur l’arrêt des antidépresseurs (AIDA, www.absetzstudie.ch), financée par le Fonds national suisse et la Deutsche Forschungsgemeinschaft, est d’une part de trouver des prédicteurs pour un arrêt sûr des SMA et d’autre part d’étudier l’effet de l’arrêt de la médication sur la neurobiologie et le comportement des patients. L’étude est en cours à l’unité de neuromodélisation translationnelle en collaboration avec la clinique psychiatrique universitaire de Zurich et à l’hôpital Charité de Berlin. La réactivité émotionnelle, la planification comportementale et la régulation des émotions sont ainsi évaluées à l’aide de l’imagerie fonctionnelle (IRMf et EEG). En combinaison avec de nouvelles approches de ce que l’on appelle la “psychiatrie computationnelle” [16], elles sont modélisées et quantifiées mathématiquement [17]. En outre, les mesures qui se sont avérées être de bons prédicteurs de la réponse aux ADM sont également étudiées. L’objectif à long terme est d’identifier des paramètres cliniquement pertinents et mesurables afin de rendre l’arrêt plus sûr.
Conclusion
La prévention des rechutes est une composante importante d’un traitement de la dépression efficace à long terme. Bien que les antidépresseurs soient globalement efficaces pour éviter les rechutes, tous les patients n’y répondent pas. Les effets secondaires peuvent poser des difficultés considérables pour les traitements à long terme et de nombreux patients choisissent de ne pas suivre un traitement médicamenteux à long terme. Pour minimiser les rechutes, il serait important d’identifier les patients qui peuvent arrêter leur médication en toute sécurité. Cependant, aucun prédicteur n’a été trouvé à ce jour pour prédire un arrêt sûr. Les biomarqueurs neurobiologiques pourraient servir de bons prédicteurs. C’est pourquoi nous menons actuellement à Zurich et à Berlin l’étude sur l’arrêt des antidépresseurs (AIDA), une étude d’observation dont l’objectif est d’identifier les prédicteurs d’un arrêt sûr.
Littérature :
- Association américaine de psychologie : Diagnostic and statistical manual-text revision (DSM-IV-TR). APA 2000.
- Geddes JR, et al : Prévention des rechutes avec un traitement antidépresseur dans les troubles dépressifs. Une revue systématique. Lancet 2003 ; 361(9358) : 653-661.
- Olfson M, et al : Continuity of Antidepressant Treatment for Adults With Depression in the United States. Am J Psychiatry 2006 ; 163(1) : 101-108.
- Hunot VM, et al : A Cohort Study of Adherence to Antidepressants in Primary Care. L’influence des préoccupations concernant les antidépresseurs et les préférences de traitement. Prim Care Companion J Clin Psychiatry 2007 ; 9(2) : 91-99.
- Andrews PW, et al. : Blue Again. Effets perturbateurs des antidépresseurs suggérant l’homéostasie monoaminergique dans la dépression majeure. Front Psychol 2011 ; 2.
- Nierenberg AA, et al. : Traitement continu contrôlé par placebo avec la mirtazapine. Le schéma de réponse aiguë prédit la rechute. Neuropsychopharmacologie 2004 ; 29(5) : 1012-1018.
- Stewart JW, et al : Use of pattern analysis to predict differential relapse of remitted patients with major depression during 1 year of treatment with fluoxetine or placebo. Arch Gen Psychiatry 1998 ; 55(4) : 334-343.
- DGPPN, et al. : pour le groupe de lignes directrices sur la dépression unipolaire. S3-Leitlinie/Nationale Versorgungsleitlinie Unipolare Depression – version longue, 2ème édition . 2015.
- Spijker J, et al : Duration of major depressive episodes in the general population. Résultats de l’enquête néerlandaise sur la santé mentale et l’incidence (NEMESIS). Br J Psychiatry J Ment Sci 2002 ; 181 : 208-213.
- Glue P, et al : Meta-analysis of relapse prevention antidepressant trials in depressive disorders. Aust N Z J Psychiatry 2010 ; 44(8) : 697-705.
- Kaymaz N, et al : Evidence that patients with single versus recurrent depressive episodes are differentially sensitive to treatment discontinuation. A meta-analysis of placebo-controlled randomized trials. J Clin Psychiatry 2008 ; 69(9) : 1423-1436.
- Viguera AC, et al : Discontinuing Antidepressant Treatment in Major Depression. Harv Rev Psychiatry 1998 ; 5(6) : 293-306.
- Farb NAS, et al : Mood-Linked Responses in Medial Prefront Cortex Predict Relapse in Patients with Recurrent Unipolar Depression. Biol Psychiatry 2011 ; 70(4) : 366-372.
- Lythe KE, et al : Self-blame-selective hyperconnectivity between anterior temporal and subgenual cortices and prediction of recurrent depressive episodes. JAMA Psychiatry 2015 ; 72(11) : 1119-1126.
- Ferenczi EA, et al. : Régulation corticale préfrontal de la dynamique des circuits cérébraux et du comportement lié au reward. Science 2016 ; 351(6268) : aac9698.
- Huys QJM, et al : Computational psychiatry as a bridge from neuroscience to clinical applications. Nature Neurosci [accepté, publication en cours].
- Huys QJM, et al : Interplay of approximate planning strategies. Proc Natl Acad Sci USA 2015 ; 112(10) : 3098-3103.
InFo NEUROLOGIE & PSYCHIATRIE 2016 ; 14(2) : 16-19