Alors que les thérapies ciblées dans le cancer du poumon non à petites cellules (NSCLC) sont en plein essor depuis des années, une telle option fait encore défaut pour les tumeurs mutées KRAS. Le sotorasib, un inhibiteur de petites molécules ciblant KRASG12C, pourrait bientôt combler cette lacune. Les choses bougent également dans le pipeline pour le cancer du poumon à petites cellules (SCLC). L’accent est mis ici, entre autres, sur l’immunothérapie avec ce que l’on appelle les “bispecific T-cell Engers” (BiTEs).
Plus de 10% de tous les cas de cancer et un peu plus de 20% de tous les décès liés à des tumeurs malignes sont imputables au cancer du poumon. Ou, pour le dire de manière plus plastique, toutes les 18 secondes, une personne meurt de cette maladie dans le monde, dont 1200 par jour en Europe. Même si certains succès thérapeutiques ont été obtenus ces dernières années, il y a encore beaucoup de place pour l’innovation. Non seulement le besoin de nouvelles approches diagnostiques et thérapeutiques est important, mais leur mise en œuvre dans la pratique nécessite des améliorations urgentes.
KRAS comme cible thérapeutique
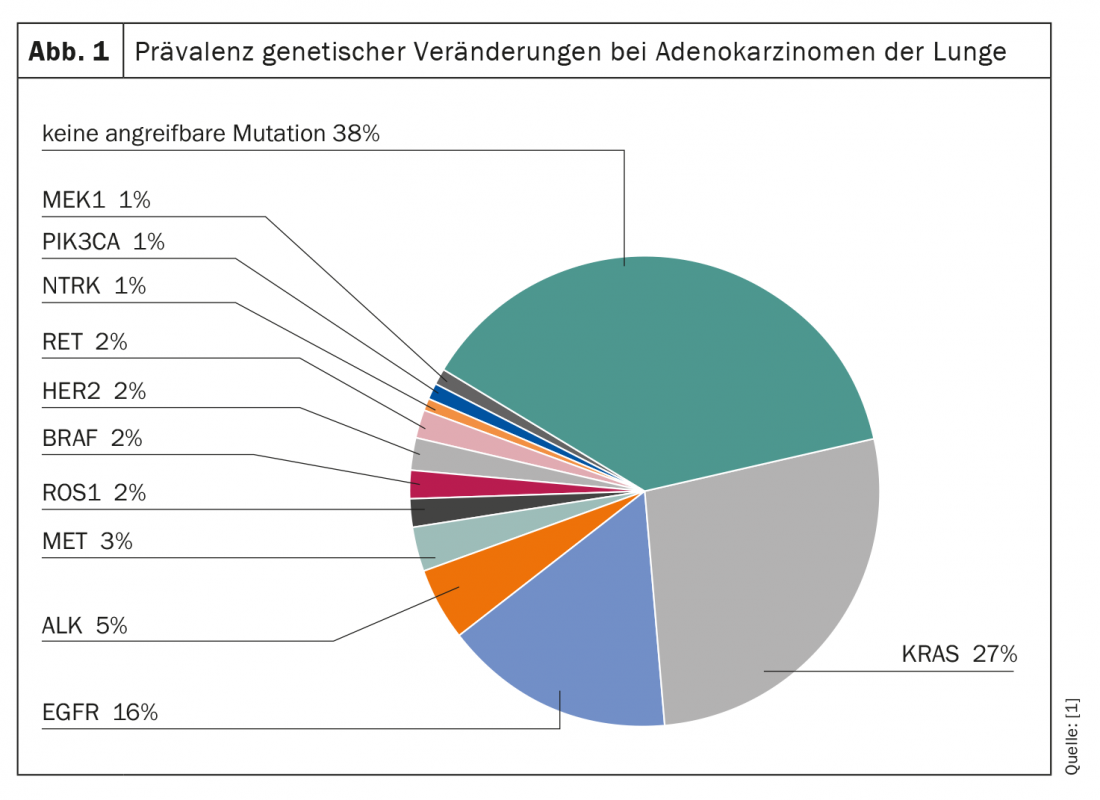
Les altérations génétiques sont très répandues dans le cancer du poumon (figure 1). Tous sous-types confondus, la protéine G KRAS est la molécule la plus souvent mutée et potentiellement vulnérable. Ainsi, environ 27% de tous les adénocarcinomes du poumon présentent une mutation du gène KRAS. Mais alors que d’autres mutations, comme celles des gènes EGFR et ALK, font déjà l’objet d’une utilisation thérapeutique ciblée, KRAS a longtemps été considéré comme une “cible ingérable”. En particulier, leur petite taille, leur surface lisse et l’absence de poches de liaison appropriées rendent difficile une attaque sélective.
Le développement de l’inhibiteur de petites molécules sotorasib a permis pour la première fois de bloquer les protéines KRAS mutées G12Cde manière cliniquement applicable. Environ 50% des NSCLC mutés KRAS portent cette sous-forme de mutation. La nouvelle substance se lie de manière sélective et irréversible à la cible considérée jusqu’ici comme impossible et a donc en quelque sorte introduit un changement de paradigme dans la thérapie ciblée – et pas seulement dans le cancer du poumon. Depuis l’administration de la première dose en 2018, plusieurs résultats prometteurs d’études cliniques ont déjà été publiés. Ainsi, dans l’étude de phase II CodeBreaK 100, qui a porté sur 126 patients ayant reçu au moins un traitement antérieur, la maladie a été contrôlée dans plus de 80% des cas sous monothérapie par sotorasib, trois patients ayant même connu une réponse complète. Chez 43 patients, le volume de la tumeur a diminué d’au moins 30%. La médiane de la réponse a duré dix mois et était détectable après 1,4 mois. Au moment de la coupure des données, 43% des répondeurs étaient toujours sous traitement par sotorasib. La survie sans progression (PFS) médiane a également été convaincante dans l’analyse des données. Il était de 6,8 mois sous traitement par sotorasib.
Comparée aux options existantes dans le traitement de deuxième ligne de ce groupe de patients, la nouvelle substance représente, sur la base des données actuelles, une bien meilleure alternative. Dans les régimes thérapeutiques actuels, la survie sans progression après échec du traitement de première ligne est d’environ 4,5 mois, avec des taux de réponse de 20% maximum à la deuxième ligne de traitement. Jusqu’à présent, le sotorasib a suscité quelques espoirs non seulement dans le domaine de l’efficacité, mais aussi dans celui de la sécurité et de la tolérance. Les effets indésirables rapportés ont été généralement légers et aucun décès n’a été causé par le médicament. Seuls 7,1% des patients ont dû arrêter le traitement en raison des effets secondaires. Dans ce cas, ce sont surtout la diarrhée et les nausées qui étaient au premier plan. En outre, des augmentations des enzymes hépatiques et de la fatigue ont été observées dans certains cas.
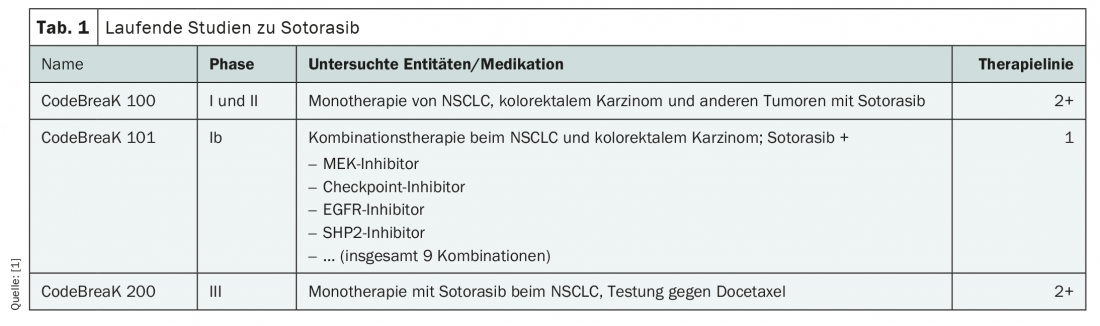
De nombreuses études cliniques sont actuellement en cours sur l’utilisation de cette nouvelle molécule, tant dans les lignes de traitement avancées qu’en première ligne (tableau 1). Jusqu’à présent, le sotorasib est l’inhibiteur de KRASG12C le plus largement étudié. De nouvelles données sont attendues dès cette année, notamment celles de l’étude de phase Ib CodeBreaK 101 sur l’utilisation en association en première ligne de traitement du NSCLC et du cancer colorectal. Une demande d’autorisation de mise sur le marché pour le traitement de deuxième ligne du NSCLC avancé avec mutation KRASG12C a déjà été déposée auprès de l’Agence européenne des médicaments (EMA).
Un léger espoir pour les petites cellules
Tout comme en l’absence de mutations vulnérables dans le NSCLC, les médicaments oncologiques ciblés ne jouent actuellement aucun rôle dans le cancer du poumon à petites cellules (SCLC). Ce type de cancer du poumon représente environ 13% de tous les cas et son pronostic reste défavorable. Depuis plus de quarante ans, la chimiothérapie est au centre du traitement, les approches immunothérapeutiques n’ont pas encore réussi à convaincre. Cependant, cela pourrait bientôt changer grâce au développement d’anticorps bispécifiques, appelés “bi-specific T-cell Engers” (BiTEs).
L’immunothérapie par les BiTE repose sur l’activation du potentiel cytotoxique des propres lymphocytes T de l’organisme. Pour ce faire, les T-cell engagers possèdent deux domaines d’anticorps variables : l’un est dirigé contre un antigène tumoral et varie selon l’entité, l’autre se lie au CD3 à la surface des cellules T cytotoxiques. À ce jour, plus de 3000 patients ont déjà été traités avec cette technologie. Celle-ci fait l’objet de recherches approfondies, tant dans le domaine des hémopathies malignes que des tumeurs solides. Actuellement, l’intérêt se porte en particulier sur l’utilisation dans le cancer de la prostate, le cancer du poumon à petites cellules, le myélome multiple et le cancer de l’estomac. Différents traitements combinés et séquentiels sont également à l’étude afin de prévenir les résistances potentielles. Actuellement, une seule biothérapie est autorisée dans le monde et en Suisse pour le traitement de la leucémie lymphoblastique aiguë : Blinatumomab (Blincyto®).
Dans le cas du cancer du poumon à petites cellules, le domaine variable des BiTE, appelé AMG 757, est dirigé contre la molécule de surface DLL3, qui est hautement régulée sur les cellules malignes. Des études de phase I sont actuellement en cours. Les premières données montrent un taux de contrôle de la maladie de 37% après un suivi de 11 mois. Les données à plus long terme restent à voir, mais il est possible qu’un peu de mouvement se produise dans un avenir proche dans une zone déjà silencieuse depuis longtemps.
Real World Check : normes inégales, disponibilité non garantie
Aussi innovantes, avancées et efficaces que soient les nouvelles thérapies, leur mise en œuvre dans la pratique clinique quotidienne est souvent difficile. Avec des approches thérapeutiques plus complexes, une multitude d’essais cliniques et divers biomarqueurs, les exigences en matière de gestion des patients atteints de cancer du poumon augmentent. La maladie, qui est encore traitée dans de nombreux endroits sans test génétique précis, prend de plus en plus de visages différents grâce à l’identification d’un nombre croissant de cibles utilisables dans le traitement. La perception du cancer du poumon comme une maladie hétérogène sur le plan histologique, génétique et phénotypique fait émerger de nouvelles options thérapeutiques à un rythme rapide. Il est souvent difficile de les intégrer dans la pratique clinique quotidienne, explique le Dr Anne-Marie Baird, présidente de l’organisation de patients Lung Cancer Europe (LUCE). La médecine personnalisée ne correspond pas encore à la réalité dans une grande partie de l’Europe. Ainsi, les développements positifs dans le domaine des substances disponibles aujourd’hui sont malheureusement loin de servir à toutes les personnes concernées. Selon ce rapport, 31 à 50% des patients en Europe ne savent pas s’ils ont subi un test de biomarqueurs. Selon Baird, il existe d’importantes différences régionales non seulement dans le domaine des diagnostics standard, mais aussi dans la disponibilité de médicaments efficaces.
Les changements rapides dans le paysage thérapeutique du cancer du poumon entraînent des inégalités dans la prise en charge et soulèvent de nombreuses questions sur la procédure optimale à suivre dans la pratique clinique quotidienne. Ainsi, il est souvent difficile de savoir qui doit être testé pour quoi et quand. De même, le choix du bon médicament et de la meilleure séquence peut représenter aujourd’hui des défis importants. Outre l’élargissement de l’accès au diagnostic et au traitement, Baird cite la recherche de marqueurs prédictifs robustes et l’élaboration de lignes directrices claires concernant les tests génétiques comme objectifs pour les prochaines années. Si l’on parvient à les mettre en œuvre, les patients atteints de cancer du poumon pourraient bientôt bénéficier de thérapies encore plus puissantes, idéalement indépendamment de leur lieu de résidence. Il est fort possible que le Sotorasib et les BiTE jouent également un rôle à cet égard.
Amgen Europe
Source :
- Point de presse “Transforming targeted lung cancer care”, 01.02.2021, Amgen Europe Corporate Affairs
InFo ONKOLOGIE & HÉMATOLOGIE 2021 ; 9(2) : 30-31