La sécurité des médicaments concerne la recherche pré- et post-autorisation d’un médicament, les connaissances des médecins et des groupes de patients particuliers, mais aussi l’intégration de la technologie dans le quotidien de l’hôpital. Les erreurs de médication et les interactions dangereuses peuvent ainsi être évitées.
Commençons par les médicaments. Les “phases de vie” du développement clinique d’un médicament sont bien connues. En commençant par le pré-marketing, qui comprend les études de phase I à III, jusqu’à la soumission à l’autorité compétente en matière de médicaments (par exemple, la FDA aux États-Unis) et l’autorisation de mise sur le marché – si le médicament survit à l’examen. Alors que ces dernières années, des populations d’étude particulières, c’est-à-dire des personnes d’âge avancé, souffrant de maladies rénales ou hépatiques, d’origines diverses, etc. ont été intégrées dans la phase de pré-commercialisation, il est évident que cela ne couvre pas tous les groupes et situations de traitement, loin de là. Par exemple, les femmes enceintes et les enfants sont souvent exclus pour des raisons éthiques.
Afin de mieux évaluer l’innocuité d’un médicament, l’autorisation de mise sur le marché est suivie d’une phase de post-commercialisation (phase IV), qui consiste en une surveillance à long terme des événements indésirables, un suivi systématique et des études pharmaco-épidémiologiques de sécurité. Depuis la fin des années 90, cette “phase de vie” des médicaments est de plus en plus systématisée et intégrée plus activement dans le concept global de marketing. Aujourd’hui, elle est normalement déjà pensée ou intégrée de manière proactive lors du développement de nouvelles substances (c’est-à-dire que des études de sécurité épidémiologiques systématiques et basées sur la population sont généralement négociées en même temps que la demande d’autorisation de mise sur le marché).
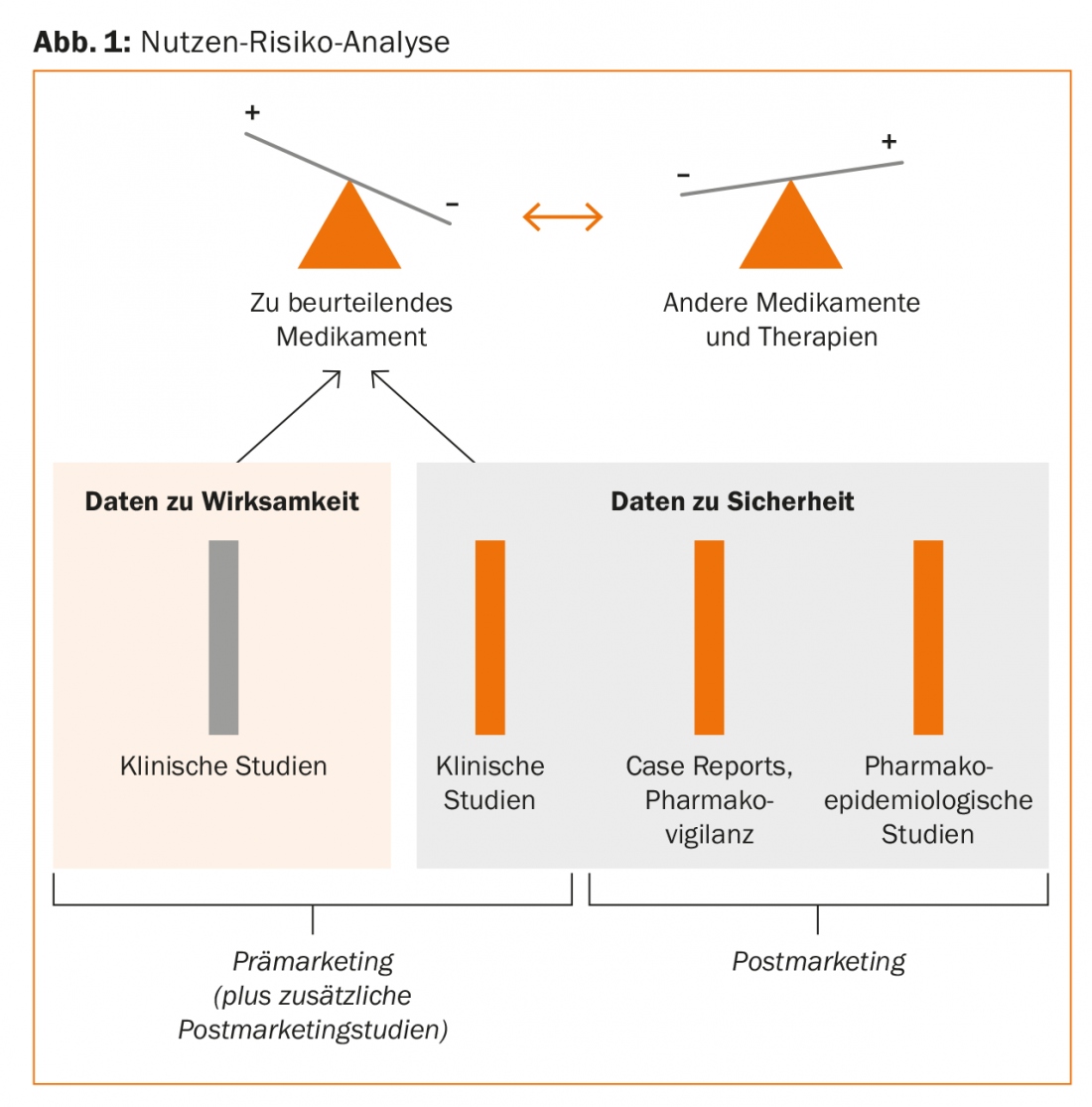
Une analyse rationnelle des bénéfices et des risques des médicaments ayant la même indication repose donc sur les piliers suivants :
- Études cliniques (phase I, II, III)
- Case Reports/Pharmacovigilance (saisies spontanées)
- Études pharmaco-épidémiologiques (Fig. 1).
Le domaine de la pharmacovigilance ou des Case Reports est très facile à évaluer qualitativement et a un effet de signal (génération d’hypothèses), mais il est mal adapté à la quantification des risques relatifs. La plus grande quantité de preuves provient d’études pharmaco-épidémiologiques systématiques. “Ce domaine est désormais très spécialisé et les études sont très vastes et exigeantes. Mais ce que nous pouvons très bien faire au quotidien avec les nouvelles possibilités techniques, ce sont des évaluations à l’aide de systèmes d’information cliniques. Nous avons publié des études sur les interactions médicamenteuses en 2011 [1]. Nos données de 2016 sur les neuroleptiques de deuxième génération [2] montrent en outre que cela est également possible au niveau local, dans votre propre hôpital, et que cela est utile pour améliorer la sécurité de la prescription”, a expliqué l’orateur.
Les étapes de la vie des médecins
En ce qui concerne les erreurs de médication, Ashcroft et al. Il y a un peu plus de deux ans, nous avons démontré que les jeunes médecins inexpérimentés commettent deux fois plus d’erreurs au cours de la première et de la deuxième année que les médecins plus âgés, mais que ces derniers ne “s’en sortent” pas sans erreurs de médication et que les erreurs – lorsqu’ils en commettent – sont tout aussi graves. Cela signifie que les interventions ne sont pas seulement indiquées pour les jeunes médecins, mais aussi pour les médecins de niveau supérieur, afin d’éviter des erreurs de médication potentiellement graves [3]. La volonté de se former et d’apprendre tout au long de sa vie (y compris les plus âgés par les plus jeunes), ainsi que l’intégration de la technologie moderne (par exemple l’iPad lors des visites) dans la prise de décision sont des conditions préalables à cela.
“Sommes-nous vraiment en train de respecter le principe d’Hippocrate ‘Primum non nocere’ (ou en français : d’abord ne pas nuire) ? Prenons un exemple : dans le cas d’une maladie autrement mortelle, prescrivez-vous le médicament 1, qui guérit 75% des patients mais présente un risque d’effet secondaire aigu mortel de 1:10’000 cas, ou le médicament 2, avec un taux de guérison de 80% et un risque correspondant de 1:100 ?”, a demandé le professeur Russmann à l’auditoire. “Beaucoup choisiraient le médicament 1. Mais on provoque alors 421 décès de plus qu’avec le médicament 2”. Le calcul correspondant est très simple :
Médicament 1 : un patient sur 10 000 meurt, sur les 9999 restants, 7499 sont guéris. Ainsi, 7499 personnes sur 10 000 survivent.
Médicament 2 : 100 patients sur 10 000 meurent, sur les 9900 restants, 7920 sont guéris. 7920 survivants sur 10 000.
Une “prise de décision défensive”, c’est-à-dire une attitude autoprotectrice du médecin, combinée à une mauvaise évaluation intuitive des probabilités, peut donc se révéler dangereuse pour le patient. Pour reprendre l’exemple ci-dessus : Le fait que le patient soit mort de la maladie plutôt que du médicament qu’il avait lui-même prescrit est un peu plus facile à supporter pour le médecin.
Un résumé de la manière dont la sécurité des médicaments peut être améliorée par les médecins est présenté sur 1.
Phases de vie de l’évidence
Les principes suivants sont pertinents à cet égard :
- Utiliser des médicaments dont le profil de sécurité est bien documenté
- Rester “à jour”, continuer à se former
- Rester critique face aux nouvelles preuves, les examiner soigneusement
- Préoccupation : “Chaque fois qu’un nouveau médicament arrive sur le marché, quelque chose de fou va se produire”.
Phases de vie des hôpitaux
Les analyses systématiques et les systèmes d’information clinique permettent de détecter les combinaisons de médicaments dangereuses, voire contre-indiquées, et de les signaler à temps. Les contrôles d’interaction sont possibles, par exemple, via www.mediq.ch. Le professeur Russmann, pharmacologue clinique et épidémiologiste, s’intéresse lui-même de près à ce sujet et a contribué à développer et à mettre en œuvre le programme dit de “pharmaco-épidémiologie interventionnelle”. Il s’agit d’enregistrer un grand nombre de prescriptions via un système d’information clinique électronique et de créer une base de données pharmaco-épidémiologique hospitalière locale. Grâce au programme de “pharmaco-épidémiologie interventionnelle”, les erreurs de médication à l’hôpital peuvent être identifiées, quantifiées et leur pertinence clinique évaluée dans un délai très court. Il est ainsi possible d’intégrer des alertes automatisées ciblées dans la prescription électronique de médicaments (en “temps réel”). En outre, les données permettent de réaliser des études de cohorte, des études cas-témoins et des études longitudinales qui fournissent des informations sur les schémas de prescription, les effets secondaires et les aspects économiques. Deux publications de ces dernières années montrent que cela fonctionne [4,5].
La gestion proactive de la qualité ainsi que les investissements dans les technologies de l’information et les systèmes susmentionnés, qui identifient les problèmes potentiels de la pharmacothérapie, évaluent la pertinence clinique et avertissent à temps des situations critiques, sont donc essentiels. En plus de la stabilité du personnel ou d’un faible taux de rotation, ils aident un hôpital à améliorer la sécurité des médicaments de manière durable et à long terme.
Étapes de la vie des patients
Enfin, quelques mots sur les patients en fin de vie”. Chez les personnes âgées, en raison de la multimorbidité et donc de la polypharmacie, la vérification des interactions entre médicaments (“drug-drug-interaction”) est essentielle. Mais il ne faut pas oublier les interactions entre les médicaments et les maladies (“drug-disease-interaction”). Un bilan de la fonction rénale et d’éventuelles adaptations de doses, des visites cliniques régulières et un suivi de différents paramètres tels que la pression artérielle, l’ECG, etc. font également partie d’une pratique clinique visant à améliorer la sécurité des médicaments. “Pour la population pédiatrique, c’est-à-dire les patients au début de leur vie, le site/base de connaissances kinderdosierungen.ch fournit des informations précieuses”, a déclaré l’orateur.
Source : 15e réunion annuelle de la SSMSP, 28 septembre 2017, Wil
Littérature :
- Haueis P, et al : Evaluation des interactions médicamenteuses dans un large échantillon de patients psychiatriques : une interface de données pour une analyse de masse avec un logiciel d’aide à la décision clinique. Clin Pharmacol Ther 2011 Oct ; 90(4) : 588-596.
- Niedrig DF, et al : Second-generation antipsychotics in a tertiary care hospital : prescribing patterns, metabolic profiles, and drug interactions. Int Clin Psychopharmacol 2016 Jan ; 31(1) : 42-50.
- Ashcroft DM, et al : Prévalence, nature, sévérité et facteurs de risque des erreurs de prescription chez les patients hospitalisés : étude prospective dans 20 hôpitaux britanniques. Drug Saf 2015 Sep ; 38(9) : 833-843.
- Niedrig D, et al : Development, implementation and outcome analysis of semi-automated alerts for metformin dose adjustment in hospitalized patients with renal impairment. Pharmacoepidemiol Drug Saf 2016 Oct ; 25(10) : 1204-1209.
- Niedrig D, et al : Paracetamol overdosing in a tertiary care hospital : implementation and outcome analysis of a preventive alert programme. Journal of Clinical Pharmacy and Therapeutics 2016 ; 41(5) : 515-518.
Littérature complémentaire :
- Gigerenzer G : Risque : comment prendre les bonnes décisions. Munich, Allemagne : Random House GmbH 2013.
InFo NEUROLOGIE & PSYCHIATRIE 2017 ; 15(6) : 39-41