Le traitement de la douleur est l’un des grands défis des soins palliatifs, mais c’est aussi souvent celui dont le succès thérapeutique est mesurable. Dans les stades avancés, toutes les possibilités de traitement de la douleur doivent être exploitées pour améliorer la qualité de vie. En cas d’échec du traitement, il est nécessaire de prendre contact avec un spécialiste de la douleur. Environ 90% des patients atteints de tumeurs avancées peuvent ainsi être traités sans douleur.
Presque tous les patients atteints d’une maladie grave, souvent maligne, redoutent une douleur qui ne peut être traitée. Beaucoup d’entre eux connaissent des situations de membres de leur famille ou d’amis qui, au cours de leur maladie, ont souffert de douleurs mal traitées et ont vécu douloureusement la phase de fin de vie. Avec les possibilités actuelles de traitement de la douleur, ces évolutions ne devraient plus se produire. Cependant, il existe des situations où le traitement de la douleur peut atteindre ses limites en raison de sa complexité.
Le traitement du symptôme de la douleur est un bon exemple de contrôle des symptômes dans les soins palliatifs, d’autant plus que la douleur est un problème fréquent au cours des maladies potentiellement mortelles. Une analgésie efficace est l’une des tâches principales des soins palliatifs. Souvent, en raison de l’évolution destructrice de la maladie, nous trouvons une situation de douleur progressive qui nécessite une adaptation continue du traitement. Il est important pour le concept de traitement d’analyser le type de douleur et les éventuelles pathologies étiologiques sous-jacentes afin d’appliquer, dans la mesure du possible, des approches thérapeutiques causales, comme par exemple une radiothérapie contre la douleur. En raison de l’inactivité, la douleur s’intensifie souvent et le traitement peut être compliqué par des dysfonctionnements organiques croissants. C’est précisément à la fin de l’évolution de la maladie que les facteurs non somatiques sont de plus en plus au premier plan dans le vécu de la douleur. D’autre part, il est compréhensible que les patients réclament rarement un contrôle des symptômes aussi ardemment que l’absence de douleur.
Principes de base de la douleur
La définition de la douleur actuellement en vigueur date de 1986 et a été établie par l’Association internationale pour la lutte contre la douleur (IASP) ; elle est la suivante : La douleur est une expérience sensorielle et émotionnelle désagréable (sensorielle et émotionnelle) associée à une lésion tissulaire réelle ou imminente – ou décrite sous la forme d’une telle lésion – souvent accompagnée de manifestations végétatives telles que pâleur, sueur et augmentation de la pression artérielle.
La douleur aiguë a normalement une fonction d’alerte utile et est utile, protectrice et vitale. Mais en cas de douleur chronique au cours d’une maladie maligne, la douleur a perdu cette fonction d’avertissement utile. La douleur peut être classée en aiguë ou chronique en fonction de son évolution dans le temps, mais aussi en douleur nociceptive, neuropathique et mixte en fonction de sa pathogenèse, sans oublier ce que l’on appelle le trouble somatoforme douloureux. Dans les situations palliatives, nous sommes généralement confrontés à des douleurs chroniques progressives, souvent mixtes, mais de nouvelles douleurs aiguës apparaissent au cours de la maladie et doivent faire l’objet d’une évaluation différenciée afin de ne pas manquer les possibilités de traitement causal.
Pathogenèse de la douleur
L’analyse différenciée de la douleur en fonction de la pathogenèse est indispensable, car une thérapie de la douleur judicieuse n’est possible qu’une fois la classification effectuée. Nous distinguons la douleur nociceptive de la douleur neuropathique. La douleur nociceptive est une douleur qui résulte généralement d’un dommage local à l’endroit de la lésion. La douleur viscérale constitue ici une exception, car elle peut rendre difficile une attribution locale via les zones de Head.
Un bon exemple d’événement nociceptif est la douleur causée par l’apparition de métastases osseuses. Ici, une destruction locale par irritation des récepteurs correspondants déclenche une douleur de base constante, parfois accentuée par une crise de douleur plus intense.
En revanche, la douleur neuropathique trouve son origine dans le système nerveux central ou périphérique. Le début de la douleur n’est souvent pas immédiat, avec une certaine latence de quelques jours ou semaines après la lésion proprement dite, les crises douloureuses sont fréquentes et très intenses, imprévisibles et sont décrites comme brûlantes, coupantes, électrisantes et pulsatiles. De plus, il peut y avoir une hyper- ou une hypalgésie, ainsi qu’une allodynie. Des exemples de douleurs neuropathiques sont la névralgie post-zostérienne, la douleur fantôme, les douleurs radiculaires ou encore les douleurs à déclenchement central (douleur thalamique).
Douleurs cancéreuses
Dans le cadre d’une maladie tumorale, la douleur peut être provoquée directement par la tumeur, que ce soit par une croissance destructrice dans les tissus, par une pression ou une infiltration des nerfs, par un étirement ou une pression sur les organes creux. Les douleurs tumorales indirectes sont dues à l’inflammation œdémateuse périlésionnelle, à des fractures pathologiques ou à des déplacements d’organes creux. Enfin, les douleurs surviennent également à la suite de traitements tumoraux postopératoires, post-actiniques ou en raison de l’inflammation et des conséquences de la chimiothérapie. Dans la mesure du possible, après avoir clarifié la cause de la douleur, la priorité est donnée à la possibilité de traitement causal si la charge qu’il implique semble acceptable dans le contexte global. Malheureusement, ces possibilités sont limitées et le traitement symptomatique est souvent la seule option.
Traitement de la douleur
A peu près au même moment où la douleur a été définie par l’IASP, l’OMS a développé un schéma par étapes pour le traitement de la douleur chez les patients cancéreux. L’objectif de ce schéma était de soulager ou d’éliminer la douleur et de prévenir une nouvelle exacerbation de la douleur. Cette classification permet de traiter la douleur de manière efficace, relativement peu risquée et rapidement efficace. Aujourd’hui, le schéma graduel de l’OMS est également utilisé, après modification, dans le traitement des douleurs non malignes.
Les trois niveaux comprennent, au niveau 1, les analgésiques classiques nociceptifs non opioïdes que nous connaissons tous bien. Outre leur effet analgésique, ces substances ont également des propriétés antiphlogistiques et antipyrétiques à des degrés divers. A l’exception du paracétamol, ils agissent exclusivement en périphérie sur le nocicepteur. Seul le paracétamol a également une action centrale. Dans Au niveau 2, nous trouvons les opioïdes faibles. Les représentants de cette catégorie sont le tramadol, la codéine, la dihydrocodéine ou la tilidine. Ils ont un rapport bénéfice/risque avantageux, possèdent environ 1/6-1/10 de l’efficacité de la substance de référence qu’est la morphine (d’où leur nom d’opioïdes faibles) et sont faciles à doser. Des problèmes surviennent chez 10% des patients qui, par exemple, ne peuvent pas métaboliser la codéine et ne souffrent que des effets secondaires induits par les opioïdes, ainsi que par les différents métaboliseurs chez lesquels le tramadol ne provoque que des troubles sérotoninergiques et antiadrénergiques en orthostase.
Le niveau 3 comprend les opioïdes classiques avec la substance de référence morphine (plus de mg pour la même analgésie – opioïdes faibles ; moins de mg pour la même analgésie – opioïdes forts). Un aperçu des doses équivalentes pour les opioïdes est présenté dans le tableau 1 . Les opioïdes inhibent la transmission au niveau des synapses du système nociceptif, activent des systèmes inhibiteurs dans le SNC et la moelle épinière, modifient la sensation de douleur en attaquant le thalamus, le système limbique et entraînent donc également une anxiolyse. En périphérie, au niveau du nocicepteur, les opioïdes agissent principalement dans les tissus enflammés.
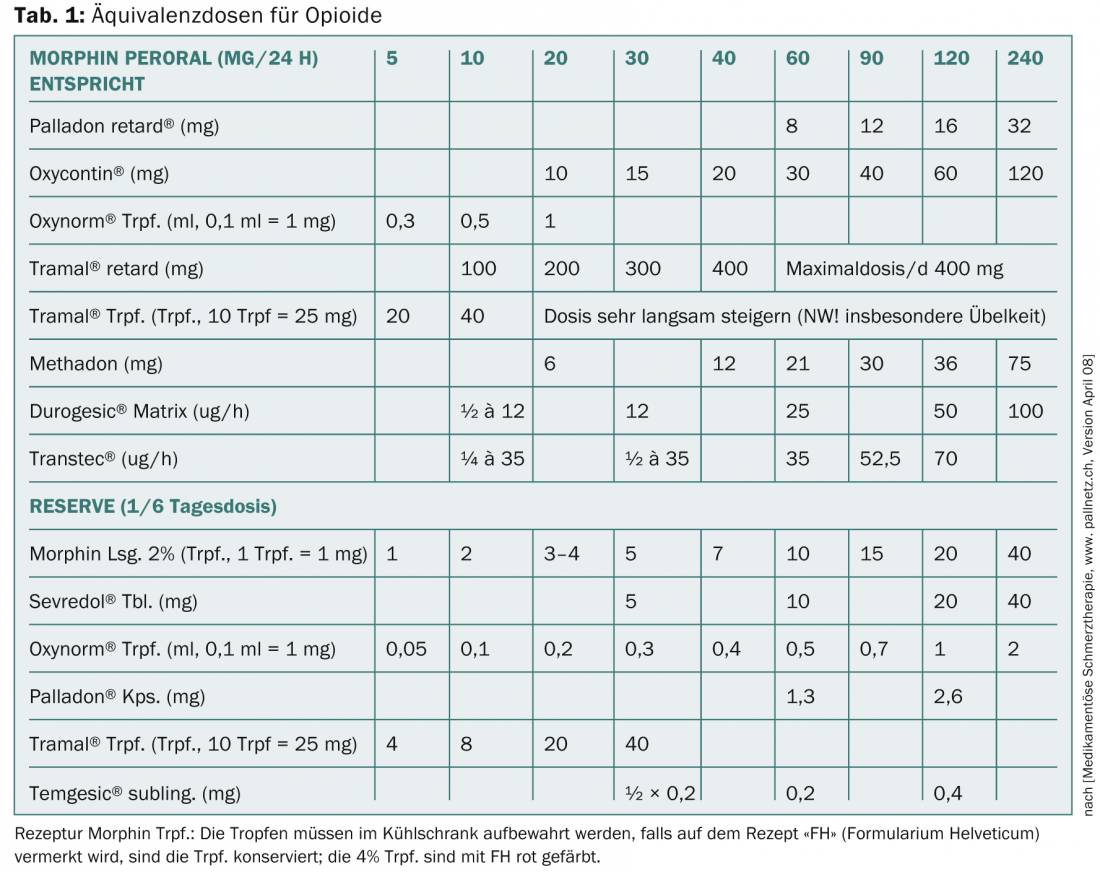
Les principaux problèmes sont les nausées induites par les opioïdes, qui sont généralement passagères, et la constipation permanente, qui nécessite une médication d’accompagnement obligatoire. Les substances individuelles se distinguent principalement par leurs effets différents sur les récepteurs mü, kappa et delta.
Les principes de base du traitement de la douleur reposent sur la prise orale (by the mouth) avec le choix de la galénique appropriée, à heure fixe (by the clock) dans le sens d’une administration prophylactique plutôt que réactive, de préférence sous forme retard et avec une progression thérapeutique par étapes (by the ladder). Quelques années plus tard, l’individualisation des schémas thérapeutiques et la prise en compte des besoins des patients en termes de mesures non pharmacologiques ont été ajoutées en complément. La recommandation initiale d’une structure sur les trois niveaux n’est plus respectée aujourd’hui, en particulier pour les douleurs tumorales et la probabilité d’une augmentation rapide de la douleur, afin d’éviter une chronicisation de la douleur par une perte de temps inutile.
En principe, les préparations de niveau 1 peuvent être facilement combinées avec celles de niveau 2 ou 3, dans la mesure où l’effet thérapeutique nociceptif des médicaments de niveau 1 peut conduire à un effet d’économie des opioïdes. L’association des médicaments de niveau 1 entre eux fait l’objet de controverses, mais il existe des preuves de synergies pour l’utilisation conjointe du paracétamol et du métamizole. Il n’est pas judicieux de combiner les opioïdes de niveau 2 et 3, car dans ce cas, la concurrence pour le récepteur peut faire que la substance la plus faible agisse.
Opioïdes
Les opioïdes sont des médicaments essentiels dans les soins palliatifs, souvent indispensables pour un contrôle réussi des symptômes. Il vaut donc la peine d’examiner de plus près certains aspects du traitement par ces substances.
De nombreux mythes entourent encore l’administration d’opioïdes, non seulement chez les patients, mais aussi chez les médecins. Souvent, l’utilisation de la morphine est assimilée au début de la fin, car la substance est considérée comme une réserve de fer pour la mort. Il est donc nécessaire de discuter avec le patient de l’indication de l’administration d’opioïdes, qui peut être clairement justifiée par le contrôle des symptômes, principalement la douleur ou même la détresse respiratoire. En expliquant en détail le mode d’action et les objectifs de la thérapie, il est possible de motiver des patients plutôt sceptiques à suivre un traitement. Il s’agit notamment d’informer qu’avec une dose stable d’opioïdes, par exemple via un système transdermique, même la conduite automobile n’est pas interdite – à moins que la maladie ne crée d’autres obstacles.
Dépendance : la deuxième crainte porte sur la dépendance. Bien entendu, une dépendance physique se développe sous traitement opioïde, c’est-à-dire que si le besoin d’analgésiques diminue grâce à un traitement causal, une préparation opioïde doit être éliminée progressivement, sinon les symptômes physiques classiques de sevrage apparaissent. Une dépendance psychique ne se développe généralement pas, surtout si le traitement est administré sous forme de préparations retard ou par voie transdermique. La péthidine constitue une exception, une dépendance étant décrite ici, surtout lorsque la substance est administrée par voie intraveineuse. Il est donc recommandé d’éviter l’administration de cette substance. En cas de perte d’efficacité, il faut toujours penser à une progression de la tumeur et réévaluer la possibilité de lutter contre la douleur de manière causale, même dans un contexte palliatif.
le dosage et les effets secondaires : Les médecins, en particulier, qui ne sont pas habitués à manipuler des doses parfois élevées d’opioïdes, craignent le risque de dépression respiratoire. Ce risque n’existe pas si la morphine est utilisée de manière appropriée, car son effet peut être très bien évalué cliniquement. Un exemple de début de traitement par la morphine est présenté dans le tableau 2.

C’est pendant la phase de titration que les effets secondaires indésirables apparaissent en premier, c’est-à-dire que les patients se plaignent de nausées et de constipation, sans qu’aucun effet analgésique ne soit enregistré. C’est souvent le moment où le traitement est interrompu pour cause d’intolérance et d’inefficacité. Après augmentation de la dose, une sédation plus ou moins prononcée se produit avant l’analgésie. Cette dose efficace sur le plan analgésique est appelée “fenêtre thérapeutique” et constitue la dose cible. Malheureusement, la fenêtre thérapeutique n’est pas toujours ouverte de la même manière, de sorte qu’une fois qu’une dose a été déterminée, elle doit toujours être ajustée à la hausse ou à la baisse. Avant d’atteindre la dose critique en termes de dépression respiratoire, des états confusionnels et des symptômes neurologiques, notamment des secousses musculaires, se produisent, de sorte que la dose doit être réduite si ces symptômes apparaissent.
Le choix de l’opioïde en fonction de son élimination, par voie rénale ou hépatique, joue également un rôle. Dans ce cas, il convient d’anticiper les éventuelles complications organiques et de les prendre en compte dans le choix de la préparation. L’oxycodone et l’hydromorphone sont souvent supérieurs aux autres opioïdes à cet égard. En principe, pour la plupart des opioïdes, il n’y a pas de dose maximale limitée vers le haut, mais c’est le contrôle de la douleur qui détermine la quantité. Cependant, surtout avec les agonistes partiels, un effet de plafond peut se produire, c’est-à-dire qu’une augmentation supplémentaire de la dose n’entraîne pas d’augmentation de l’effet. Il est alors recommandé d’effectuer une rotation vers une autre substance. La sécheresse buccale, la rétention urinaire, la constipation et l’orthostatisme ne devraient pas être des facteurs limitant la dose.
Médicaments associés : la question des médicaments associés est souvent controversée. Nous commençons toujours, en plus des opioïdes, par un traitement antiémétique à base de métoclopramide, la substance la plus puissante pour les nausées induites par les opioïdes. Il est possible qu’une partie des patients soit ainsi surtraitée. Cependant, les patients qui éprouvent ce symptôme désagréable ont souvent une telle aversion pour les opioïdes qu’une nouvelle tentative nécessite souvent un long délai, pendant lequel la douleur est mieux supportée que traitée de manière suffisante. En général, les nausées ne sont que passagères et la médication concomitante peut être arrêtée après quelques jours. Cependant, dans certains cas, elle persiste et l’antiémétique doit être maintenu. Parfois, une rotation des opioïdes, c’est-à-dire le passage à une autre substance, est également nécessaire pour contrôler cet effet secondaire.
Malheureusement, la constipation gênante est permanente et nécessite généralement un traitement continu avec des laxatifs, parfois avec plus d’un produit. Dans ce cas, la préparation combinée d’oxycontin et de naloxone peut partiellement faciliter le traitement.
En résumé, dans une situation de douleur progressive, le recours aux opioïdes est souvent inévitable et l’association d’analgésiques de niveau 1 et de comédicaments analgésiques ne constitue pas une alternative au traitement opioïde nécessaire. L’allergie à la morphine est très rare. Les démangeaisons, qui sont un effet des opioïdes en raison de l’irritation des récepteurs correspondants, ne doivent en aucun cas être interprétées à tort comme une allergie. Comme indiqué ci-dessus, l’apparition de nausées n’est pas une allergie.
Une bonne connaissance des substances utilisées est importante pour une thérapie réussie. Il faut connaître la durée d’action, le début de l’effet, un éventuel effet de plafond, les interactions et les effets secondaires. Il est parfois possible de tirer parti de l’effet secondaire pour le traitement, par exemple de la diarrhée. Une prescription correcte à l’hôpital ou à domicile comprend la dose individuelle, la dose quotidienne maximale, la préparation, l’horaire et la dose de réserve pour les douleurs de percée, qui est généralement de 1⁄6-1⁄10 de la dose quotidienne et peut être délivrée jusqu’à toutes les heures, selon la situation. L’objectif est d’obtenir une analgésie avec une intensité de la douleur sur l’échelle VA inférieure à quatre ; si plus de cinq doses de réserve sont administrées par jour, une augmentation de la médication de base est indiquée.
Selon le caractère de la douleur, l’ajout de co-analgésiques est judicieux, par exemple l’utilisation d’antiépileptiques ou d’antidépresseurs en cas de composante neuropathique de la douleur. Si l’œdème est considéré comme co-responsable, l’administration de glucocorticoïdes doit être envisagée et des neuroleptiques ou des myorelaxants sont également utilisés. Cependant, l’utilisation de ces produits est parfois limitée par l’intensification de la fatigue liée au cancer déjà existante.
Les raisons d’un échec du traitement analgésique peuvent être un diagnostic erroné de la douleur ou une sous-estimation de l’intensité de la douleur, un traitement insuffisant des symptômes associés (par ex. anxiété ou dépression), une dose incorrecte, des intervalles trop longs, ou l’évitement de médicaments puissants. Cependant, même si le traitement de la douleur est effectué lege-artis, il existe des échecs thérapeutiques qui justifient le recours à des anesthésistes expérimentés dans le traitement de la douleur. Il peut être nécessaire de recourir à des procédures invasives.
Le premier mot d’ordre doit toujours être la déclaration de Dame Cicley Saunders : “Pain is, what the patient says, it is” (la douleur est ce que le patient dit qu’elle est).
Dr. med. Christel Nigg
Dr. med. Nic Zerkiebel
Littérature :
- Neuenschwander H, et al. : Médecine palliative, Ligue suisse contre le cancer, 2e édition révisée, 2006.
- Beubler E : Kompendium der medikamentösen Schmerztherapie, 4e édition révisée, Springer WienNew York, 2008.
- Gallacchi G, et al. : Compendium de la douleur, 2e édition, Thieme-Verlag, 2005.
- Recommandations Douleur de percée, éd. : Société suisse de médecine et de soins palliatifs, palliative ch palliative.ch 2006.
- Eychmüller St : Sense macht Sinn, Therapeutische Umschau 2012 ; 69(2) : 87-90.
- Büche D. : Assessment et instrument d’évaluation dans les soins palliatifs, Therapeutische Umschau 2012 ; 69(2) : 81-86.
- Stratégie nationale en matière de soins palliatifs 2010-2012, Office fédéral de la santé publique (OFSP) 2009. www.admin.ch/palliativecare
- Critères d’indication pour les soins palliatifs spécialisés www.bundespublikationen.admin.ch
- Antonovsky A : Salutogenèse. Pour démystifier la santé. Édition allemande par Alexa Franke. Éditions dgvt, Tübingen 1997.
- Hydratation en fin de vie, Recommandations Bigorio : Ed. : Société suisse de médecine et de soins palliatifs, palliative ch, 2011.
- Kunz R : Les soins palliatifs une approche globale de la prise en charge, pas une nouvelle spécialité, Bulletin des médecins suisses, 2006 (87) : 1106.
- Académie Suisse des Sciences Médicales ASSM : Soins palliatifs. Directives et recommandations médico-éthiques, 2006.
- Bruera E, et al : The Edmonton Symptom Assessment System (ESAS) : a simple method for the assessment of palliative care patients. J of Palliative Care 1991 (7) : 6-9.
- Saunders C : Cicley Saunders Mourir et vivre : la spiritualité dans les soins palliatifs. Traduit de l’anglais. de Martina Holder-Franz.
InFo Oncologie & Hématologie 2014 ; 2(3) : 10-14











