Une clarification approfondie de la cause des crises d’épilepsie est indispensable pour prendre une décision thérapeutique. Le grand nombre de préparations disponibles permet de personnaliser le traitement pour chaque personne concernée. Le risque de récidive est un facteur déterminant dans la décision d’un traitement précoce.
La pharmacothérapie est la base du traitement de l’épilepsie depuis la découverte des premiers médicaments efficaces contre les crises. Toutes les substances actuellement disponibles ont un effet purement symptomatique de suppression des crises et n’influencent pas la pathophysiologie sous-jacente, c’est pourquoi il convient de parler de médicament anticonvulsivant et non antiépileptique. Cependant, comme toutes les crises d’épilepsie ne se manifestent pas par des “convulsions” – c’est-à-dire des secousses musculaires -, le terme d’anticonvulsivant n’est pas non plus tout à fait approprié. L’Institute of Medicine (IOM) propose d’appeler les substances utilisées pour traiter les crises d’épilepsie des “seizure medication” (médicaments contre les crises) [1].
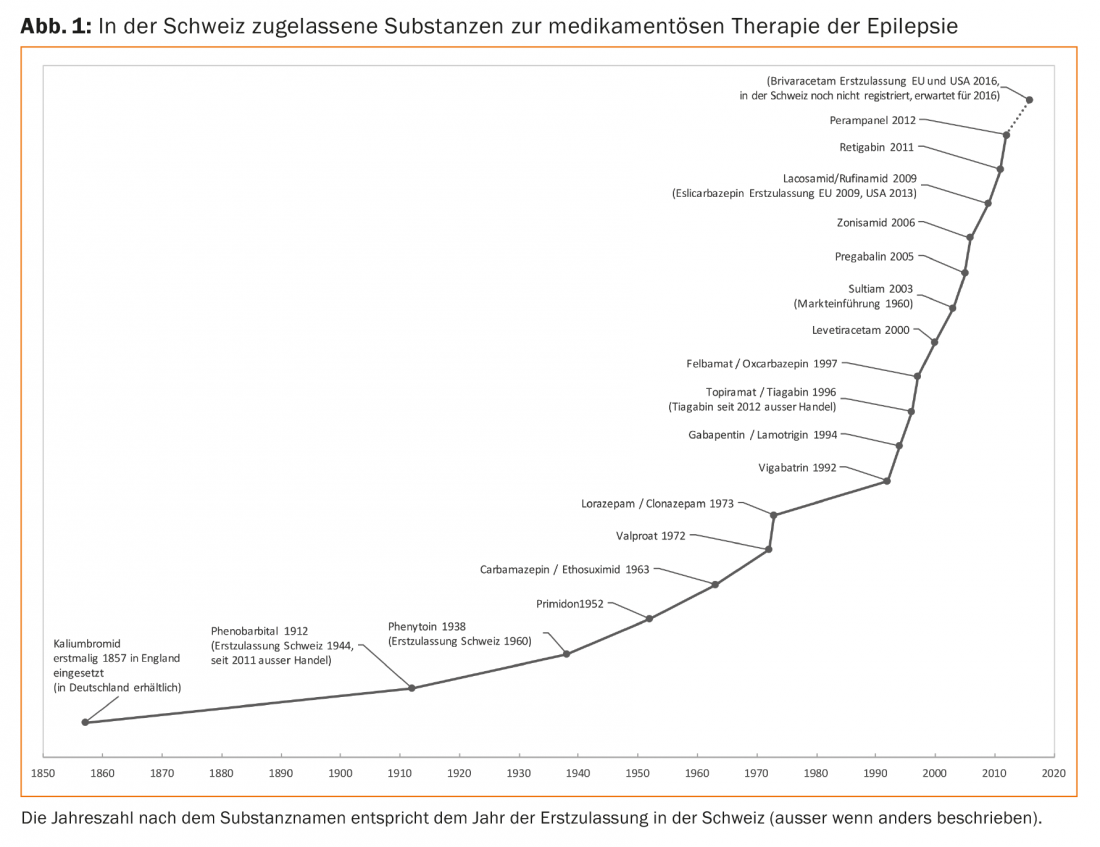
Outre les anciennes substances standard toujours utilisées, telles que la phénytoïne, la primidone, la carbamazépine, l’éthosuximide et l’acide valproïque, d’autres substances sont disponibles (fig. 1). Certains de ces nouveaux médicaments contre les crises sont utilisés depuis longtemps et leurs avantages et inconvénients sont bien connus.
Traitement dès la première crise non provoquée ?
Une clarification approfondie de la cause des crises d’épilepsie est indispensable pour prendre une décision thérapeutique. Selon la dernière classification de l’épilepsie de l’International League Against Epilepsy (ILAE), le diagnostic d’épilepsie peut être posé après une première crise non provoquée si, d’après les résultats des examens correspondants, il existe un risque de récidive d’une autre crise d’au moins 60% en dix ans et que le risque de récidive est donc similaire à celui observé après deux crises non provoquées.
Si le risque de récidive est élevé, un traitement anticonvulsivant peut être instauré dès la première crise non provoquée, conformément aux directives internationales, comme celles de la société allemande de neurologie. Dans l’ensemble, il s’agit toutefois le plus souvent d’une décision thérapeutique individuelle qui tient également compte de l’attitude du patient vis-à-vis des médicaments, de la peur des effets secondaires et également du besoin de sécurité ou de la propension au risque du patient (et de ses proches) [2].
Deux grandes études multicentriques (FIRST – First Seizure Trail Group ; MESS – Multicentre Epilepsy and Single Seizure Study) ont examiné le risque de récidive et le pronostic à long terme en cas de traitement immédiat ou différé des crises [3–6]. Les deux études ont montré que le traitement immédiat après une première crise non provoquée réduisait le risque d’une nouvelle crise de 50 et 30% respectivement ; cependant, la moitié des participants à l’étude n’ont pas eu de deuxième crise. Dans les deux études, un début de traitement précoce n’a pas eu d’effet sur la fréquence des crises après trois et cinq ans.
Selon les données de l’étude MESS, le Number needed to treat (NNT) pour prévenir une nouvelle crise d’épilepsie est de 14 après une première crise et de 5 après une deuxième crise d’épilepsie. Le pronostic thérapeutique à long terme ne se détériore pas si l’on attend une éventuelle deuxième crise d’épilepsie [4,5].
Dans l’ensemble, de nombreuses études ont montré que le risque de récidive est le plus élevé peu après la première crise. 80 à 90% des patients qui continuent à avoir des crises ont une récidive dans les deux premières années. Cependant, les résultats des études actuellement disponibles sont souvent difficiles à appliquer à la pratique clinique quotidienne actuelle, car, par exemple, dans l’essai MESS, l’imagerie structurelle n’a pas été réalisée chez tous les participants à l’étude. C’est ce que demandent aujourd’hui les lignes directrices et c’est aussi une pratique courante, car les lésions cérébrales structurelles entraînent un risque accru de récidive et peuvent donc justifier un traitement anticonvulsivant précoce [7–9].
Les études actuelles ne permettent toutefois pas de recommander de manière générale si un traitement anticonvulsivant est indiqué dès la première crise d’épilepsie. Il existe cependant des résultats d’analyses ou des Diagnostics pour lesquels on doit supposer un risque accru de récidive et qui incitent donc à une pharmacothérapie plus précoce (tab. 1).

Traitement anticonvulsivant de première intention
Il est généralement recommandé de commencer par une monothérapie et de la doser dans un premier temps. Le choix d’un médicament pour le traitement initial n’est pas évident compte tenu du grand nombre de médicaments disponibles. Cependant, certains critères doivent être pris en compte lors de la sélection : Le type de crise, la classification du syndrome épileptique, le sexe, les maladies associées, la médication concomitante et l’urgence du traitement. Au total, environ 60 à 70% des patients adultes ne font plus de crises grâce au premier médicament anticonvulsivant administré. Le choix de la substance doit avant tout tenir compte de la tolérance et de l’influence des comorbidités, car environ 60% des patients doivent prendre les médicaments pour contrôler les crises à vie.
Selon les lignes directrices, tous les anticonvulsivants conviennent à la monothérapie initiale des épilepsies focales, à l’exception de l’éthosuximide, qui n’est utilisé qu’en cas d’épilepsie par absences (crises de petit mal).
Il a été démontré que la lamotrigine et le lévétiracétam ont une efficacité équivalente ; ils sont préférés à la carbamazépine en raison de leur meilleure tolérance [10]. Le lévétiracétam, en particulier, est souvent utilisé en routine clinique, car il ne nécessite pas de longues doses, n’induit pas d’enzymes et entraîne moins d’interactions avec d’autres médicaments. Le lévétiracétam et la lamotrigine ne provoquent généralement pas de crises dans les épilepsies généralisées idiopathiques (EGI), contrairement à la carbamazépine, par exemple. Dans la récente grande étude randomisée et contrôlée SANAD (Standard And New Antiepileptic Drugs), la lamotrigine s’est avérée supérieure à la carbamazépine, à la gabapentine et au topiramate dans les épilepsies focales (bras A) en termes de délai d’arrêt du traitement et d’effets secondaires non tolérables [11]. Dans une autre étude, la prégabaline s’est révélée moins efficace que la lamotrigine en comparaison directe [12].
Le valproate, la lamotrigine et le topiramate, qui ont été comparés dans le bras B de l’étude SANAD, sont notamment adaptés à la monothérapie initiale des épilepsies généralisées ou non classées [13]. Le valproate a montré une meilleure efficacité par rapport à la lamotrigine et une meilleure tolérance par rapport au topiramate. Pour obtenir une absence de crises pendant un an, le topiramate était comparable au valproate.
Traitement des femmes en âge de procréer
Une contraception fiable est indiquée pour les femmes en âge de procréer traitées par anticonvulsivant. Il faut faire attention aux interactions cliniquement significatives entre les contraceptifs et les médicaments contre les crises (par exemple la lamotrigine), car les contraceptifs peuvent diminuer l’effet des médicaments contre les crises, et vice versa. Pour la plupart des nouvelles substances, il n’existe actuellement pas de données suffisantes pour permettre une évaluation définitive d’un éventuel effet sur l’enfant à naître. Une grande étude de registre a montré que les femmes traitées par des médicaments de crise pendant la grossesse n’avaient qu’un très faible risque de malformations congénitales majeures de 4,2% (2-4% de taux de malformation dans la population normale) [14]. Une étude danoise [15] n’a pas montré d’augmentation du risque de malformations congénitales graves en cas de prise d’un nouveau médicament contre les crises pendant la grossesse. Dans une étude publiée en 2014, le topiramate a été associé à un possible retard de croissance plus important chez l’enfant à naître [16].
Le valproate doit être utilisé avec la plus grande prudence chez les femmes en âge de procréer. Les raisons sont le risque tératogène et l’effet négatif sur le développement cognitif à long terme des enfants exposés in utero au valproate [17]. Sur la base des données actuelles, la recommandation est de n’utiliser le valproate qu’en cas de nécessité absolue, et alors sous forme retardée et à la dose la plus faible possible, si possible inférieure à 1000 mg/jour.
Poursuite du traitement après échec du traitement initial
Il y a pharmacorésistance lorsque, après des essais de traitement adéquats avec deux antiépileptiques bien tolérés, appropriés et utilisés à des doses suffisamment élevées (soit en monothérapie, soit en association), aucune absence durable de crises n’est obtenue. Le diagnostic d’épilepsie doit alors être réexaminé de manière critique, par exemple à l’aide d’un vidéo-EEG de 24 heures, et les diagnostics différentiels doivent également être recherchés. Il convient également d’envisager rapidement une éventuelle intervention chirurgicale de l’épilepsie. Les causes possibles de la résistance au traitement sont énumérées dans le tableau 2.

En principe, toutes les substances autorisées sont envisageables pour un traitement combiné. La prudence est de mise en cas d’administration concomitante d’inhibiteurs des canaux sodiques, car cela peut entraîner des effets secondaires plus importants au niveau du système nerveux central. Les nouvelles substances autorisées pour le traitement combiné, dont le mécanisme d’action est en partie différent, comme le lacosamide, le rufinamide, la rétigabine et le pérampanel, laissent espérer que des effets synergiques et additifs permettront, dans certains cas, d’obtenir la disparition des crises en cas de pharmacorésistance.
Utilisation de médicaments génériques
Un traitement initial peut être facilement administré avec un produit générique. En cas d’épilepsie non encore traitée avec succès, des médicaments génériques peuvent également être utilisés ou substitués. En raison de la biodisponibilité variable et du risque accru de crise qui en résulte, le passage du médicament original au médicament générique, du médicament générique au médicament original ou même d’un médicament générique à un autre doit être déconseillé chez les patients ne souffrant pas de crises [18].
Fin de la thérapie
Il existe peu de données fiables sur la question de l’arrêt de la médication en l’absence de crises depuis de nombreuses années. La pratique clinique consiste à poursuivre le traitement tant qu’il n’y a pas d’effets secondaires graves. L’arrêt n’est recommandé que si la situation déclenchant la crise n’est plus présente. En outre, certaines formes d’épilepsie infantile et juvénile peuvent “évoluer”. Avant d’arrêter le traitement, la personne concernée doit être informée des conséquences possibles de l’arrêt du traitement.
Littérature :
- Epilepsy Across the Spectrum : Promoting Health and Understanding – Institute of Medicine [Internet], 2012. www.iom.edu/epilepsy
- Elger CE : Première crise d’épilepsie et épilepsies de l’adulte – Quoi de neuf ? Les principales recommandations en un coup d’œil. Définition et classification 2016 ; 1-23.
- First Seizure Trial Group (FIR.S.T. Group) : Essai clinique randomisé sur l’efficacité des médicaments antiépileptiques dans la réduction du risque de rechute après une première crise tonico-clonique non provoquée. Neurology 1993 ; 43(3 Pt 1) : 478-483.
- Musicco M, et al : Le traitement de la première crise tonico-clonique n’améliore pas le pronostic de l’épilepsie. Premier groupe d’essai sur le seizure. Neurology 1997 ; 49(4) : 991-998.
- Marson A, et al : Traitement médicamenteux antiépileptique immédiat versus différé pour l’épilepsie précoce et les crises uniques : un essai contrôlé randomisé. Lancet 2005 ; 365(9476) : 2007-2013.
- Kim LG, et al : Prediction of risk of seizure recurrence after a single seizure and early epilepsy : Further results from the MESS trial. Lancet Neurol 2006 ; 5(4) : 317-322.
- Eickhoff SB, et al : Connectivité anatomique et fonctionnelle des aires cytoarchitectoniques au sein de l’opercule pariétal humain. J Neurosci 2010 ; 30(18) : 6409-6421.
- Hauser W, et al : Récurrence de l’épilepsie après une première épilepsie non provoquée : un suivi prolongé. Neurology 1990 ; 40(8) : 1163-1170.
- Krumholz A, et al. : Evidence-based guideline : Management of an unprovoked first seizure in adults : Report of the Guideline Development Subcommittee of the American Academy of Neurology and the American Epilepsy Society. Neurology 2015 Oct ; 85(17) : 1526-1527.
- Rosenow F, et al : The LaLiMo Trial : lamotrigine comparée au lévétiracétam dans les 26 semaines initiales de monothérapie pour l’épilepsie focale et généralisée – une étude multicentrique prospective, randomisée et contrôlée en open-label. J Neurol Neurosurg Psychiatry 2012 ; 83(11) : 1093-1098.
- Marson AG, et al : The SANAD study of effectiveness of carbamazepine, gabapentin, lamotrigine, oxcarbazepine, or topiramate for treatment of partial epilepsy : an unblinded randomised controlled trial. Lancet 2007 ; 369(9566) : 1000-1015.
- Kwan P, et al : Efficacité et sécurité de la prégabaline versus lamotrigine chez les patients atteints de seizures partiels nouvellement diagnostiqués : un essai de phase 3, en double aveugle, randomisé, en groupes parallèles. Lancet Neurol 2011 ; 10(10) : 881-890.
- Marson AG, et al : The SANAD study of effectiveness of valproate, lamotrigine, or topiramate for generalized and unclassifiable epilepsy : an unblinded randomised controlled trial. Lancet 2007 ; 369(9566) : 1016-1026.
- Morrow J, et al : Malformation risks of antiepileptic drugs in pregnancy : a prospective study from the UK Epilepsy and Pregnancy Register. J Neurol Neurosurg Psychiatry 2006 ; 77(2) : 193-198.
- Mølgaard-Nielsen D, Hviid A : Médicaments antiépileptiques de nouvelle génération et risque d’anomalies congénitales majeures. JAMA 2011 ; 305(19) : 1996-2002.
- Veiby G, et al : Restriction de la croissance fœtale et défauts d’accouchement avec des médicaments antiépileptiques récents et anciens pendant la grossesse. J Neurol 2014 ; 261(3) : 579-588.
- Meador KJ, et al : Fetal antiepileptic drug exposure and cognitive outcomes at age 6 years (NEAD study) : a prospective observational study. Lancet Neurol 2013 ; 12(3) : 244-252.
- Rueegg S, et al. : Utilisation des antiépileptiques génériques dans le traitement de l’épilepsie – Prise de position de la Ligue suisse contre l’épilepsie (LSCE). Schweizer Arch für Neurol und Psychiatr 2012 ; 163(3) : 104-106.
InFo NEUROLOGIE & PSYCHIATRIE 2016 ; 14(3) : 8-11