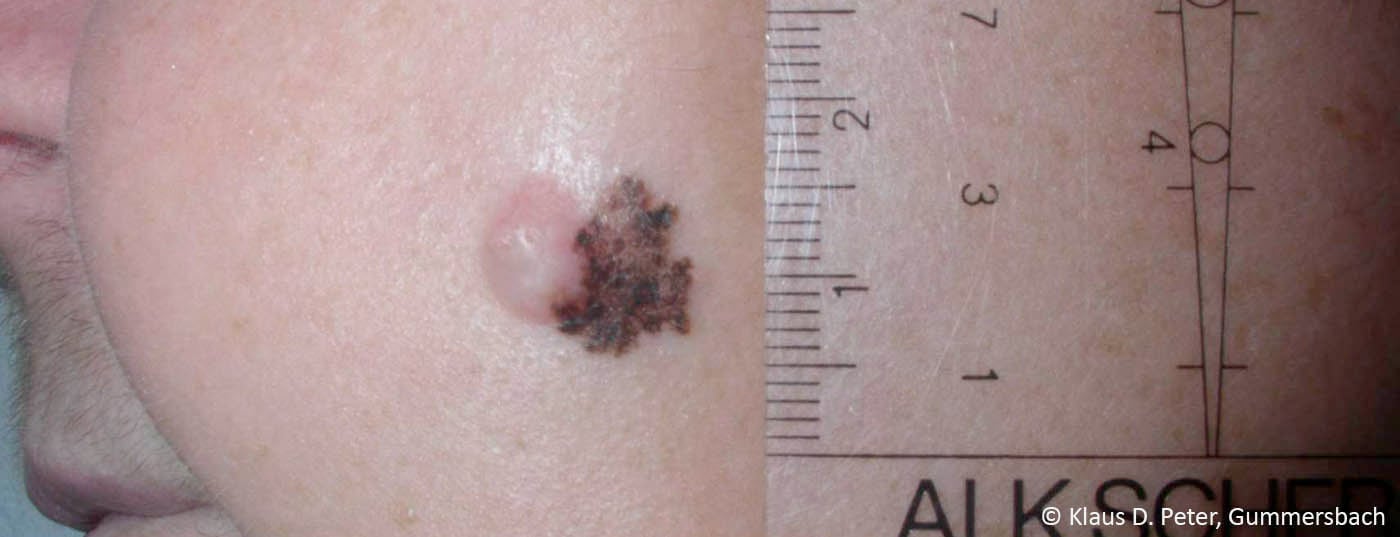
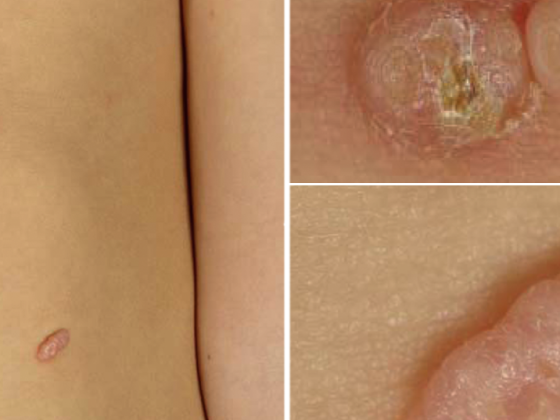
Les nouvelles découvertes en biologie et immunologie des tumeurs ainsi qu’en pathologie moléculaire ont permis de faire progresser rapidement le développement d’anticorps immunomodulateurs et d’agents thérapeutiques dits “ciblés” [1]. Le traitement du mélanome avancé devient ainsi un défi interdisciplinaire. Le traitement moderne du mélanome avancé est donc de plus en plus personnalisé et s’oriente également sur le statut mutationnel de la tumeur.
La résection chirurgicale reste une option valable en cas de métastases d’organes solitaires et peut permettre une survie sans récidive pendant de nombreuses années, tout comme la perfusion lourde des extrémités avec des cytostatiques et de l’interféron-α. Diverses chimiothérapies, en particulier pour les mélanomes sans mutation à visée thérapeutique, comprennent par exemple la dacarbacine, la vinblastine, le cisplatine, le taxol et la bléomycine, et parfois le tamoxifène comme hormonothérapie. Les taux de réponse modérés se font au détriment de la toxicité, sans affecter significativement la survie globale. Le témozolomide, un alkylant dont le taux de réponse est comparable à celui de la dacarbazine, peut être fréquemment utilisé pour traiter les métastases cérébrales en raison de son passage dans le LCR, même si moins de 10% des patients répondent de manière objectivable à ce traitement.
Immunothérapies
En raison de la nature antigénique et immunogène du mélanome malin, différentes tentatives de traitement par des substances immunomodulatrices ont été menées depuis longtemps. Outre les vaccins peptidiques (souvent avec adjuvant oligonucléotidique CpG), des cytokines (par exemple l’IL-2 recombinante) sont testées et des méthodes d’immunothérapie telles que le transfert adoptif de cellules T avec des TIL (lymphocytes infiltrant la tumeur) et des lymphocytes du sang périphérique (PBL) ou des cellules T génétiquement modifiées “engineered” (“chimeric antigen receptor” et TCR) sont développées. L’IL-2 à haute dose (et la combinaison d’IL-2 et de gp100) a permis d’obtenir des rémissions de longue durée chez un petit nombre de patients, mais elle est principalement établie aux États-Unis [2]. Plusieurs études sont actuellement en cours sur le transfert adoptif de cellules T et les cellules modifiées par TCR, ainsi que sur les blocages de points de contrôle.
Anticorps CTLA-4 : la méthode de blocage des points de contrôle (par exemple le blocage CTLA-4) a permis avec succès d’identifier de nouvelles cibles pour un traitement immunomodulateur. L’antigène 4 associé aux lymphocytes T cytotoxiques (CTLA-4) entre en compétition avec CD28 pour se lier aux cellules présentatrices d’antigènes, ce qui entraîne l’inhibition des signaux de costimulation de l’activation des lymphocytes T. Les cellules de l’antigène 4 se lient aux cellules de l’antigène 4, ce qui entraîne l’inhibition des signaux de costimulation de l’activation des cellules de l’antigène 4. Mais si CTLA-4 est bloqué par un anticorps monoclonal IgG1 humain spécifique comme l’ipilimumab, un “frein” des cellules de défense de l’organisme est levé et la réponse tumorale médiée par les cellules T est renforcée. L’ipilimumab (Yervoy®) est le premier anticorps dirigé contre CTLA-4 à avoir démontré une survie significativement prolongée, même en combinaison avec un vaccin peptidique gp100 (survie médiane de 10,1 contre 6,4 Monte pour le contrôle vaccinal), et a été approuvé par l’EMA pour le traitement du mélanome métastatique depuis 2011 [3]. De même, l’association de la dacarbacine et du blocage de CTLA-4 a entraîné des rémissions complètes durables (taux de survie à 3 ans d’environ 20%) et offre pour la première fois la perspective d’une survie à long terme malgré un faible taux de réponse (environ 15%). Comme la réponse à l’ipilimumab ne peut survenir que douze semaines après le début du traitement et que le médicament induit parfois de graves effets secondaires à médiation immunitaire, le fait qu’aucun marqueur pronostique ne permette à ce jour de sélectionner les patients constitue un inconvénient. Il est donc important de poser un diagnostic précoce et de gérer en temps utile les effets secondaires des entérocolites, hépatites, thyroïdites, hypophysites, névrites et dermatites auto-immunes, qui sont fréquentes (tableau 1).
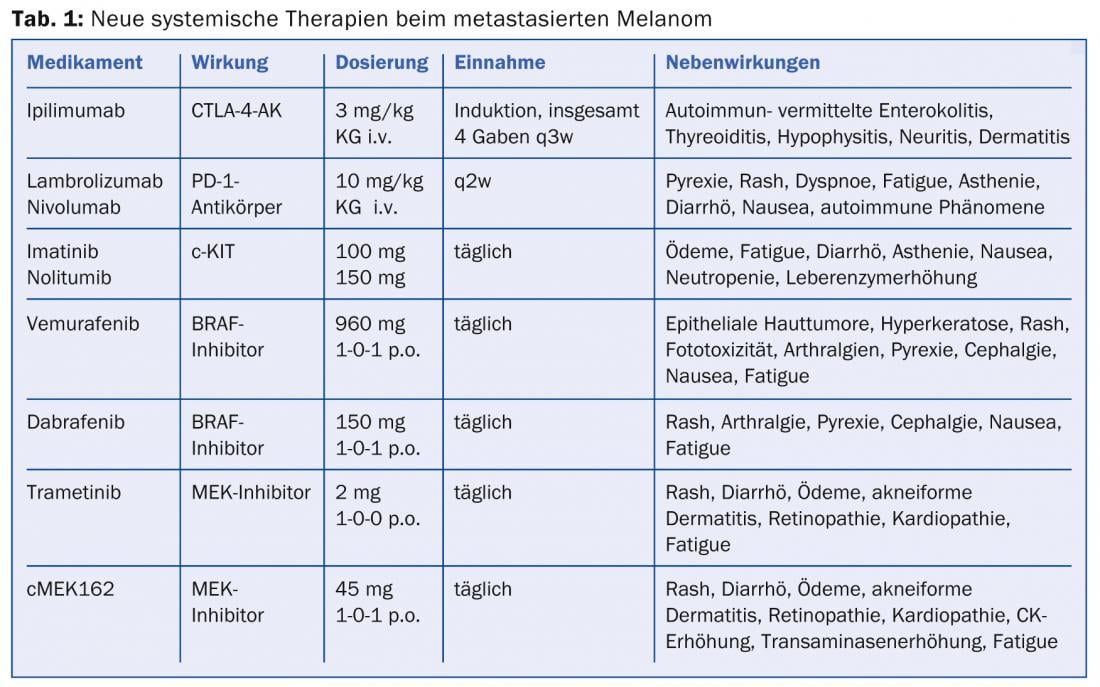
Anticorps PD-1 et PD-L1 (PD-1 et PD-L1-AK) : dans le but d’optimiser davantage la réponse immunitaire endogène contre les cellules tumorales, des anticorps inhibant le récepteur inhibiteur “Programmed Death 1” (PD-1) à la surface des lymphocytes T activés ont été récemment développés. En effet, si la prolifération des cellules T est inhibée par la liaison du ligand-1 du PD au récepteur PD-1 du lymphocyte T, les anticorps anti-PD-1 lambrolizumab et nivolumab, en cours d’essai depuis 2013, peuvent lever cette restriction de la “phase effectrice”. Les résultats des premières études sur le nivolumab ont montré une réponse remarquable chez 31% des patients atteints de mélanome prétraités [4]. Tout comme le blocage du CTLA-4, les anticorps anti-PD-1 induisent des rémissions stables avec toutefois beaucoup moins d’effets secondaires liés à l’auto-immunité. De plus, une réponse est généralement observée quelques semaines après le début du traitement, l’expression du ligand PD-1 à la surface des cellules tumorales étant soupçonnée d’être un biomarqueur prédictif possible. Le lambrolizumab et les anticorps directs contre le ligand PD-1 (PD-L1-AK) sont actuellement en phase de test clinique. L’utilisation simultanée d’anticorps bloquant le CTLA-4 et le PD-1 présente en outre des effets synergiques.
Traitement ciblé sur la base du statut de la mutation
Au cours de la dernière décennie, les méthodes moléculaires et l’analyse des mutations ont permis d’identifier plusieurs interfaces pour un traitement innovant du mélanome métastatique. La mutation la plus fréquente (environ 50%) dans les cellules de mélanome est une mutation ponctuelle dans le gène codant pour la kinase BRAF. BRAF est une kinase importante dans la voie de signalisation MAPK (“Mitogen-Activated Protein Kinase”) et est en partie responsable de la prolifération et de la croissance des cellules tumorales. Les mutations activatrices du gène BRAF V600 entraînent une suractivation de cette voie de signalisation, ce qui se traduit par une croissance cellulaire excessive. Des mutations de NRAS, une kinase située en dessous de BRAF, sont également présentes chez jusqu’à 20% des patients atteints de mélanome et conditionnent, comme BRAF, une aggravation du pronostic. Une autre mutation plutôt rare ayant des conséquences thérapeutiques concerne la tyrosine kinase c-KIT, qui apparaît principalement dans les mélanomes muqueux et acraux. Les patients présentant une mutation c-KIT dans l’exon 11 ou 13 répondent le mieux au traitement par un inhibiteur de c-KIT kinase tel que l’imatinib ou le nilotinib (essai TEAM). Les effets secondaires fréquents du traitement sont l’œdème, la fatigue, la diarrhée, la perte d’appétit, la nausée, la neutropénie et l’augmentation des enzymes hépatiques.
Inhibiteurs de BRAF
La mutation V600 de BRAF a également été identifiée comme prédictive d’un point de vue thérapeutique dans 40-50% des tumeurs. Le vémurafénib (Zelboraf®), premier inhibiteur de BRAF testé cliniquement, a donné lieu à des taux de réponse élevés chez les patients naïfs de traitement présentant une mutation V600E avérée, avec respectivement 5,6 réponses complètes et 1 réponse complète. 51,3% de rémissions partielles et une survie globale médiane de 13,2 mois (mise à jour de l’étude BRIM-3) [5]. La réponse clinique se traduit généralement par une réduction rapide de la tumeur, mais des mois plus tard, le développement d’une résistance est fréquent en raison de la réactivation de la voie de signalisation MAPK ou de la régulation à la hausse des voies de signalisation alternatives.
Un autre inhibiteur de BRAF est le dabrafenib (Tafinlar®), qui a depuis été approuvé (étude BREAK-3) pour le traitement de première ligne du mélanome BRAF V600E positif non résécable ou métastatique [6,7]. Le fait qu’une réponse tumorale efficace sous dabrafenib soit observée pendant huit mois en moyenne chez une grande partie des patients concernés améliore à la fois la qualité de vie et de manière significative la durée de survie attendue et représente une nouvelle expérience dans le traitement du mélanome avancé. L’étude BREAK-MB a également montré que les patients atteints de métastases cérébrales bénéficient d’un traitement par dabrafenib qui double au moins leur durée de survie, par ailleurs très courte. Les risques liés à l’utilisation de l’inhibiteur de BRAF incluent parfois l’apparition de nouvelles tumeurs cutanées, raison pour laquelle les patients doivent être contrôlés régulièrement pour détecter de telles tumeurs. D’autres effets secondaires tels que les toxicités de la peau et des muqueuses, les infections, les modifications de l’ECG et des électrolytes ainsi que les modifications de la glycémie peuvent nécessiter l’interruption du traitement. La prudence est également de mise en cas d’association avec des médicaments qui influencent l’activité enzymatique du CYP3A4 ou du CYP2C8 et le pH gastrique, ainsi qu’en cas d’administration concomitante de warfarine ou de digoxine.
Inhibiteurs MEK
Située en aval du RAS-RAF, la kinase MEK (isoformes MEK1/2) peut être activée soit par des mutations, soit par des facteurs de croissance autocrines, ce qui en fait l’un des sites centraux de la chaîne de signalisation MAPK. Le tramétinib, un inhibiteur MEK1/2 hautement sélectif, a montré une amélioration significative de la survie sans progression (PFS : 4,8 vs. 1,5 mois) et de la survie globale chez les patients porteurs d’une mutation BRAF V600E ou V600K par rapport à la chimiothérapie (étude METRIC) [8]. Jusqu’à présent, on n’a pas observé de développement de carcinomes épidermoïdes sous trametinib, comme c’est souvent le cas avec les inhibiteurs de BRAF. Dans une autre étude, le trametinib a également montré une efficacité sur les mélanomes présentant des mutations rares de BRAF [9]. Un autre inhibiteur puissant et sélectif de MEK1/2, cMEK162, est actuellement en essai de phase II. Les premiers résultats du cMEK162 chez des patients atteints de mélanome non traité avec un mélanome muté BRAF ou NRAS ont montré de bons résultats comparables pour les deux groupes (PFS 3,7 vs. 3,6 mois), de sorte qu’une approche thérapeutique semble pour la première fois possible pour les patients dont les tumeurs présentent une mutation NRAS [10].
Combinaison des inhibiteurs de BRAF et de MEK
En raison de l’évolution observée de la résistance, la combinaison d’un inhibiteur de BRAF et d’un inhibiteur de MEK a également été testée entre-temps dans le cadre d’une étude de phase I/II. Après une étude initiale de détermination de la dose, le dabrafenib a été administré à des patients présentant une mutation V600 à raison de 150 mg 2×/jour. plus tramétinib 1 mg ou 2 mg par jour ou, à titre de comparaison, dabrafenib en monothérapie (150 mg 2×/jour) [11]. L’association avec la dose plus élevée de trametinib a montré une PFS significativement prolongée de 3,6 mois par rapport à la monothérapie par dabrafenib, 41% des patients du bras combiné étant toujours exempts de progression à 12 mois. Les effets indésirables les plus fréquents (71%) ont été la pyrexie (38,5°) et les frissons sous l’association à forte dose (tableau 1). Ces effets secondaires ont été moins fréquents (environ 66%) avec le dabrafenib en monothérapie. Comme nous l’espérions, le traitement combiné a également permis de réduire le nombre de tumeurs cutanées secondaires.
PD Dr. med. Andreas Trojan
Littérature :
- Dummer R, et al : Cutaneous melanoma : ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up ; ESMO Guidelines Working Group. Ann Oncol 2012 Oct ; 23 Suppl 7.
- Smith FO, et al : Treatment of metastatic melanoma using interleukin-2 alone or in conjunction with vaccines. Clin Cancer Res 2008 ; 14(17) : 5610-5618.
- Hodi FS, et al : Amélioration de la survie avec l’ipilimumab chez les patients atteints de mélanome métastatique. N Engl J Med 2010 ; 363(8) : 711-723.
- Topalian SL, et al : Survival, durable tumor remission, and long-term safety in patients with advanced melanoma receiving nivolumab. J Clin Oncol 2014 Apr 1 ; 32(10) : 1020-1030.
- McArthur GA, et al. : Sécurité et efficacité du vémurafénib dans le mélanome à mutation BRAF(V600E) et BRAF(V600K) positive (BRIM-3) : suivi étendu d’une étude de phase 3, randomisée, en ouvert. Lancet Oncol 2014 Mar ; 15(3) : 323-332.
- Ascierto PA, et al : Phase II trial (BREAK-2) of the BRAF inhibitor dabrafenib (GSK2118436) in patients with metastatic melanoma. J Clin Oncol 2013 Sep 10 ; 31(26) : 3205-3211.
- Hauschild A, et al : Dabrafenib in BRAF-mutated metastatic melanoma : a multicentre, open-label, phase 3 randomised controlled trial. Lancet 2012 Jul 28 ; 380(9839) : 358-365.
- Flaherty KT, et al : Improved survival with MEK inhibition in BRAF-mutated melanoma. N Engl J Med 2012 ; 367(2) : 107-114.
- Kim KB, et al : Étude de phase II du tramétinib, inhibiteur de MEK1/MEK2, chez des patients atteints de mélanome cutané BRAF-mutant métastatique, précédemment traités avec ou sans inhibiteur de BRAF. J Clin Oncol 2013 ; 31(4) : 482-489.
- Ascierto PA, et al : MEK162 for patients with advanced melanoma harbouring NRAS or Val600 BRAF mutations : a non-randomised, open-label phase 2 study. Lancet Oncol 2013 ; 14(3) : 249-256.
- Flaherty KT, et al : Combined BRAF and MEK inhibition in melanoma with BRAF V600 mutations. N Engl J Med 2012 ; 367(18) : 1694-1703.
CONCLUSION POUR LA PRATIQUE
- Avec l’approbation de l’ipilimumab (Yervoy®) et du vémurafénib (Zelboraf®), la recherche immunologique et moléculaire a été transposée avec succès dans le domaine clinique.
- L’ipilimumab entraîne souvent des rémissions de longue durée avec un taux de réponse nettement plus faible.
- Dans le domaine des substances immunomodulatrices, les anticorps anti-PD-1 et les combinaisons d’anticorps anti-CTLA-4 et anti-PD-1 font l’objet d’essais cliniques prometteurs.
- Malgré un début d’action rapide et des taux de réponse élevés, les inhibiteurs de BRAF développent souvent une résistance, contre laquelle des combinaisons avec, par exemple, des inhibiteurs de MEK pourraient être utilisées avec succès à l’avenir.
A RETENIR
- Avec l’autorisation de mise sur le marché de l’ipilimumab (Yervoy®) et du vémurafénib (Zelboraf®), la recherche immunologique et moléculaire a été appliquée avec succès à la clinique.
- L’ipilimumab permet des rémissions souvent prolongées avec un taux de réponse nettement plus faible.
- Dans le domaine des substances immunomodulatrices, les anticorps anti-PD-1 ainsi que des combinaisons d’anticorps anti-CTLA-4 et anti-PD-1 vont être testés cliniquement avec de grands espoirs.
- Malgré une apparition rapide de l’effet et des taux de réponse élevés, une résistance se développe fréquemment avec les inhibiteurs de BRAF, contre lesquelles des combinaisons par exemple avec des inhibiteurs de MEK pourront être utilisées efficacement à l’avenir.
DERMATOLOGIE PRATIQUE 2014 ; 24(3) : 16-20