Le traitement systémique du carcinome des cellules rénales est en pleine évolution. Plusieurs inhibiteurs de tyrosine kinase peuvent prolonger de manière significative la survie dans les stades métastatiques. Les immunothérapies sont également efficaces.
Le carcinome des cellules rénales représente environ 2 à 3 % de toutes les tumeurs malignes. L’incidence mondiale est estimée à 338 000 cas en 2012 pour 144 000 décès liés à la tumeur. Le carcinome des cellules rénales est donc le 13e cancer le plus fréquent au monde [1–3] . Il s’agit de la troisième tumeur urologique la plus fréquente après le cancer de la prostate et le carcinome urothélial de la vessie. Le terme “tumeur rénale” englobe un large éventail de tumeurs hétérogènes ainsi que différentes entités histopathologiques. Les trois sous-types les plus fréquents sont le carcinome rénal à cellules claires, le carcinome rénal papillaire et le carcinome rénal chromophobique, qui représentent ensemble environ 85-90% de toutes les tumeurs malignes du rein et dont le sous-type à cellules claires a le plus mauvais pronostic [4]. Dans environ 10 à 15% des cas, les tumeurs rénales sont bénignes [5]. Les tumeurs rénales bénignes les plus fréquentes sont l’oncocytome et l’angiomyolipome.
Épidémiologie
L’âge principal de survenue du carcinome des cellules rénales se situe entre 60 et 70 ans [5,6]. Les hommes sont plus souvent touchés que les femmes, dans une proportion d’environ 1,5 pour 1. Les facteurs de risque sont le tabagisme, l’obésité, l’hypertension et l’insuffisance rénale chronique [5,6]. Une petite partie des carcinomes des cellules rénales sont héréditaires, et il convient de mentionner dans ce contexte le syndrome de Von Hippel-Lindau (VHL), la sclérose tubéreuse et le syndrome de Birt-Hogg-Dubé.
Diagnostic
De nos jours, la plupart des carcinomes des cellules rénales sont diagnostiqués de manière incidente, c’est-à-dire comme une découverte fortuite lors d’un examen d’imagerie avec une autre question médicale, et sont asymptomatiques au moment du diagnostic initial. Les tumeurs rénales étant ainsi plus souvent diagnostiquées à un stade précoce qu’auparavant, on a assisté au cours des dernières décennies à ce que l’on appelle un “stage shift” [5,6]. La triade classique de symptômes comprenant des douleurs au flanc, une macrohématurie et une tumeur abdominale palpable n’est plus que très rarement observée. Toutefois, si ces symptômes locaux sont présents, il s’agit généralement d’une maladie tumorale déjà localement avancée et métastasée, avec un mauvais pronostic consécutif. L’examen physique général ne joue qu’un rôle mineur dans le diagnostic du carcinome des cellules rénales. Toutefois, l’apparition récente de varicocèles ou d’œdèmes des membres inférieurs peut être le signe d’une masse rétropéritonéale, qui doit donc être exclue par l’imagerie [6]. Les tumeurs rénales peuvent provoquer différents symptômes paranéoplasiques [6].
Les résultats anormaux de l’échographie rénale doivent être examinés plus en détail à l’aide d’une tomodensitométrie (TDM) multiphasique avec contraste de l’abdomen ou d’une IRM. Dans certains cas spécifiques, une échographie renforcée par un agent de contraste peut être utile [5]. Les lésions spatiales du rein sont généralement divisées en lésions solides et kystiques. Les lésions kystiques sont classées en cinq catégories (I, II, IIF, III, IV) pour l’évaluation de la valeur intrinsèque au scanner, selon la classification de BOSNIAK [7,8]. Les résultats des catégories III et IV sont considérés comme malins jusqu’à preuve du contraire, une clarification histologique est donc indiquée. Dans le cas de lésions solides du rein, l’image locale du produit de contraste appliqué (KM) est un critère important de malignité [5].
Le scanner ou l’IRM permettent d’évaluer la localisation exacte de la tumeur (centrale, périphérique, proche du hile ou du pyélon, etc.), l’extension locale de la tumeur, une éventuelle atteinte vasculaire (par ex. thrombus tumoraux dans la veine rénale et la veine cave) ainsi que des hypertrophies suspectes des ganglions lymphatiques, de sorte qu’il est possible de procéder à un staging précis selon la classification TNM actuelle (tableau 1) [5,6]. Le diagnostic par imagerie peut poser des difficultés pour distinguer les angiomyolipomes sans graisse et les oncocytomes des processus malins [9]. En cas de suspicion confirmée de carcinome rénal, un scanner thoracique complémentaire doit être réalisé pour exclure la présence de métastases pulmonaires [5].

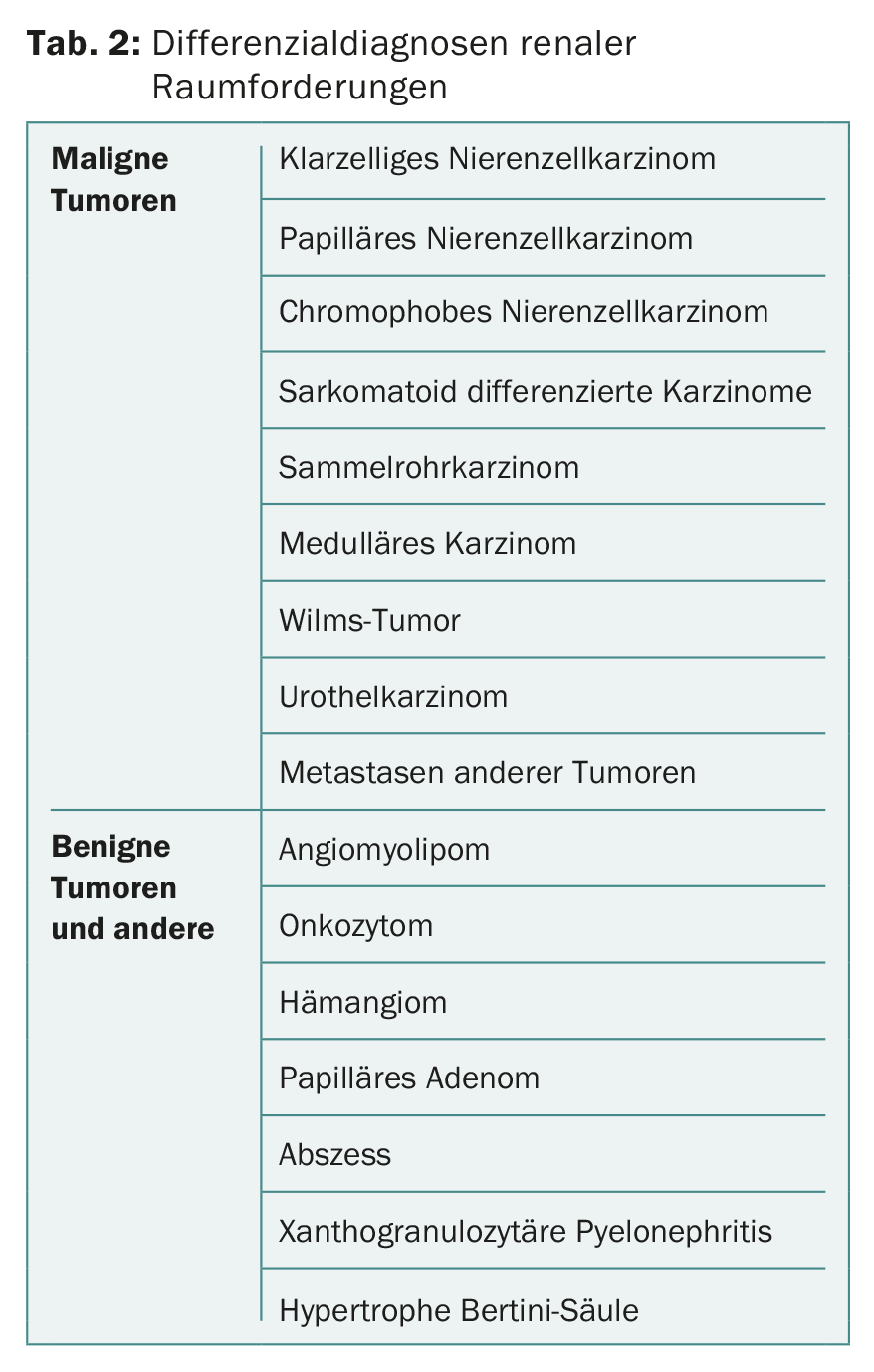
Alors que la biopsie percutanée de tumeurs rénales était autrefois considérée comme pratiquement contre-indiquée en raison de la crainte de métastases par voie piquante, elle est aujourd’hui de plus en plus souvent pratiquée. La biopsie a sa place notamment en cas de lésions radiologiquement peu claires, de petites tumeurs rénales avant l’inclusion dans une stratégie de surveillance active, avant un traitement ablatif local ou en cas de tumeur métastatique pour l’obtention d’histologie [5,6,9]. Dans le cas des tumeurs rénales métastasées, cela permet de choisir un traitement systémique adapté. La biopsie d’une tumeur rénale permet également de distinguer les métastases d’autres tumeurs primaires. Une biopsie peut être réalisée soit par échographie, soit par scanner. Les diagnostics différentiels possibles des lésions rénales sont présentés dans le tableau 2.
Classification des stades
La classification clinique des stades du carcinome des cellules rénales se fait selon la classification TNM actuelle (tableau 1) [5,10]. Le système de classification WHO/ISUP (World Health Organization/International Society or Urological Pathology) remplace la classification histologique analogue à celle de Fuhrmann, développée dans les années 1980 et la plus répandue au niveau international [5,11,12].
Thérapie chirurgicale
Le traitement standard du carcinome des cellules rénales est généralement l’ablation chirurgicale complète de la tumeur [9]. Dans le cas d’un carcinome rénal localisé, l’intention est curative. Historiquement, la néphrectomie radicale a longtemps été le gold standard [6]. Aujourd’hui, en fonction de la localisation et de la taille de la tumeur rénale, il convient d’opter pour une technique chirurgicale permettant d’épargner le néphron, au sens d’une résection partielle du rein. La survie spécifique à la tumeur dans le carcinome rénal localisé semble être comparable après résection partielle du rein et néphrectomie [5]. Des données rétrospectives indiquent que la survie globale après résection partielle du rein est meilleure qu’après néphrectomie en cas de carcinome rénal localisé [5, 13-15].
Les lignes directrices actuelles de l’EAU recommandent la réalisation d’une résection partielle du rein en cas de carcinome rénal de stade T1 [5]. Elle peut en principe être réalisée par voie ouverte, laparoscopique ou robotisée. Au stade T2, la néphrectomie laparoscopique est recommandée si la réalisation d’une résection partielle du rein n’est pas possible [5].
La surrénalectomie ipsilatérale de routine ne semble pas apporter de bénéfice en termes de survie et n’est donc pratiquée qu’en cas de suspicion d’infiltration tumorale [5]. Les métastases des ganglions lymphatiques (pN+) sont associées à un mauvais pronostic. Les données relatives à l’importance de la lymphadénectomie sont toutefois controversées. Actuellement, selon les directives actuelles de l’EAU, une lymphadénectomie n’est recommandée qu’en cas de suspicion clinique de métastases ganglionnaires (cN+) [5]. Si les ganglions lymphatiques sont cliniquement normaux, elle peut être envisagée pour les tumeurs de grande taille ou à différenciation sarcomatoïde. Dans le cas d’un carcinome rénal déjà métastasé, une néphrectomie cytoréductrice peut être proposée aux patients avant l’introduction d’un traitement systémique, en particulier pour les tumeurs rénales de grande taille [5].
Alternatives à la chirurgie
Chez les patients âgés présentant des comorbidités importantes et/ou une espérance de vie limitée, des alternatives à la chirurgie peuvent être discutées en cas de carcinome localisé des cellules rénales. En particulier, les petites tumeurs rénales diagnostiquées de manière incidente peuvent être surveillées régulièrement par imagerie chez ces patients (surveillance active) [5,9]. Le taux de croissance de telles lésions spatiales et le risque de progression vers le stade métastatique sont faibles [5,6]. Initialement, une confirmation histologique du diagnostic par une biopsie de la tumeur rénale peut être utile dans le cadre de cette approche [6]. Des déclencheurs clairs pour le passage à un traitement actif ne sont pas définis. Des options thérapeutiques peu invasives telles que la cryoablation ou l’ablation par radiofréquence (RFA) peuvent également être discutées sur un groupe de patients sélectionnés [5,6]. Ces procédures sont réalisées par voie percutanée ou assistée par laparoscopie. Les données actuelles ne permettent pas encore d’évaluer définitivement ces traitements en termes de contrôle tumoral et de morbidité. Dans le cas de tumeurs rénales inopérables, symptomatiques par exemple de douleurs des flancs ou de macrohématurie, une embolisation artérielle sélective peut être envisagée [5].
Traitement systémique du carcinome des cellules rénales
Le traitement systémique du carcinome rénal à cellules claires avancé s’est heureusement beaucoup amélioré au cours des dernières années. Il répond mal à la chimiothérapie, mais on sait depuis longtemps que les réactions immunologiques jouent un rôle. On peut ainsi observer des stabilisations prolongées et même des régressions de métastases pulmonaires ou ganglionnaires après l’ablation de la tumeur primaire. Chez 9% des patients atteints de carcinome rénal métastatique, un traitement par interféron alpha peut entraîner des rémissions, mais avec une toxicité considérable. Ce dernier est encore nettement plus élevé avec les traitements à l’interleukine 2, mais des rémissions impressionnantes et durables sur plusieurs années peuvent être observées chez environ 10% des patients.
Dans plus de 80% des carcinomes rénaux à cellules claires, il existe une modification bi-allélique du gène VHL dans la tumeur, ce qui entraîne une augmentation de la production de VEGF (“vascular endothelial growth factor”), qui est un facteur de croissance important. Plusieurs inhibiteurs de tyrosine kinase peuvent inhiber les récepteurs du VEGF (ainsi que d’autres récepteurs) et se sont révélés être des médicaments efficaces dans le carcinome métastatique des cellules rénales. Ils ont majoritairement remplacé les médicaments susmentionnés.
En première ligne de traitement, les principaux choix actuels sont le sunitinib par voie orale et le pazopanib, qui n’est pas moins efficace mais un peu moins toxique. Dans des études randomisées, le sunitinib a montré une réponse de 31% contre 6% pour l’interféron alpha, le standard de l’époque, et un allongement jusqu’à la progression de la tumeur de cinq à onze mois. La survie a également été prolongée de 4,6 mois – à 26,4 mois. Les effets secondaires peuvent être la diarrhée, l’hypertension, la fatigue, des réactions cutanées, des cheveux blancs et des dysfonctionnements de la thyroïde, ainsi que des troubles cardiaques. Selon une nouvelle étude de phase II, le cabozantinib pourrait être plus efficace que le sunitinib dans le traitement de première ligne, mais cela doit être confirmé par une étude de phase III avant de devenir la nouvelle norme.
Le mécanisme d’action mentionné ci-dessus explique également l’efficacité du bevacizumab, un anticorps monoclonal qui se lie au VEGF. L’association avec l’interféron alpha est autorisée dans le traitement de première ligne.
Selon les données de l’étude, l’évérolimus, un inhibiteur de mTOR, est une autre option pour les cancers des cellules rénales dont le pronostic est moins bon. Les effets secondaires possibles sont la stomatite et les effets secondaires hématologiques. L’une des indications de l’évérolimus est l’échec d’un traitement basé sur les anti-VEGF.
Un inhibiteur de tyrosine kinase peut également être utilisé en deuxième ligne de traitement (comme l’axitinib ou le sorafenib). Le cabozantinib, un inhibiteur de tyrosine kinase, a permis de prolonger significativement la survie en deuxième ligne par rapport à l’évérolimus (21,4 contre 16,5 mois) [16]. L’association du lenvatinib avec l’évérolimus a même permis de prolonger la survie de dix mois dans une étude de phase II.
Des données récentes et intéressantes montrent parfois de très bons résultats avec l’immunothérapie (inhibiteurs de points de contrôle). Une étude de phase III sur le nivolumab en deuxième ligne de traitement a montré une augmentation de la survie moyenne de 5,4 mois par rapport à l’évérolimus, pour atteindre 25 mois, et un taux de réponse plus élevé de 25% vs 5% [17]. Un autre avantage de cette thérapie est également sa toxicité généralement beaucoup plus faible, dont différentes maladies auto-immunes. Cependant, nous avons nous-mêmes vu des patients présentant des effets secondaires graves (par exemple une maladie rhumatismale invalidante de type polymyalgia rheumatica qui a duré plusieurs mois). Récemment, il a été démontré (CHECKMATE-214 à l’ESMO 2017) qu’une immunothérapie combinée par nivolumab et ipilimumab était supérieure au sunitinib en première ligne, en particulier en cas d’expression de PD-L1, avec une réponse plus élevée de 58% vs 25% et un temps prolongé jusqu’à la progression de la tumeur de 22,8 vs 5,9 mois. Les immunothérapies font donc leur entrée dans le traitement de première ligne grâce à ces données récentes. Cette supériorité par rapport au sunitinib ne s’applique toutefois pas aux patients du groupe de bon pronostic.
Le choix du traitement de troisième ligne résulte des traitements précédents et de leur succès.
Traitement adjuvant
Les études sur le traitement adjuvant après un carcinome rénal opéré et en cas de risque élevé de récidive avec différentes substances ont été négatives et controversées pendant des années. Des données récentes [18] montrent que le sunitinib administré pendant un an en traitement adjuvant dans les situations à haut risque peut augmenter le délai avant une récidive de 5,6 à 6,8 ans. Toutefois, il s’agit pour l’instant d’un traitement hors étiquette.
Messages Take-Home
- L’âge principal de survenue du carcinome des cellules rénales se situe entre 60 et 70 ans.
- En fonction de la localisation et de la taille de la tumeur rénale, il convient d’opter, dans la mesure du possible, pour une technique chirurgicale épargnant les néphrons.
- La biopsie percutanée des tumeurs rénales est de plus en plus fréquente de nos jours.
- Le traitement systémique du carcinome des cellules rénales est en pleine évolution grâce à de nouveaux médicaments et à de nouvelles combinaisons. Plusieurs inhibiteurs de tyrosine kinase peuvent prolonger de manière significative la survie dans les stades métastatiques. Les immunothérapies (inhibiteurs de points de contrôle) sont également efficaces dans les stades métastatiques.
- En cas de risque élevé de récidive, un traitement adjuvant est une option.
Littérature :
- Torre LA, et al : Global Cancer Statistics, 2012. CA : A Cancer J Clin 2015 ; 65(2) : 87-108.
- Ferlay J, et al. : Cancer incidence and mortality worldwide : Sources, methods and major patterns in GLOBOCAN 2012. Int J Cancer 2015 ; 136(5) : 359-386.
- Réseau européen des registres du cancer : Kidney cancer (KC) Factsheet. Février 2017. www.encr.eu
- Shuch B, et al : Comprendre les variantes pathologiques du carcinome cellulaire rénal : Distiller les opportunités thérapeutiques à partir de la complexité biologique. Eur Urol 2015 ; 67(1) : 85-97.
- Ljungberg B, et al : EAU guidelines on Renal Cell Carcinoma. Association européenne d’urologie. Mise à jour limitée mars 2017. www.uroweb.org
- Capitanio U, Montorsi F : Cancer du rein. The Lancet 2016 ; 387 : 894-906.
- Israel GM, Bosniak M : How I do it : evaluating renal masses. Radiologie 2005 ; 236(2) : 441-450.
- Warren KS, McFarlane J : La classification de Bosniak des masses kystiques rénales. BJU Int 2005 ; 95(7) : 939-942.
- Schmid HP : Tendances dans le carcinome des cellules rénales – processus d’évaluation et traitement localisé. info@oncologie 2015 ; 5 : 27-30.
- Edge S, et al : AJCC Cancer Staging Manual. 7ème édition. New York : Springer-Verlag 2010.
- Moch H : Le système de classification OMS/ISUP pour le carcinome rénal. Pathologe 2016 ; 37(4) : 355-360.
- Dagher J, et al : Clear cell renal cell carcinoma : validation of World Health Organization/International Society of Urological Pathology grading. Histopathology 2017 Jul 18. DOI : 10.1111/his.13311 [Epub ahead of Print].
- Roos FC, et al : Survival advantage of partial over radical nephrectomy in patients presenting with localized renal cell carcinoma. BMC Cancer 2014 ; 14(1) : 372.
- Zini L, et al : Radical versus partial nephrectomy : Effect on overall and non-cancer mortality. Cancer 2009 ; 115(7) : 1465-1471.
- Huang WC, et al : Partial Nephrectomy Versus Radical Nephrectomy in Patients With Small Renal Tumors-Is There a Difference in Mortality and Cardiovascular Outcomes ? J Urol 2009 ; 181(1) : 55-62.
- Choueiri TK, et al : Cabozantinib versus everolimus in advanced renal cell carcinoma (METEOR) : final results from a randomised, open-label, phase 3 trial. Lancet Oncol 2016 ; 17 : 917-927.
- Motzer RJ, et al : Nivolumab versus everolimus in advanced renal-cell carcinoma. N Engl J Med 2015 ; 373 : 1803-1813.
- Ravaud A, et al : Sunitinib adjuvant dans le carcinome à cellules rénales à haut risque après néphrectomie. N Engl J Med 2016 ; 375(23) : 2246-2254.
InFo ONKOLOGIE & HÉMATOLOGIE 2017 ; 5(6) : 23-26