Les procédures de remplacement du cœur sont des procédures thérapeutiques de plus en plus importantes et très efficaces pour les patients concernés. Aujourd’hui, malgré les progrès réalisés ces dernières années, elles sont encore considérées à tort comme un “dernier recours”. Il serait pourtant crucial que l’orientation vers une thérapie plus poussée se fasse au bon moment. Ensuite, une équipe de traitement professionnelle et expérimentée est une condition préalable pour obtenir de bons résultats à long terme. Une telle équipe est idéalement composée d’un cardiologue spécialisé dans l’insuffisance cardiaque, du chirurgien cardiaque, du coordinateur VAD et du cardiotechnicien, de l’infirmier CHF/HTx/VAD et d’un psycho-cardiologue.
L’insuffisance cardiaque (IC) est principalement une maladie de la population d’âge avancé, où elle atteint une prévalence allant jusqu’à 10%. Tous âges confondus, la prévalence moyenne est de 1 à 2 % [1]. Malgré l’ampleur de l’épidémie, la détérioration progressive de la qualité de vie et le mauvais pronostic en termes de survie, la place de l’insuffisance cardiaque est massivement sous-estimée par rapport aux tumeurs malignes [2,3]. Habituellement, en présence d’une néoplasie maligne, les patients sont rapidement adressés à un spécialiste médical, l’oncologue. Il ne semble pas en être de même pour l’insuffisance cardiaque. Des données européennes et suisses montrent que les patients souffrant d’une insuffisance cardiaque évidente ne sont souvent pas traités sur la base de données probantes et ne reçoivent pas la dose cible appropriée des médicaments indiqués [4,5]. Les directives anglaises du NICE sur le thème “Chronic Heart Failure”, qui ont été rédigées en grande partie par des médecins généralistes, exigent l’implication précoce d’un cardiologue spécialiste de l’insuffisance cardiaque dans le traitement du patient après le diagnostic d’insuffisance cardiaque [6,7]. Après une évaluation par un spécialiste et en accord avec le médecin référent, le patient continue à être suivi par son médecin traitant, mais il est également vu à intervalles réguliers par le cardiologue spécialisé dans l’insuffisance cardiaque. Cela permet non seulement d’optimiser le traitement médicamenteux, mais aussi de compléter les conseils nécessaires en matière d’insuffisance cardiaque et d’évaluer en temps utile si des mesures supplémentaires, telles qu’une procédure de remplacement cardiaque, doivent être envisagées.
Quand et pour qui une procédure de remplacement du cœur est-elle indiquée ?
Malheureusement, malgré les développements médico-techniques de la dernière décennie, on pense aujourd’hui à tort que la procédure de remplacement cardiaque est une “ultima ratio”. “Qui a besoin d’une chose aussi rare qu’une transplantation cardiaque (HTx) ou même d’un cœur artificiel ? Certainement pas la population âgée”. C’est ainsi que de nombreux collègues médecins raisonnent habituellement et, dans un certain sens, de manière compréhensible. Il est intéressant de noter que les patients sont nettement plus ouverts à d’autres options thérapeutiques telles que les DAI, les CRT, les MitraClip® et les TAVI, bien que l’efficacité thérapeutique et les coûts associés ne diffèrent pas de manière significative.
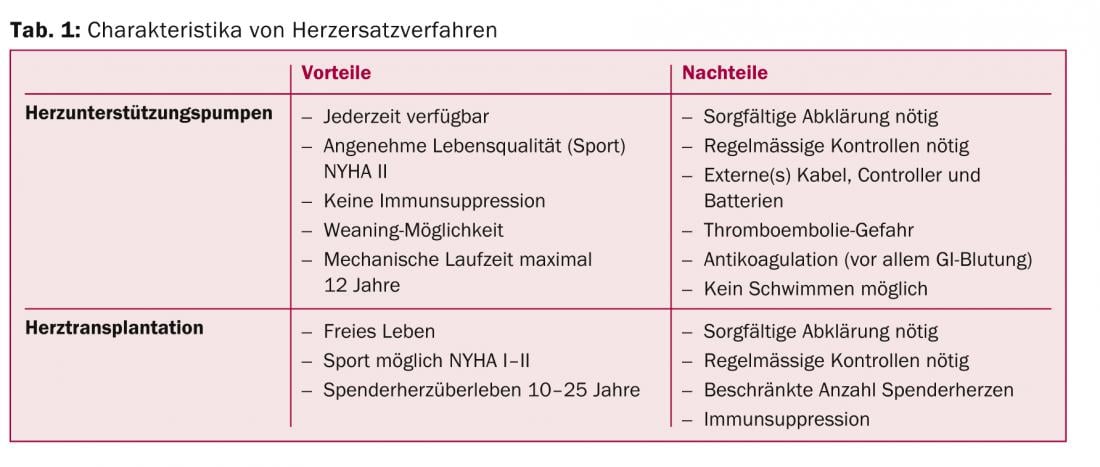
L’un des principaux problèmes est que de nombreux collègues sont mal informés des avantages et des inconvénients liés au traitement avancé de l’insuffisance cardiaque. Le tableau 1 résume les caractéristiques des différentes méthodes de remplacement du cœur.
L’orientation en temps voulu vers une thérapie plus poussée est essentielle. Patients présentant un syndrome cardiorénal débutant (DFG ≤60), une hypertension artérielle pulmonaire débutante resp. L’apparition d’une faiblesse générale devrait être attribuée au plus tard à ce moment-là. L’apparition d’une cachexie cardiaque ou d’un dysfonctionnement ventriculaire droit consécutif est un signe clair d’une évolution avancée de la maladie, qui pourrait être mieux traitée plus tôt.
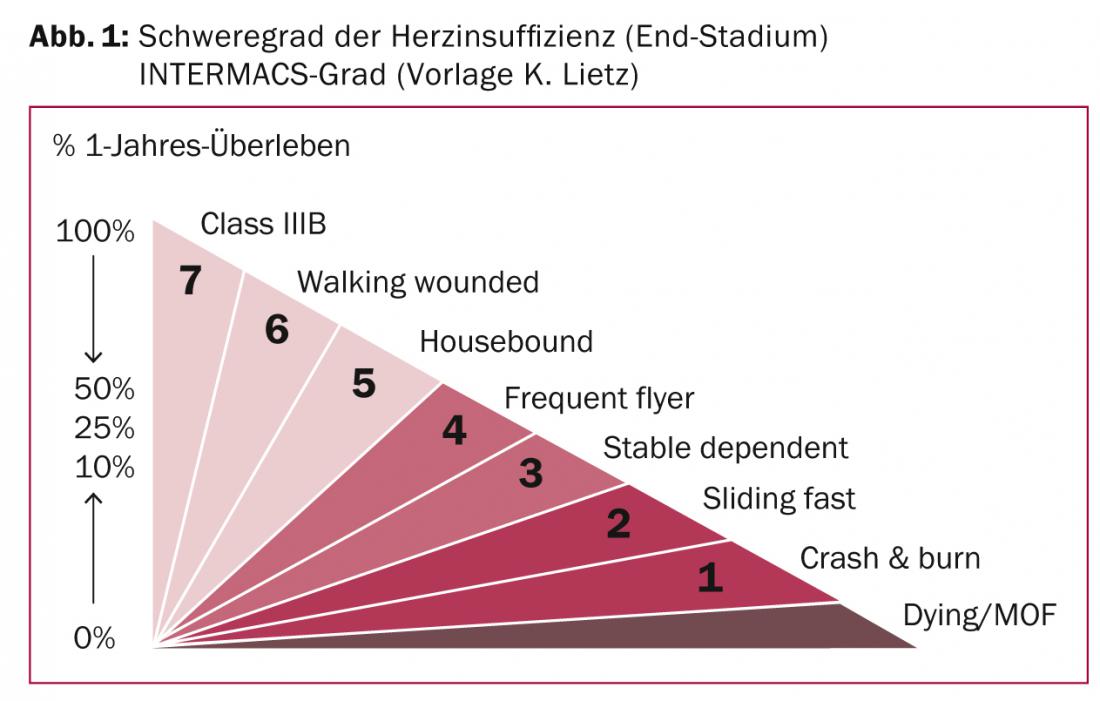
L’implantation relativement simple et peu risquée d’un dispositif d’assistance ventriculaire gauche (“left-ventricular assist device”, LVAD) avec de bonnes données de résultats prouvées n’est plus possible sans autre à ce stade. Afin d’assurer un traitement optimal des patients souffrant d’insuffisance cardiaque, il est utile d’utiliser la classification INTERMACS de la gravité clinique de l’insuffisance cardiaque (Fig. 1) : Pour un degré INTERMACS 5 (dit “housebound”), il faut clairement demander l’avis d’un spécialiste de l’insuffisance cardiaque [8]. Les grades INTERMACS 3-4 correspondent à des conditions cliniques pour lesquelles l’indication d’une procédure de remplacement cardiaque doit être évaluée.
L’évaluation du patient à ce stade de la maladie comprend d’une part l’évaluation de la morbidité (qualité de vie) et d’autre part l’estimation de la mortalité (risque).
Les paramètres de morbidité sont la fréquence des hospitalisations et la capacité de performance, mesurée par le test de course de 6 minutes ou, mieux, par spiroergométrie (détermination de la VO2max) [9]. Le VO
2
La valeur maximale permet également de déterminer le “Heart Failure Survival Score” (HFSS, selon Aaronson-Mancini) [10]. Le HFSS peut être calculé de manière très simple grâce à l’application “Mediquations”. En ce qui concerne le HFSS, il convient toutefois de noter que le risque calculé est estimé sans le DAI, qui est presque toujours nécessaire. Elle ne tient pas non plus compte de la bonne valeur pronostique avérée du BNP.
Chez les patients ne disposant pas d’une valeur maximale de VO2, la valeur dite “Seattle Heart Failure Model”(www.seattleheartfailuremodel.org) peut être utilisée pour évaluer le risque.
Pompes d’assistance cardiaque
Les pompes d’assistance cardiaque font aujourd’hui partie du quotidien clinique et ne sont plus du tout une fiction. À cet égard, nous nous trouvons dans une période similaire à la phase de lancement des stimulateurs cardiaques ou des DAI. Les pompes d’assistance cardiaque sont de plus en plus sûres et de plus en plus petites. Leurs avantages et inconvénients sont résumés dans le tableau 1.
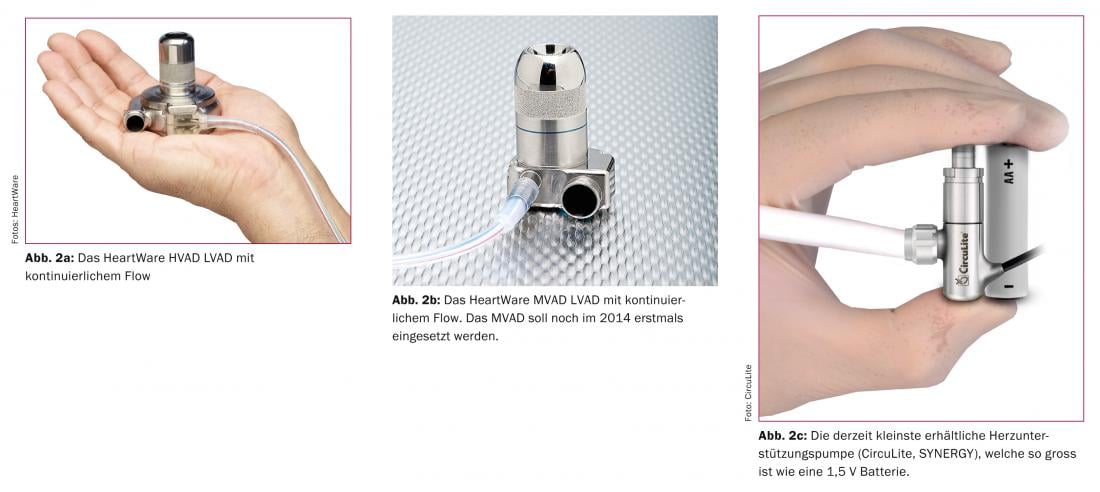
Les principales complications liées à l’utilisation à long terme de pompes d’assistance cardiaque entièrement implantables sont le risque d’infection au niveau du point de sortie de la “drive line”, le câble qui assure les besoins en énergie des pompes par voie transcutanée, ainsi que les problèmes thromboemboliques ou même hémorragiques qui peuvent survenir. Même si ce n’est pas encore optimal dans le cadre actuel, ce n’est qu’une question de temps avant que les câbles gênants ne cèdent la place à une alimentation transcutanée des systèmes d’assistance mécanique. Le risque thromboembolique pourra également être réduit dans un avenir proche grâce à l’introduction de nouveaux matériaux bio-tissulaires. Les pompes d’assistance cardiaque deviennent de plus en plus petites, comme le montre la figure 2a-c.
Transplantation cardiaque
Les transplantations cardiaques sont pratiquées avec succès depuis 45 ans maintenant. Grâce aux immunosuppresseurs modernes, les effets secondaires de ces médicaments très efficaces sont bien tolérés, en particulier lorsqu’ils sont utilisés en combinaison et donc à faible dose. Les performances des patients ayant subi une transplantation cardiaque sont toujours supérieures à celles des pompes d’assistance cardiaque mécaniques. En ce qui concerne l’option thérapeutique de la transplantation cardiaque, il convient toutefois de mentionner comme problème principal la disponibilité limitée de cœurs de donneurs. Cela entraîne de longs délais d’attente pour obtenir un organe et il est donc souvent nécessaire d’implanter une pompe d’assistance cardiaque en attendant une éventuelle transplantation cardiaque (“bridge to transplant”). Parfois, les patients s’habituent tellement à la pompe d’assistance cardiaque pendant cette période d’attente et atteignent une qualité de vie satisfaisante, voire élevée, qu’ils décident même, dans certains cas, de ne pas subir une transplantation cardiaque ultérieure.
Littérature :
- Mohacsi P, et al : Prevalence, augmentation, et coûts de l’insuffisance cardiaque Heart and Metabolism 2001 ; 14 : 9-16.
- Stewart S, et al : Plus maligne que le cancer ? Europ J Heart Fail 2001 ; 3 : 315.
- Cowie MR, et al : Heart 2000 ; 83 : 505-510.
- Harjola VP, et al : Characteristics, outcomes, and predictors of mortality at 3 months and 1 year in patients hospitalized for acute heart failure. Eur J Heart Fail 2010 ; 12 : 239-248.
- Luthi JF, et al : Swiss Med Wkly 2006 ; 136 : 268-273.
- www.nice.org.uk/nicemedia/live/13099/50526/50526.pdf.
- www.nice.org.uk/nicemedia/live/13099/50517/50517.pdf.
- Stevenson LW, et al : INTERMACS Profiles of Advanced Heart FAilure : The Current Picture. J Heart Lung Transplant 2009 ; 28 : 535-541.
- Lucas C, et al : The 6-min walk and peak oxygen consumption in advanced heart failure : aerobic capacity and survival. Am Heart J 1999 ; 138 : 618-624.
- Aaronson KD, et al : Development and prospective validation of a clinical index to predict survival in ambulatory patients referred for cardiac transplant evaluation. Circulation 1997 ; 95 : 2660-2667.
CARDIOVASC 2014 ; 13(3) : 8-10











