La gravité et la prévalence de la carence en fer dans l’insuffisance rénale chronique vont de pair avec le stade de celle-ci et sont d’origine multifactorielle. Chez les patients atteints d’insuffisance rénale, l’homéostasie du fer est considérablement modifiée, de sorte que les paramètres optimaux du fer sont définis différemment de ceux des patients en bonne santé rénale. Cela a des conséquences sur les aspects de l’anamnèse, les examens à effectuer et les valeurs limites et cibles. Le présent article aborde ce point et analyse la substitution en fer sous forme orale et parentérale.
L’élément fer est un oligo-élément essentiel et quantitativement le plus important pour presque tous les êtres vivants. Présent chez les animaux et les humains sous forme divalente et trivalente, le fer est principalement impliqué dans la fixation de l’oxygène et le transfert d’électrons. De ces propriétés physico-chimiques découlent ses principales fonctions de fixateur et de transporteur d’oxygène, de catalyseur des réactions d’oxydoréduction dans la chaîne respiratoire cellulaire et de composant actif de nombreuses enzymes non héminiques. Cependant, la capacité des ions de fer libres à former des espèces d’oxygène hautement réactives (par exemple des radicaux hydroxyles) à partir du peroxyde d’hydrogène (réaction dite de Fenton) et à provoquer une peroxydation des lipides, présente un potentiel cytotoxique considérable. C’est pourquoi la majorité du fer, tant intracellulaire qu’extracellulaire, se trouve sous forme redox, liée à des protéines spécialisées [1].
Homéostasie du fer
Le corps humain adulte contient environ 3,5-5 g de fer élémentaire [2]. Ce dernier se trouve presque exclusivement sous forme liée, sous forme de fer de stockage et de fer fonctionnel. Le pool de stockage (0,8-1,2 g) est constitué du complexe protéique ferritine, une protéine d’environ 450 kDa remplie d’oxyde d’hydroxyde ferrique, et de l’hémosidérine strictement intracellulaire, qui est une forme de stockage lente et difficilement mobilisable de ferritine dénaturée. Le foie, la rate et la moelle osseuse sont particulièrement riches en fer de réserve. Bien que la proportion de ferritine extracellulaire soit relativement faible, sa concentration sérique semble bien corrélée à la réserve de fer intracellulaire en temps normal.
Le fer fonctionnel comprend l’hémoglobine, la plus importante en termes de quantité (2,5-3 g), la myoglobine (150 mg), le fer intracellulaire (80 mg) et les enzymes contenant du fer (10 mg). Le fer de transport circulant (4 mg) lié à la transferrine, une glycoprotéine d’environ 80 kDa, ne constitue proportionnellement qu’une petite fraction de la quantité totale. Ainsi, le fer rapidement échangeable et disponible pour la resynthèse de l’hème et des enzymes contenant du fer (25 mg/jour) est recyclé plusieurs fois par jour. Cela se produit par la dégradation des groupes sanguins dans le système réticulo-endothélial. La saturation de la transferrine, le rapport entre le fer sérique et la capacité totale de fixation du fer (transferrine), est une mesure indirecte de la disponibilité du fer [1, 3].
La figure 1 donne un aperçu de la quantité de fer disponible et de sa répartition chez l’adulte en bonne santé.
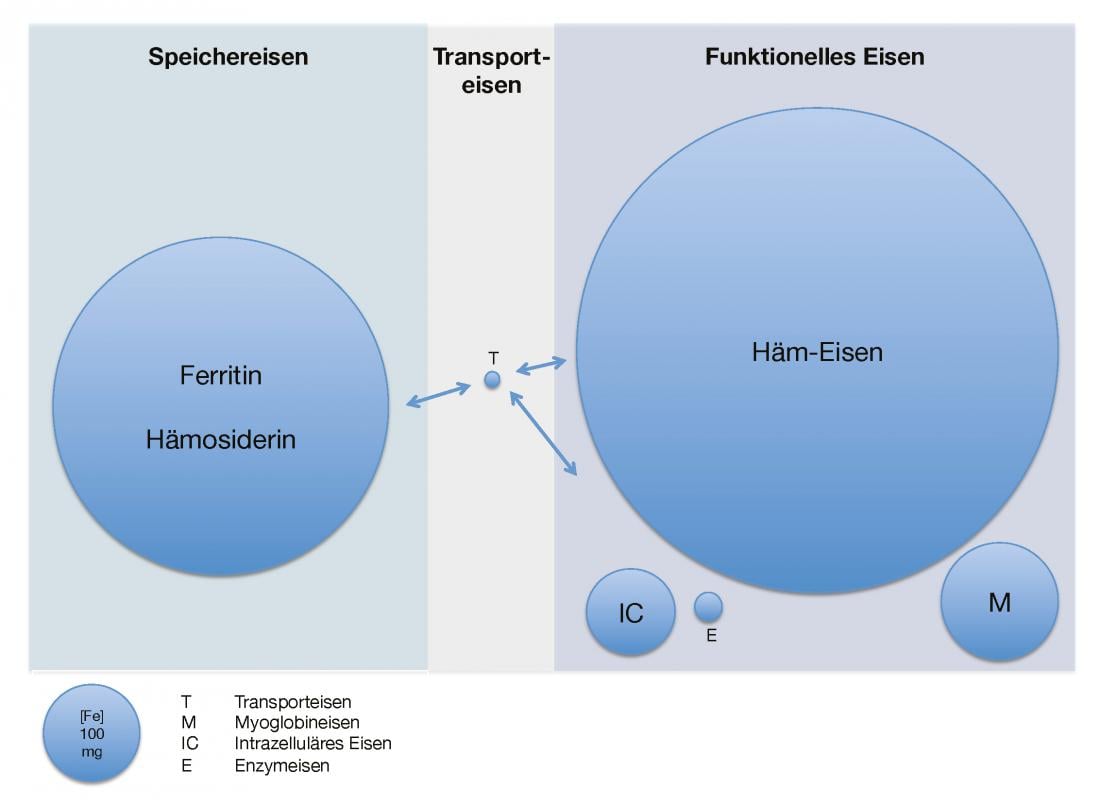
Fig. 1 : Quantité de fer disponible et répartition chez l’adulte en bonne santé
Répartition du fer dans l’organisme d’un point de vue quantitatif. T signifie fer-transferrine lié à la transferrine, M signifie fer de la myoglobine, IC signifie fer intracellulaire et E signifie fer contenu dans les enzymes.
En raison de sa double propriété d’oligo-élément indispensable et de poison organique et cellulaire très puissant, le bilan du fer et sa compartimentation dans l’organisme sont strictement régulés. Contrairement aux cations polyvalents comme le calcium, l’homéostasie du fer est exclusivement régulée par l’absorption, car les pertes normales ne sont pas contrôlables et aucune augmentation supplémentaire de l’excrétion du fer n’est possible. Ainsi, chez les individus sains à l’état d’équilibre, l’apport quotidien de fer par voie entérale (1-2 mg chez l’homme, 2-3 mg chez la femme en période de menstruation) couvre les pertes naturelles dues à la desquamation des cellules de la peau et de la muqueuse, aux menstruations chez les femmes en âge de procréer et à des traces dans les selles et l’urine.
Chez les mammifères, le fer ferrique mal absorbé est réduit en fer ferreux plus soluble par le cytochrome B duodénal au pôle apical des entérocytes. Ensuite, l’absorption intracellulaire dans l’entérocyte se fait par le transporteur de métal divalent (DMT1). Le fer peut en outre être absorbé par un mécanisme parallèle et très efficace sous forme d’hémine, un produit de dégradation de l’hème et de la myoglobine abondant dans les produits carnés, par le transporteur Häm Carrier Protein 1 (HCP1). La ferroportine basolatérale exporte alors le fer ferreux, qui est immédiatement oxydé par la céruloplasmine en fer ferrique, lequel se lie à la transferrine. Le taux d’absorption du fer ingéré par voie orale est cependant faible et s’élève en moyenne à 6% chez les hommes et à environ le double chez les jeunes femmes. Une augmentation en cas de stimulation maximale du système (carence en fer) ne peut se produire que jusqu’à 20%. L’hormone peptidique hepcidine, découverte il y a environ 13 ans, joue un rôle clé dans cette régulation fine. Celle-ci se lie et induit la dégradation de la ferroportine, exportateur de fer, dans les entérocytes duodénaux, les macrophages réticulo-endothéliaux et les hépatocytes, empêchant ainsi la libération de fer dans la transferrine. Il en résulte une faible absorption entérale du fer et une diminution de la libération de fer de la ferritine vers la transferrine, ce que l’on appelle un blocage réticulo-endothélial. Le fer circulant et les médiateurs de l’inflammation stimulent la production d’hepcidine, tandis que l’hypoxémie et l’administration d’ASE ont un effet inhibiteur [1, 3-5].
Carence en fer en cas d’insuffisance rénale chronique
L’une des principales caractéristiques de l’insuffisance rénale chronique est l’anémie rénale, qui est associée à une diminution de la qualité de vie, à une augmentation de la morbidité cardiovasculaire et de la mortalité globale [6, 7]. Outre la carence relative en érythropoïétine [8, 9], la résistance à l’érythropoïétine d’origine urémique [10] et la durée de survie nettement réduite des érythrocytes dans le milieu urémique [11], la carence en fer absolue et fonctionnelle doit être considérée comme un facteur causal important. Ces deux éléments sont également des facteurs importants de la résistance à l’érythropoïétine, qui se caractérise par un besoin élevé en agents stimulant l’érythropoïèse (ASE) et des difficultés, voire l’impossibilité, d’atteindre l’objectif thérapeutique sans avoir recours à la transfusion [12, 13].
La prévalence et la gravité de la carence en fer dans l’insuffisance rénale chronique vont de pair avec le stade de celle-ci et sont d’origine multifactorielle. L’inappétence fréquemment observée dans ce collectif, la restriction diététique en phosphate prescrite ainsi que l’utilisation importante et généralisée d’inhibiteurs de la pompe à protons et de chélateurs du phosphate contenant du calcium entraînent une diminution de l’apport et de l’absorption de fer [14, 15]. En raison de la thrombopathie urémique et de la gastrite, on observe en outre des pertes gatro-intestinales. Parallèlement, l’insuffisance rénale croissante entraîne une augmentation de la formation et de l’accumulation d’hepcidine en raison de l’état pro-inflammatoire associé à l’urémie et de la diminution de la clairance des hormones peptidiques. Cette constellation particulière explique la carence fonctionnelle en fer fréquemment observée à différents degrés, caractérisée par des taux de ferritine élevés et des taux de saturation de la transferrine faibles à normaux [4, 12, 15, 16]. En conséquence, chez les patients insuffisants rénaux, le taux de ferritine utilisé pour définir la carence en fer est plus élevé que chez les personnes en bonne santé rénale, à savoir 100-200 ng/ml [6, 7, 15, 17]. Une formulation alternative pour cela serait que l’utilisation optimale du fer chez ces patients se fait au détriment de l’augmentation du fer de réserve. Ainsi, lorsque les taux de ferritine sérique sont inférieurs à 100 ng/ml, on constate une réponse sous-optimale à l’ESA et des réserves insuffisantes [18].
En revanche, presque tous les patients souffrant d’insuffisance rénale, y compris les patients sous hémodialyse, ont des réserves de fer intramédullaire suffisantes si leur taux de ferritine sérique est supérieur à 300 ng/ml [19]. Cependant, Mirahmadi et al. a montré il y a plusieurs décennies que certains patients hémodialysés présentaient déjà des signes de surcharge en fer lorsque leur taux de ferritine sérique dépassait 124 ng/ml [20]. Toute la situation devient encore plus complexe si l’on considère le fait que certains patients hémodialysés présentant des taux élevés de ferritine sérique (jusqu’à plus de 1200 ng/ml) continuent à présenter une réponse positive à l’administration parentérale de fer, en particulier lorsque la saturation de la transferrine est suboptimale, inférieure à 20% [21, 22].
Ces chiffres démontrent clairement que l’évaluabilité générale de ces tests doit être relativisée [23]. En cas de mobilisation rapide des réserves de fer, comme c’est le cas par exemple dans le cadre d’un traitement ESA récemment démarré ou intensifié, l’apport en fer à partir des réserves peut être insuffisant, ce qui entraîne ce que l’on appelle une érythropoïèse limitée en fer. Elle peut survenir indépendamment de la carence fonctionnelle en fer et se caractérise par une diminution de la teneur en hémoglobine des érythrocytes et de leurs précurseurs. Le pourcentage d’érythrocytes hypochromes (% HRC) et le taux d’hémoglobine réticulocytaire (CHr) sont des indicateurs bien établis de la carence fonctionnelle en fer et de l’érythropoïèse limitée par le fer. Un CHr inférieur à 29 pg/cellule chez les patients sous traitement ESA est donc révélateur d’une carence en fer fonctionnelle. L’équivalent réticulocytaire de l’hémoglobine (Ret-HE) inférieur à 30,6 pg/cellule, un équivalent du CHr mesuré par une méthode alternative, est quant à lui hautement prédictif d’une bonne réponse à l’administration intraveineuse de fer chez les patients hémodialysés traités par ESA. Des paramètres plus récents et plus précis de la carence fonctionnelle en fer et de l’érythropoïèse limitée par le fer, tels que la protoporphyrine érythrocytaire de zinc (ZPP) et le récepteur soluble de la transferrine (sTFR), ne sont actuellement pas recommandés comme tests standard chez les patients insuffisants rénaux en raison de leur disponibilité limitée, de leur coût plus élevé et d’une expérience encore insuffisante [22].
Selon les critères mentionnés ci-dessus, la prévalence de la carence en fer chez les patients insuffisants rénaux non dialysés (stades 3 et 4 de l’IRC) est supérieure à 50% [15]. La situation est encore plus critique chez les patients sous hémodialyse. Outre les facteurs déjà mentionnés, les nombreuses prises de sang et la séquestration régulière du sang dans le filtre et les instruments de dialyse entraînent une perte considérable de fer, de l’ordre de 1 à 3 g (avec un hématocrite normal, 1 ml de sang contient environ 0,5 mg de fer). Cela conduit virtuellement à une carence en fer chez tous les patients si les pertes ne sont pas remplacées par une substitution adéquate [10].
Une carence en fer isolée sans anémie (EoA), une entité par ailleurs de plus en plus clairement définie chez les patients insuffisants rénaux [24, 25], est rare chez les patients insuffisants rénaux. Il s’agit souvent de situations iatrogènes, où les patients ne reçoivent pas de substitution en fer, voire des saignées, pendant une longue période en raison d’un taux d’hématocrite spontanément élevé. Un traitement inadéquat de l’anémie rénale avec de fortes doses d’ASE et l’absence ou l’insuffisance de substitution en fer peut conduire au même tableau. Les symptômes généraux typiques de l’EoA, tels que la fatigue, les troubles de l’attention, les troubles de la thermorégulation et la perte de cheveux, sont absents ou masqués par les symptômes urémiques qui sont au premier plan. Seul le syndrome des jambes sans repos (RLS) semble être associé à la carence fonctionnelle en fer dans cette population, indépendamment du degré d’anémie [26].
Substitution du fer et surveillance en cas d’insuffisance rénale
Tous les patients atteints d’insuffisance rénale doivent être examinés pour vérifier la présence d’une anémie. La prévalence de l’anémie rénale augmente considérablement à partir du stade 3 de l’IRC et nécessite une évaluation appropriée [6, 7, 27]. En plus d’une anamnèse et d’un examen ciblés, cela implique au moins un hémogramme complet avec indices érythrocytaires et nombre absolu de réticulocytes, ainsi qu’un taux sérique de vitamine B12 et de folates. Le statut en fer doit être évalué pour le fer de réserve (ferritine sérique) et le fer rapidement mobilisable (saturation de la transferrine et/ou un taux d’hémoglobine réticulocytaire) [6, 7].
La substitution en fer est en principe recommandée chez tous les patients insuffisants rénaux, dialysés ou non, souffrant d’anémie et suivant un traitement par ASE. En outre, l’administration parentérale de fer peut éviter ou du moins retarder la nécessité d’un traitement par ASE chez les patients non dialysés et contribue à une réduction substantielle des besoins en ASE chez les patients hémodialysés, ce qui est associé à des avantages financiers et éventuellement sanitaires [6, 7, 13, 28].
Bien que les groupes d’experts n’aient pas défini les valeurs cibles de manière uniforme, il est possible de dégager un consensus sur les valeurs cibles. Une valeur minimale de 200 ng/ml pour la ferritine sérique et de 20% pour la saturation de la transferrine est acceptée à l’unanimité. Alternativement, en plus de la saturation de la transferrine, des valeurs cibles sont définies pour le CHr (>29 pg/cellule) et le % HCR (<10%). Ces exigences minimales ne représentent pas en soi des valeurs cibles au niveau de la population, qui sont évidemment plus élevées ici.
Il reste plus compliqué de se prononcer clairement sur les limites supérieures en ce qui concerne les complications immédiates et les complications tardives, encore mal étudiées, de la thérapie parentérale à base de fer [29–31]. Des signes de toxicité hépatique et une augmentation de la mortalité et de la sensibilité aux infections ont été observés chez les patients hémodialysés avec une surcharge en fer [15, 29, 32]. En général, il n’est pas recommandé d’administrer du fer lorsque la ferritine est supérieure à 500 ng/ml [6, 7, 17]. En outre, en cas d’infections actives et de fièvre, l’administration parentérale de fer devrait être évitée en raison des effets délétères sur le système immunitaire et de la diminution de la capacité de transport liée à l’inflammation [7]. La persistance d’un déficit fonctionnel en fer nécessite des investigations complémentaires sur une infection cryptogénique ou une néoplasie. Si les deux sont exclus, on peut tenter de surmonter cet état en optimisant le traitement par hémodialyse et en administrant du fer parentéral de manière contrôlée. Dans un avenir proche, on espère pouvoir traiter encore plus efficacement le “blocage urémique du fer” grâce à l’utilisation thérapeutique d’inhibiteurs de l’hepcidine. Le tableau 1 résume les paramètres cibles pour une thérapie à base de fer selon les directives actuellement disponibles.
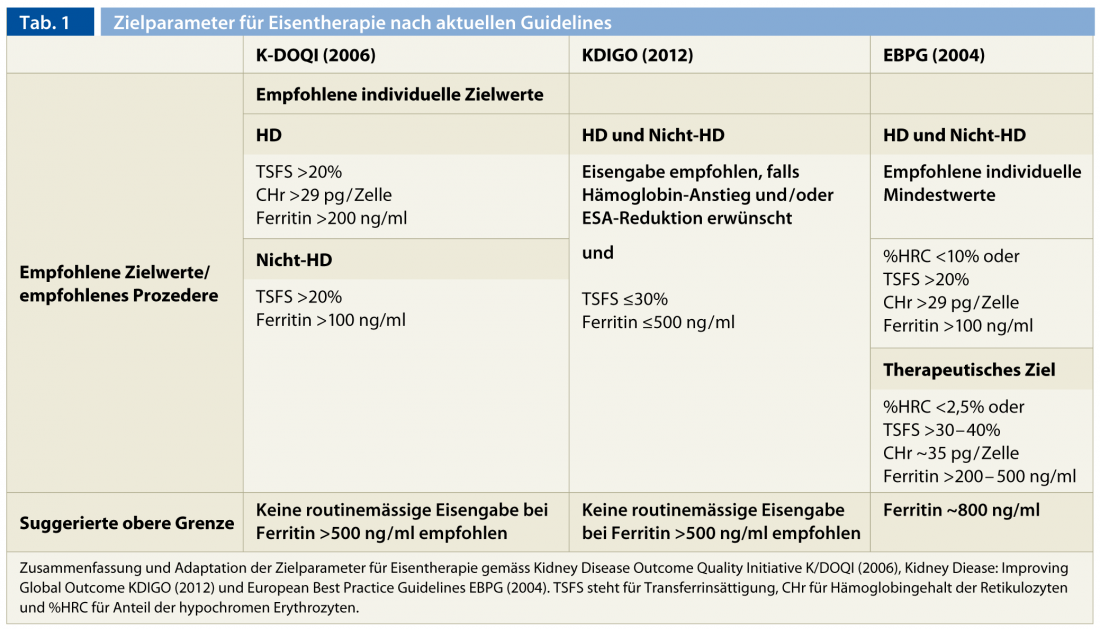
L’effet thérapeutique doit être régulier afin de garantir des réserves de fer optimales en permanence et d’éviter les effets secondaires toxiques dus à une accumulation incontrôlée du fer de réserve (à partir d’environ 500-800 ng/ml de ferritine) et/ou à un dépassement de la capacité de transport sérique avec augmentation délétère du fer libre dans le sérum (TSFS >60%) [33]. Il est important de noter que la possibilité d’évaluer les paramètres du fer immédiatement après l’administration parentérale de fer est fortement compromise et qu’un intervalle d’au moins une semaine doit être respecté entre l’administration et la mesure. Des contrôles mensuels sont recommandés pendant les phases de saturation ou au début du traitement par ASE. Dans les cas stables et chez les patients ne suivant pas de traitement ASE, des contrôles de trois mois sont suffisants.
Substitution orale du fer
Malgré son faible coût et sa facilité d’utilisation, la substitution orale du fer présente plusieurs inconvénients. Le fer ingéré par voie perorale peut entraîner des dommages oxydatifs dans le tractus gastro-intestinal, ce qui peut se manifester cliniquement par des vomissements, une dyspepsie et une diarrhée. La mauvaise observance qui en résulte peut être considérable, allant jusqu’à 70% dans certains collectifs [34]. En outre, l’efficacité de la substitution orale du fer reste très faible pour les raisons déjà mentionnées.
Une reconstitution plus efficace des réserves de fer et une meilleure réponse à l’ASE ne peuvent être obtenues qu’avec la forme parentérale [14]. C’est précisément lorsque les réserves en fer étaient auparavant normalisées que l’administration per os n’a pas été en mesure de maintenir des réserves en fer suffisantes à long terme [35]. Lors de l’utilisation de préparations contenant de fortes doses de sels de fer (anion ferrique[II]), la diffusion passive et incontrôlée du fer peut entraîner une augmentation significative du fer libre, appelé fer non lié à la transferrine (NTBI), par épuisement des mécanismes de transport locaux, ce qui peut également entraîner une toxicité systémique. En règle générale, la substitution orale doit être limitée aux patients non dialysés ne suivant pas de traitement par ASE et ne présentant pas de carence grave en fer, avec une évaluation régulière de l’efficacité et de la tolérance [6, 7].
Substitution parentérale du fer
Les besoins élevés en fer, en particulier chez les patients sous hémodialyse, dépassent la capacité d’absorption et de libération du fer par voie entérale à partir du pool de stockage, déjà compromise dans le cadre de l’insuffisance rénale, et expliquent la nette supériorité thérapeutique de l’administration parentérale par rapport à la voie perorale. C’est pourquoi elle est recommandée comme mode d’administration standard chez tous les patients souffrant d’insuffisance rénale. Actuellement, trois préparations parentérales à base de fer sont disponibles en Suisse (tableau 2).
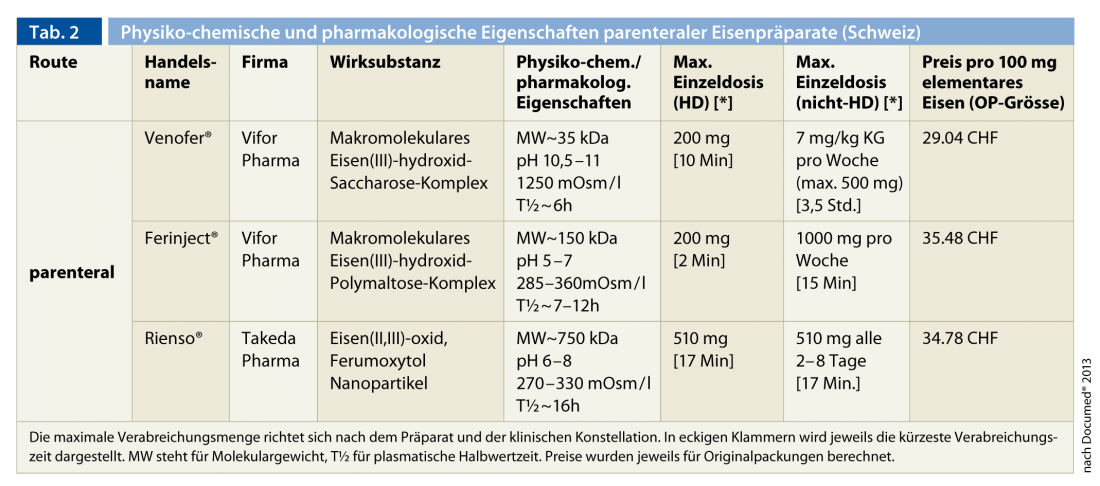
Il s’agit, par ordre chronologique d’autorisation, de Venofer® (complexe macromoléculaire d’hydroxyde ferrique et de saccharose), Ferinject® (complexe macromoléculaire d’hydroxyde ferrique et de polymaltose) et Rienso® (nanoparticules d’oxyde ferreux (II, III) et de ferumoxytol). Les préparations contenant du dextran de faible et de haut poids moléculaire ne sont plus commercialisées en raison de leurs effets indésirables potentiellement mortels (anaphylaxie). L’expérience acquise au fil des décennies avec la première préparation (Venofer®) est considérable. Les deux préparations les plus récentes permettent d’administrer des doses unitaires plus élevées en raison de leurs propriétés physico-chimiques (pH et osmolalité) et surtout de la plus grande stabilité du complexe ferrique. C’est un avantage important pour les patients ambulatoires non hémodialysés. Dans tous les cas, la fréquence des effets secondaires graves mettant en jeu le pronostic vital est très faible. Il ne faut pas s’attendre à des réactions croisées avec les préparations contenant du dextran, qui ne sont pas disponibles en Suisse [15, 36]. Des épisodes d’hypotension, des bronchospasmes, des réactions cutanées, des myalgies et des arthralgies ou de la fièvre sont observés dans des cas isolés, en particulier lors d’une administration rapide.
La thérapie se divise en une phase de remplissage et une phase de maintien. Les besoins initiaux en fer peuvent être calculés à l’aide de la formule de Ganzoni :
Déficit total en fer (mg) = [Soll-Hb – Ist-Hb (g/dl)] × poids corporel (kg) × 2,4 + fer de réserve (mg)
Cette quantité peut ensuite être administrée de manière fractionnée (Venofer® et Ferinject®) ou en dose unique (Ferinject® et Rienso®), en fonction de la préparation, du degré de sévérité de l’insuffisance rénale et de la forme d’administration. La dose d’entretien dépend de l’effet thérapeutique obtenu et des paramètres du fer contrôlés régulièrement.
CONCLUSION POUR LA PRATIQUE
- La carence en fer absolue et fonctionnelle est fréquente en cas d’insuffisance rénale chronique et joue un rôle essentiel dans le développement de l’anémie rénale.
- La substitution en fer est un élément central du traitement de l’anémie rénale. L’optimisation des paramètres du fer permet d’atteindre les valeurs thérapeutiques cibles chez la plupart des patients et de minimiser la consommation d’ASE, ce qui s’accompagne d’une réduction des coûts et éventuellement d’une amélioration des résultats.
- L’homéostasie du fer est considérablement modifiée en cas d’insuffisance rénale, de sorte que les paramètres optimaux du fer sont définis différemment de ceux des personnes en bonne santé rénale.
- L’administration parentérale est aujourd’hui supérieure à l’administration perorale en raison d’une meilleure efficacité et d’une meilleure tolérance. Les préparations parentérales de fer plus modernes sont sûres et facilitent considérablement la substitution en fer.
- En raison de l’absence d’études sur les résultats à long terme et de l’existence de preuves sur les effets délétères du surdosage en fer dans ce collectif, l’administration systématique de fer ne devrait se faire qu’en respectant les valeurs cibles.
Dr. med. Robert M. Kalicki
Littérature :
- Dunn LL, Suryo Rahmanto Y, Richardson DR : Trends Cell Biol 2007 ; 17, 93.
- Löffler G : Biochimie et pathobiochimie. 7e édition. Éditions Springer : Berlin 2002.
- Andrews NC : Blood 2008 ; 112 : 219.
- Babitt JL, Lin HY : Am J Kidney Dis 2010 ; 55 : 726.
- Nemeth E, et al : Science 2004 ; 306 : 2090.
- Am J Kidney Dis 2006 ; 47 : S16.
- Kidney International Supplements 2012 ; 2 : 279.
- Jacobson LO, Goldwasser E, Fried W, Plzak L : Nature 1957 ; 179 : 633.
- McGonigle RJ, Wallin JD, Shadduck RK, Fisher JW : Kidney Int 1984 ; 25 : 437.
- Besarab AF, in : Anemia in renal disease. Lippincott Williams and Wilkins : Philadelphia 2007 ; 2406-2430.
- Eschbach JW : Kidney Int 1989 ; 35 : 134.
- Babitt JL, Lin HY : J Am Soc Nephrol 2012 ; 23 : 1631.
- Coyne DW, Auerbach M : Am J Hematol 2012 ; 85 : 311.
- Fudin R, Jaichenko J, Shostak A, Bennett M, Gotloib L : Nephron 1998 ; 79 : 299.
- Macdougall IC, Geisser P : Iran J Kidney Dis 2012 ; 7 : 9.
- Ashby DR, et al : Kidney Int 2009 ; 75 : 976.
- Nephrol Dial Transplant 2004 ; 19 [Suppl 2]: ii6.
- Fernandez-Rodriguez AM, et al : Am J Kidney Dis 1999 ; 34 : 508.
- Aljama P, et al : Clin Nephrol 1978 ; 10 : 101.
- Mirahmadi KS, et al. : JAMA 1977 ; 238 : 601.
- Chang CH, Chang CC, Chiang SS : Clin Nephrol 2002 ; 57 : 136.
- Thomas DW, et al : Br J Haematol 2013.
- Kalantar-Zadeh K, et al : Am J Kidney Dis 1995 ; 26 : 292.
- Bruner AB, Joffe A, Duggan AK, et al : Lancet 1996 ; 348 : 992.
- Rowland TW, Deisroth MB, Green GM, et al : Am J Dis Child 1988 ; 142 : 165.
- Sloand JA, Shelly MA, Feigin A, et al : Am J Kidney Dis 2004 ; 43 : 663.
- Bethesda MD, The National Institutes of Health, National Institute of Diabetes and Digestive and Kidney Diseases 2004.
- Solomon SD, et al : N Engl J Med 2010 ; 363 : 1146.
- Kalantar-Zadeh K, et al : J Am Soc Nephrol 2005 ; 16 : 3070.
- Feldman HI, et al : J Am Soc Nephrol 2002 ; 13 : 734.
- Feldman HI, et al : J Am Soc Nephrol 2004 ; 15 : 1623.
- Vaziri ND : Am J Kidney Dis 2013.
- Hershko C, Graham G, Bates GW, et al : Br J Haematol 1978 ; 40 : 255.
- Kruske SG, Ruben AR, Brewster DR : J Paediatr Child Health 1999 ; 35 : 153.
- Macdougall IC, et al : Kidney Int 1996 ; 50 : 1694.
- Auerbach M, Ballard H : Hematology Am Soc Hematol Educ Program 2010 ; 338.











