L’angiosarcome associé aux radiations est plus fréquent qu’on ne le pense intuitivement. Le diagnostic initial doit être posé le plus tôt possible. Paradoxalement, même pour cette tumeur radio-induite, la ré-irradiation est une bonne option thérapeutique.
L’angiosarcome associé aux radiations (RAAS) est si rare qu’il n’existe aucune étude prospective. C’est pourquoi toutes les connaissances acquises jusqu’à présent reposent sur des séries de cas rétrospectives et des rapports de cas. En raison de la publication sélective des cas, les recommandations thérapeutiques basées sur ces données ne doivent être faites qu’avec prudence. D’autre part, il faut s’en contenter jusqu’à ce que l’on dispose d’un plus grand nombre de cas et d’observations à long terme provenant en partie de registres de tumeurs en cours de création.
Les angiosarcomes sont des tumeurs hautement malignes des cellules endothéliales, qui ne représentent qu’environ 1 à 2 % de tous les sarcomes des tissus mous [1]. L’angiosarcome du sein peut être primaire ou secondaire à un lymphœdème chronique après mastectomie (syndrome de Stewart-Treves) [2] ou dans le cadre d’un RAAS au sein d’un champ d’irradiation antérieur [3]. Les angiosarcomes primaires semblent avoir un meilleur pronostic que les RAAS [4–6]. Pour les distinguer, on utilise généralement les critères modifiés de Cahan [7,8]. Il s’agit notamment de
- Histologie différente de la tumeur primaire initiale et de la tumeur secondaire
- Apparition de la tumeur secondaire dans le champ d’irradiation précédent
- Latence entre la tumeur primaire et la tumeur secondaire de plus de trois ans.
En général, on indique une latence médiane de six ans entre la radiothérapie (RT) de la tumeur primaire et l’apparition du RAAS [1,9]. Ce délai est nettement plus court que celui des autres sarcomes associés aux radiations, qui ne se manifestent généralement qu’après 10 à 20 ans [10,11]. On peut supposer une certaine prédisposition génétique, même si elle n’est pas prouvée [12].
Une analyse de la base de données SEER portant sur près de 275 000 patientes atteintes d’un cancer du sein a montré une incidence cumulée du RAAS de 0,09% à 15 ans [9]. Celle-ci semble augmenter en raison de la RT adjuvante pratiquée en routine après un traitement conservateur du sein (BET) en cas de carcinome mammaire ou de DCIS [1]. On ne sait pas dans quelle mesure les thérapies systémiques intensifiées contribuent à la genèse.
Le taux de survie à 5 ans est faible et est estimé à 27-35% sur la base de la base de données SEER [9]. Les raisons de ce mauvais pronostic sont multiples. Les décolorations rougeâtres-vives, parfois étendues, qui apparaissent dans l’ancien champ d’irradiation attirent trop tard l’attention de la patiente. Outre l’atteinte macroscopique, une métastase microscopique occulte en forme de “saut de puce” se produit tôt dans la peau. Il est difficile d’y remédier chirurgicalement, car elle peut se manifester à nouveau rapidement après l’excision de la lésion macroscopique à un autre endroit [10,13,14].
Il n’existe pas de recommandations thérapeutiques uniformes. L’approche chirurgicale est au premier plan. La plus grande revue à ce jour, basée sur 222 patients avec un RAAS, montre un intervalle sans récidive locale à 5 ans de 32% et un taux de survie à 5 ans de 43% [1], ce qui est supérieur à la base de données SEER (27-35%). Cela est probablement dû au fait que les patients analysés provenaient de rapports de cas et de séries de cas avec principalement des réponses exceptionnelles et des thérapies combinées, et que le pronostic est donc surévalué en raison du “biais de publication”. Inversement, cela peut indiquer une possible amélioration du pronostic grâce à des thérapies combinées.
Rapport de cas
Nous rapportons le cas d’une patiente aujourd’hui âgée de 79 ans et souffrant d’un SARA. 11/2006, un carcinome mammaire invasif et canalaire gauche a été diagnostiqué. Une BET a été réalisée avec une tumorectomie et une lymphadénectomie axillaire sentinelle avec un stade pT1c pN0 (0/1 sn) cMO ER/PR positif, HER2 négatif. En postopératoire, la RT adjuvante normofractionnée de l’ensemble du sein a été réalisée avec des champs tangentiels allant jusqu’à 50 Gy et un boost local de 16 Gy, suivi d’une hormonothérapie.
En 08/2011, la patiente a remarqué une large coloration jaune livide sur tout le sein gauche, avec des nodules qui s’ouvrent et un début d’ulcération. Le mamelon n’était déjà plus reconnaissable (Fig. 1). L’histologie a révélé un hémangiosarcome mal différencié (G3), qui a été confirmé par une seconde évaluation.
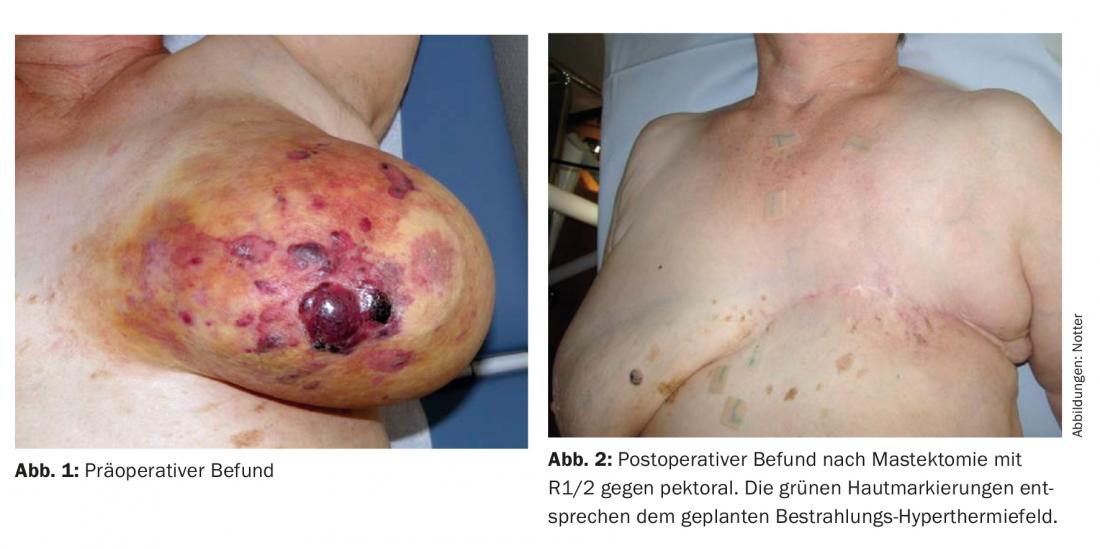
Une discussion préopératoire a eu lieu au sein du tumor board concernant la stratégie thérapeutique, au cours de laquelle une mastectomie suivie d’une ré-irradiation (re-RT) combinée à une hyperthermie à grande échelle (HT) a été recommandée. En postopératoire, une résection R1/R2 a été observée dans la zone de la cicatrice et vers le pectoral (Fig. 2). Aucune résection ultérieure n’a été effectuée. Ensuite, par analogie avec un schéma thérapeutique établi pour les récidives du sein et de la paroi thoracique, [15] a procédé à une re-RT hypofractionnée de 5× 4 Gy, 1×/semaine, en concomitance avec une TH de surface (fig. 3) .
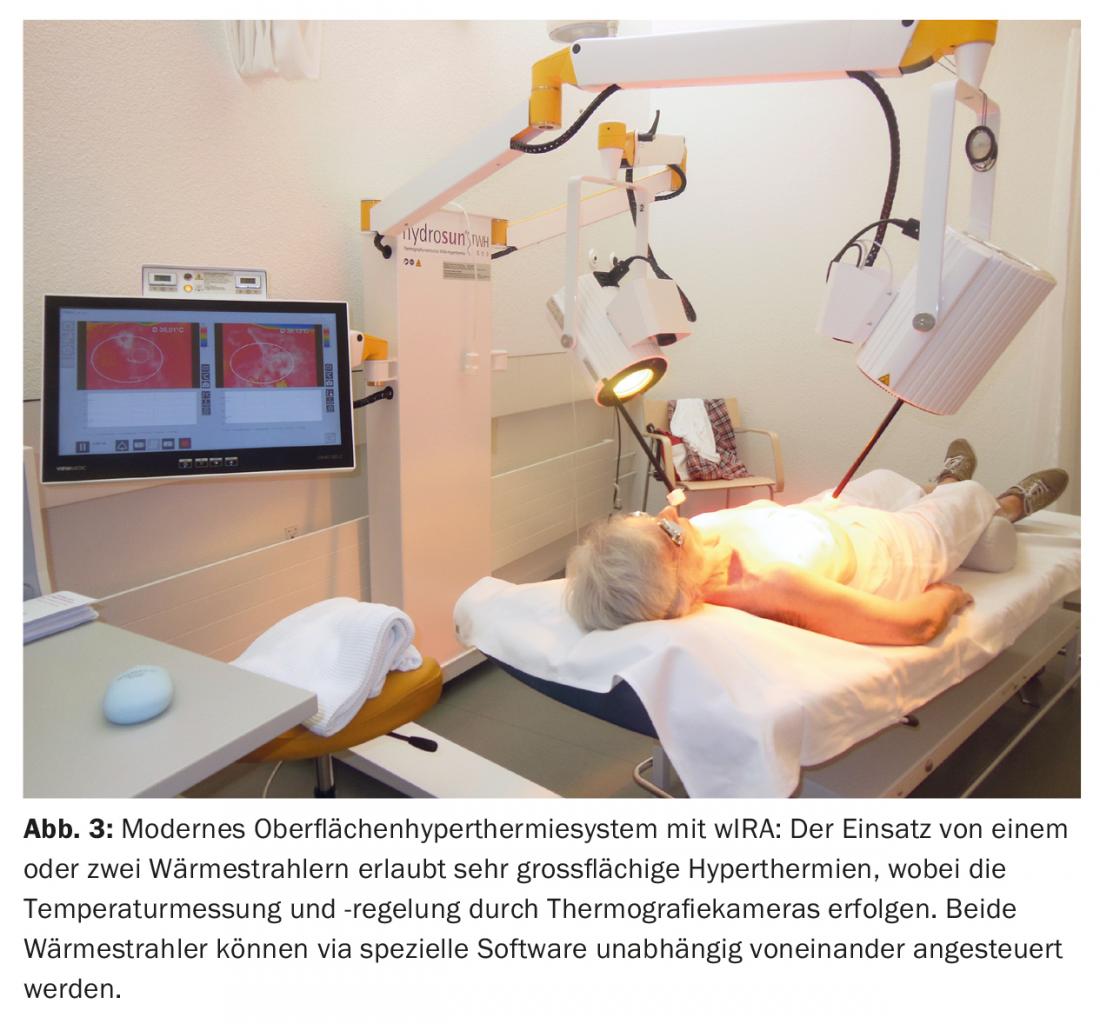
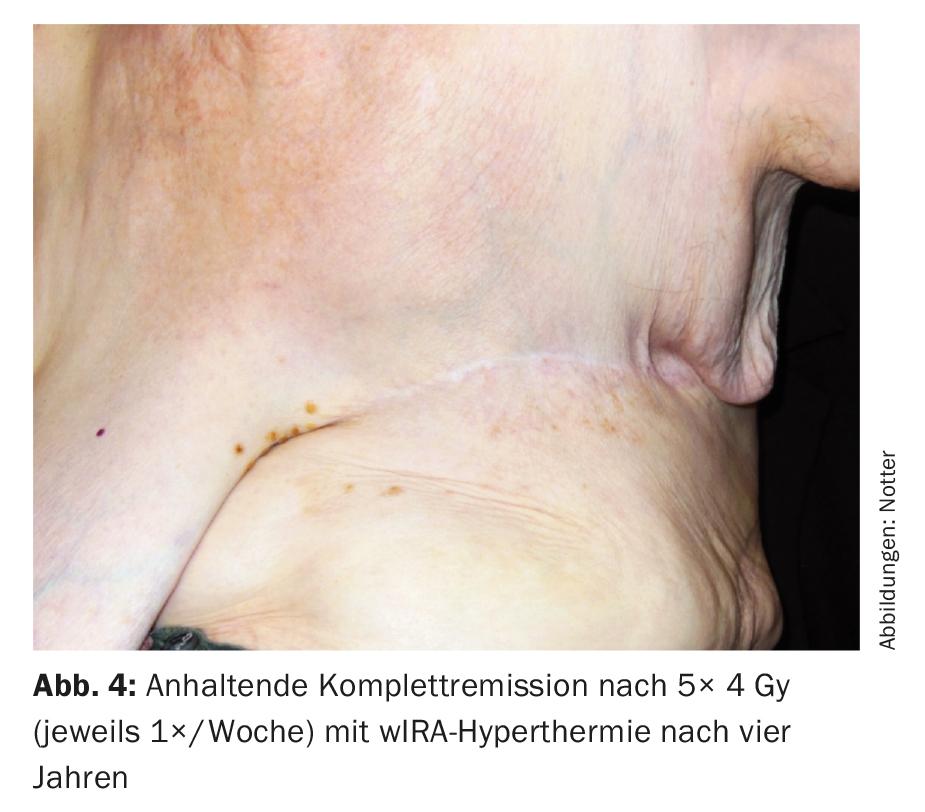
Celle-ci a toujours été administrée le même jour, avant la RT, avec de l’infrarouge A filtré à l’eau (wIRA) contrôlé par thermographie pendant 45 minutes. La RT a été effectuée dans les deux minutes suivant la fin de l’HT, avec 4 Gy (9 MeV d’électrons) à chaque fois et une dose totale de 20 Gy. L’objectif principal était la région R1/R2, avec une large irradiation de toute la paroi thoracique gauche dans une intention prophylactique pour traiter les métastases occultes. Ce traitement a été bien toléré, avec pour seul effet secondaire une légère rougeur cutanée transitoire (CTCAE grade 1). Quatre ans plus tard, une rémission complète a également été observée (Fig. 4), qui s’est maintenue jusqu’à six ans plus tard (08/2017). Ceci est exceptionnel dans la mesure où des paramètres pertinents (résection R1/2, tumeur >10 cm, multifocalité, G3) plaideraient pour un risque très élevé de récidive locale.
Discussion
En raison de sa rareté, le RAAS du sein est généralement diagnostiqué trop tard et n’est souvent pas discuté de manière interdisciplinaire au départ/en préopératoire. Le standard est une résection chirurgicale R0 dans le cadre d’une mastectomie ou d’une résection locale de la paroi thoracique avec des marges de sécurité généreuses, mais malgré une radicalité R0, le risque de récidive locale est considérable, jusqu’à 66% [13]. Différentes approches visant à réduire le risque de récidive locale ont été décrites, avec des résections encore plus étendues (“superradicales”/”wide-margins”) et les déficits fonctionnels et les mutilations correspondants. Il a été démontré qu’une résection R0 est déterminante pour le pronostic, tant lors de la première opération qu’en cas de récidive, mais que de nouvelles récidives peuvent survenir malgré une résection R0 à partir de cellules microscopiques disséminées [13,14,16]. Il n’est pas clair dans quelle mesure la distance de résection chez les sujets sains est un facteur déterminant. Il existe des rapports qui n’ont pas pu démontrer de différence de pronostic entre une marge de résection libre <1 cm et >1 cm [14]. Une étude chirurgicale rétrospective récente portant sur 76 patients montre qu’une chirurgie “radicale”, qui consiste à retirer au moins toute la peau précédemment irradiée, a un bien meilleur pronostic qu’une chirurgie “conservatrice” (taux de récidive locale à 5 ans de 23% vs 76%) [16]. Cependant, les complications liées aux plaies étaient plus fréquentes. Il convient également de mentionner que, dans le cas des opérations “radicales”, le nombre de chimiothérapies concomitantes (ChT) était également significativement plus élevé, ce qui pourrait avoir agi comme un facteur de confusion.
En fin de compte, c’est surtout le contrôle des métastases microscopiques occultes dans la “zone à risque” qui semble déterminer le pronostic en tant que base pour la récidive suivante. La question se pose donc de savoir si le contrôle de la “zone à risque” étendue doit être obligatoirement chirurgical et s’il n’existe pas d’autres possibilités moins mutilantes. Les options sont donc une chimiothérapie néoadjuvante et une chimiothérapie adjuvante (ChT). Dans la plus grande analyse avec RAAS et ChT portant sur 95 patients, une chirurgie seule a été rétrospectivement comparée à une ChT (néo)adjuvante supplémentaire. Une nouvelle RT a été considérée comme contre-indiquée. En cas de faible chance de résection R0/R1 en préopératoire, la TC néoadjuvante a été réalisée. En postopératoire, la TC adjuvante a été réalisée en cas de lésions tumorales importantes, de G3 ou de distances de résection <1 cm. De façon surprenante, le groupe de mauvais pronostic avec chirurgie et TC a montré une amélioration significative de la survie sans récidive locale à 5 ans de 62,8% par rapport à la chirurgie seule avec 36,9%, mais sans influence significative sur les taux de survie à 5 ans [10]. Sur la base de ces données, il n’est malheureusement pas possible d’émettre une recommandation sûre concernant la ChT, d’une part parce qu’aucun régime de ChT uniforme n’a été utilisé et d’autre part parce qu’une analyse de sous-groupe n’est pas possible en raison du trop petit nombre de cas. Il faut également tenir compte du fait qu’un grand nombre de marraines, en raison de leur âge et de leur état général, ne supporteraient pas une ChT agressive.
Peut-on proposer une nouvelle RT malgré des antécédents importants ? Pour plusieurs cliniques et tumor boards, les antécédents médicaux sont encore considérés à tort comme une contre-indication en raison des toxicités possibles [10,14,16]. Comme l’a montré l’exemple de la re-RT (avec HT) des récidives mammaires et de la paroi thoracique, cela n’est pas justifié [15,17–20]. Le profil d’effets secondaires dépend du fractionnement, de la dose totale et de la latence entre la RT primaire et la re-RT planifiée. Les données disponibles à ce jour semblent plaider en faveur de l’utilisation d’une re-RT dans le RAAS [21]. De manière analogue aux récidives classiques de la paroi thoracique, il est intéressant de combiner une re-RT avec l’hyperthermie de surface (HT).
Dans le cas du cancer du sein récidivant, une méta-analyse portant sur 2110 patients a montré un taux de rémission complète de 60% avec un faible taux d’effets secondaires lorsque la re-RT et l’HT sont combinées [19]. L’hyperthermo/re-radiothérapie (HTreRT) en cas de récidive mammaire ou de la paroi thoracique est incluse dans les directives du NCCN comme “category 3 evidence”. L’HT est définie comme un réchauffement contrôlé des tissus jusqu’à une température de 39-43°C et agit principalement comme un radiosensibilisateur grâce à
- Inhibition de la réparation des dommages à l’ADN induits par les radiations
- Amélioration de la microperfusion tumorale avec sensibilisation des cellules hypoxiques et donc radiorésistantes [19].
Cette dernière est particulièrement utile dans le cas d’une paroi thoracique fibrosée et donc moins bien irriguée par les capillaires en raison d’un antécédent radiogénique [15].
Dans une revue de 222 patients atteints de RAAS, la chirurgie avec re-RT adjuvante a permis d’obtenir un meilleur contrôle local que la chirurgie seule. Cependant, dans 30% des cas, l’HT a été ajoutée à la re-RT [1].
Dans le cas du SRAA, une bonne réponse à la HTreRT combinée mentionnée est décrite, avec d’autres schémas de RT et une application HT différente de celle utilisée chez nous [22,23]. Des patients ont été inclus après de multiples récidives, ce qui explique le faible taux de survie à 5 ans de 11% à un âge médian de 70 ans, mais un bon effet palliatif avec des taux de contrôle à 3 ans de 46% (postopératoire) et 22% (HTreRT seule).
Conclusion
En résumé, une comparaison directe des différentes options thérapeutiques n’est pas réalisable de manière fiable en raison du faible nombre de cas et de la collecte rétrospective des données. Dans le cas d’une entité telle que le SRAA du sein, où l’on “court” souvent après la maladie sur le plan chirurgical, il faut viser un traitement interdisciplinaire proactif et bien coordonné. Il serait avantageux de discuter d’une HTreRT postopératoire dès la pose du diagnostic afin de couvrir la “zone à risque” de manière précoce. Le RAAS relève d’un tumor board spécialisé.
Messages Take-Home
- L’angiosarcome associé aux radiations (RAAS) est plus fréquent qu’intuitivement chez les patientes atteintes d’un cancer du sein irradié, avec une incidence d’environ 0,1%.
- et survient beaucoup plus tôt que les autres sarcomes associés aux radiations.
- Le diagnostic initial doit être posé le plus tôt possible et le traitement combiné doit être planifié dès le départ de manière interdisciplinaire lors d’un tumor board expérimenté.
- Paradoxalement, même pour cette tumeur radio-induite, la ré-irradiation est une bonne option thérapeutique avec un faible profil d’effets secondaires.
- Dans le cas du RAAS du sein/de la paroi thoracique, de nombreux arguments plaident en faveur d’un traitement interdisciplinaire comprenant une intervention chirurgicale et une radiothérapie adjuvante hyperthermique à grand champ semi-prophylactique.
- L’intérêt d’une thérapie systémique néo- ou adjuvante supplémentaire doit être évalué plus avant.
Littérature :
- Depla AL, et al : Treatment and prognostic factors of radiation-associated angiosarcoma (RAAS) after primary breast cancer : a systematic review. Eur J Cancer 2014 ; 50 : 1779-1788.
- Stewart FW, Treves N : Lymphangiosarcoma in postmastectomy lymphedema ; a report of six cas in elephantiasis chirurgica. Cancer 1948 ; 1 : 64-81.
- Huang J, Mackillop WJ : Risque accru de sarcome des tissus mous après radiothérapie chez les femmes atteintes d’un cancer du sein. Cancer 2001 ; 92 : 172-180.
- Fraga-Guedes C, et al : Angiosarcomes primaires et secondaires du sein : une expérience à institution unique. Breast Cancer Res Treat 2012 ; 132 : 1081-1088.
- Fury MG, et al : A 14-year retrospective review of angiosarcoma : clinical characteristics, prognostic factors, and treatment outcomes with surgery and chemotherapy. Cancer J 2005 ; 11 : 241-247.
- Vorburger SA, et al : Angiosarcoma of the breast. Cancer 2005 ; 104 : 2682-2688.
- Cahan WG, et al : Sarcoma arising in irradiated bone ; report of 11 cas. Cancer 1948 ; 1 : 3-29.
- Arlen M, et al : Radiation-induced sarcoma of bone. Cancer 1971 ; 28 : 1087-1099.
- Yap J, et al : Sarcoma as a second malignancy after treatment for breast cancer. Int J Radiat Oncol Biol Phys 2002 ; 52 : 1231-1237.
- Torres KE, et al : Résultats à long terme chez les patients atteints d’angiosarcomes du sein associés à une radiothérapie après une chirurgie et une radiothérapie pour un cancer du sein. Ann Surg Oncol 2013 ; 20 : 1267-1274.
- Manner J, et al : L’amplification du gène MYC de haut niveau est une caractéristique distinctive des angiosarcomes après irradiation ou lymphadéma chronique. Am J Pathol 2010 ; 176 : 34-39.
- Nestle-Kramling C, et al : [Hemangiosarcoma after breast-conserving therapy of breast cancer : report of four cases with molecular genetic diagnosis and literature review]. Strahlenther Onkol 2011 ; 187 : 656-664.
- Seinen JM, et al : Angiosarcome radio-associé après un cancer du sein : taux de récidive élevé et faible survie malgré un traitement chirurgical avec résection R0. Ann Surg Oncol 2012 ; 19 : 2700-2706.
- Lehnhardt M, et al. : [Radiation-induced angiosarcoma of the breast]. Handchir Mikrochir Plast Chir 2017 ; 49 : 103-110.
- Notter M, Piazena H, Vaupel P : Ré-irradiation hypofractionnée des cancers du sein récurrents de grande taille par hyperthermie infra-rouge-A contrôlée par thermographie et sans contact avec l’eau : une étude rétrospective de 73 patients. Int J Hyperthermia 2016 ; 1-10.
- Li GZ, et al : Angiosarcome mammaire cutané lié à la radiothérapie : la radicalité de la chirurgie affecte la survie. Ann Surg 2017 ; 265 : 814-820.
- Wahl AO, et al : Multi-institutional review of repeat irradiation of chest wall and breast for recurrent breast cancer. Int J Radiat Oncol Biol Phys 2008 ; 70 : 477-484.
- Vernon CC, et al : Radiothérapie avec ou sans hyperthermie dans le traitement du cancer du sein localisé superficiel : résultats de cinq essais randomisés et contrôlés. International Collaborative Hyperthermia Group. Int J Radiat Oncol Biol Phys 1996 ; 35 : 731-744.
- Datta NR, et al : Hyperthermia and Radiation Therapy in Locoregional Recurrent Breast Cancers : A Systematic Review and Meta-analysis. Int J Radiat Oncol Biol Phys 2016 ; 94 : 1073-1087.
- Datta NR, et al : Hyperthermia and reirradiation for locoregional recurrences in preirradiated breast cancers : a single institutional experience. Swiss Med Wkly 2015 ; 145 : w14133.
- Ghareeb ER, et al : Angiosarcome du sein primaire et radio-induit : Prédicteurs clinicopathologiques des résultats et l’impact de la radiothérapie adjuvante. Am J Clin Oncol 2016 ; 39 : 463-467.
- Linthorst M, et al : Effet d’une chirurgie, d’une ré-irradiation et d’une thérapie hyperthermique combinées sur le taux de contrôle local dans l’angiosarcome radio-induit de la paroi thoracique. Strahlenther Onkol 2013 ; 189 : 387-393.
- de Jong MA, et al : Reirradiation et hyperthermie pour les sarcomes associés aux radiations. Cancer 2012 ; 118 : 180-187.
InFo ONKOLOGIE & HÄMATOLOGIE 2017 ; 5(4) : 28-32











