La prise en charge thérapeutique du patient diabétique de type 2 évolue actuellement vers une approche personnalisée, avec des cibles glycémiques individualisées. Le clinicien a à sa disposition différentes classes d’antidiabétiques oraux, parmi lesquelles les nouvelles molécules ciblées sur la voie des incrétines, la tendance étant de réussir un bon équilibre glycémique tout en évitant les effets indésirables du traitement, en premier, les hypoglycémies et la prise pondérale. Le but de cet article est de faire le point sur les avantages et les inconvénients des anciens et nouveaux médicaments antidiabétiques.
Le diabète de type 2 est une des causes majeures de cécité, d’insuffisance rénale terminale, d’amputation non-traumatique et de morbi-mortalité cardiovasculaire au niveau mondial avec une incidence en augmentation progressive, en lien avec l’obésité et le mode de vie sédentaire. La physiopathologie de la maladie reste insuffisamment connue. L’insulino-résistance est typiquement présente longtemps avant le diagnostic, mais l’euglycémie est initialement maintenue. Par la suite, en raison d’un déficit sécrétoire de la cellule béta d’installation progressive, apparaît l’hyperglycémie, qui, en l’absence de dépistage, peut rester méconnue pendant de nombreuses années. Ce défaut sécrétoire du pancréas endocrine est multifactoriel, avec la contribution à la fois de l’insulino-résistance et hyper-insulinémie préalables, de facteurs génétiques intrinsèques à la cellule béta, et de l’effet de la glucotoxicité chronique. On observe également une augmentation de la production hépatique de glucose, et de la sécrétion du glucagon et un effet incrétine altéré.
L’effet bénéfique du bon contrôle glycémique sur les complications microvasculaires (rétinopathie, néphropathie, neuropathie) a été bien démontré par des larges études interventionnelles randomisées, mais le bénéfice sur les complications macrovasculaires est moins bien défini. Le suivi à long-terme des patients inclus à l’étude UKPDS qui bénéficiaient d’un contrôle glycémique strict visant à une HbA1C à 7% versus un contrôle glycémique standard à 7,9% a mis en évidence une diminution de la morbidité cardiovasculaire dix ans après la fin de l’étude. Cet effet n’a pas été retrouvé par d’autres études qui ont en plus démontré une augmentation du risque d’hypoglycémie ainsi qu’une augmentation du poids corporel chez les patients du bras «contrôle glycémique strict». Le clinicien doit par conséquent faire ses choix thérapeutiques tout en tenant compte du bénéfice clair sur la prévention de la microangiopathie du contrôle strict mais également du risque d’hypoglycémie associé au traitement agressif, surtout chez le patient âgé et fragile sur le plan cardiovasculaire.
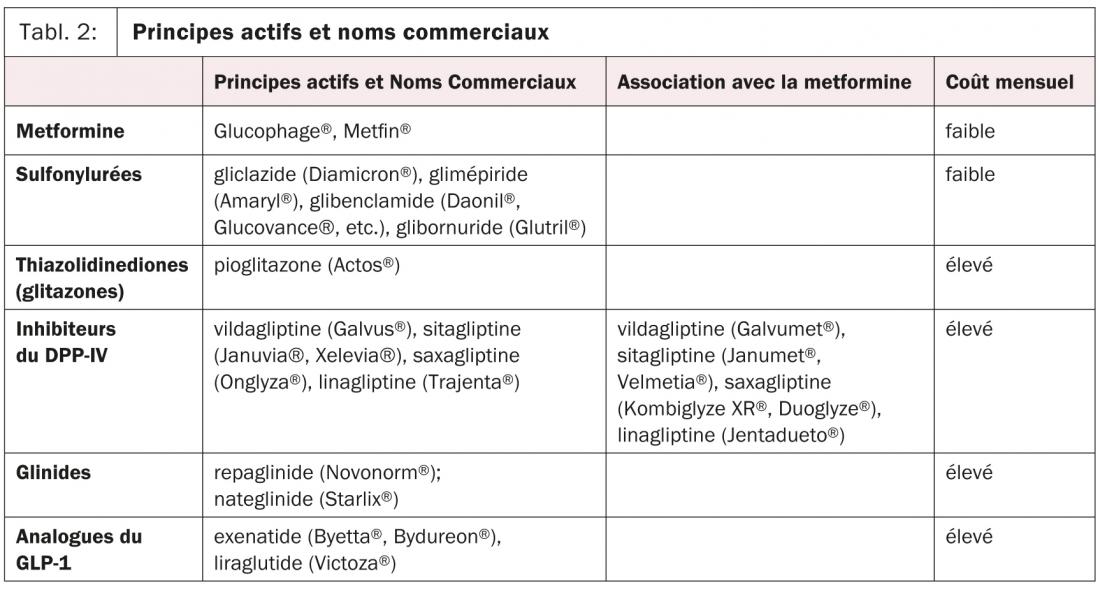
Les recommandations de l’ADA publiées en juin 2012 mettent en valeur ces principes et proposent une approche personnalisée du malade diabétique, avec comme objectif glycémique une HbA1C <6,5–7% pour les nouveaux patients en bon état général mais beaucoup moins strict pour le patient âgé avec des comorbidités cardiovasculaires. Les mesures hygiéno-diététiques, l’intensification de l’activité physique et la réduction du poids corporelle restent prioritaires. Le diabétologue ou médecin généraliste est beaucoup plus libre qu’auparavant à faire son choix parmi les différentes classes d’antidiabétiques oraux (biguanides, insulino-secrétagogues, glitazones, gliptines, analogues du GLP-1), de manière individualisée. Ce choix tient compte de l’efficacité de chaque médicament sur le plan glycémique, de la tolérance, de l’effet sur la prévention des complications et le risque cardiovasculaire, des effets indésirables (sécurité) à moyen ou à long terme (par exemple prise pondérale) (tabl. 1), et bien sûr du coût (tabl. 2).

La Metformine
La metformine reste la base du traitement pour le patient diabétique de type 2 en l’absence de contre-indications, grâce à son efficacité sans risque d’hypoglycémie, à la sécurité à long-terme, à son effet neutre sur le poids et au fait qu’elle semble diminuer le risque d’événements cardiovasculaires chez le patient diabétique nouvellement diagnostiqué. Son mode d’action implique la diminution de la production hépatique du glucose via l’activation de l’AMP-protéine kinase, avec également une diminution de l’insulinorésistance. La limitation principale de ce traitement est l’intolérance digestive (diarrhées, acidité gastrique) qui est dose-dépendante et qui impose la titration progressive. Il est nécessaire de rester prudent en cas d’insuffisance rénale notamment pour le risque d’acidose lactique, un effet indésirable rare mais grave, et la metformine est contre-indiquée quand la clairance à la créatinine baisse à <35 ml/min/1,73 m2.
Et lorsque la metformine ne suffit pas?
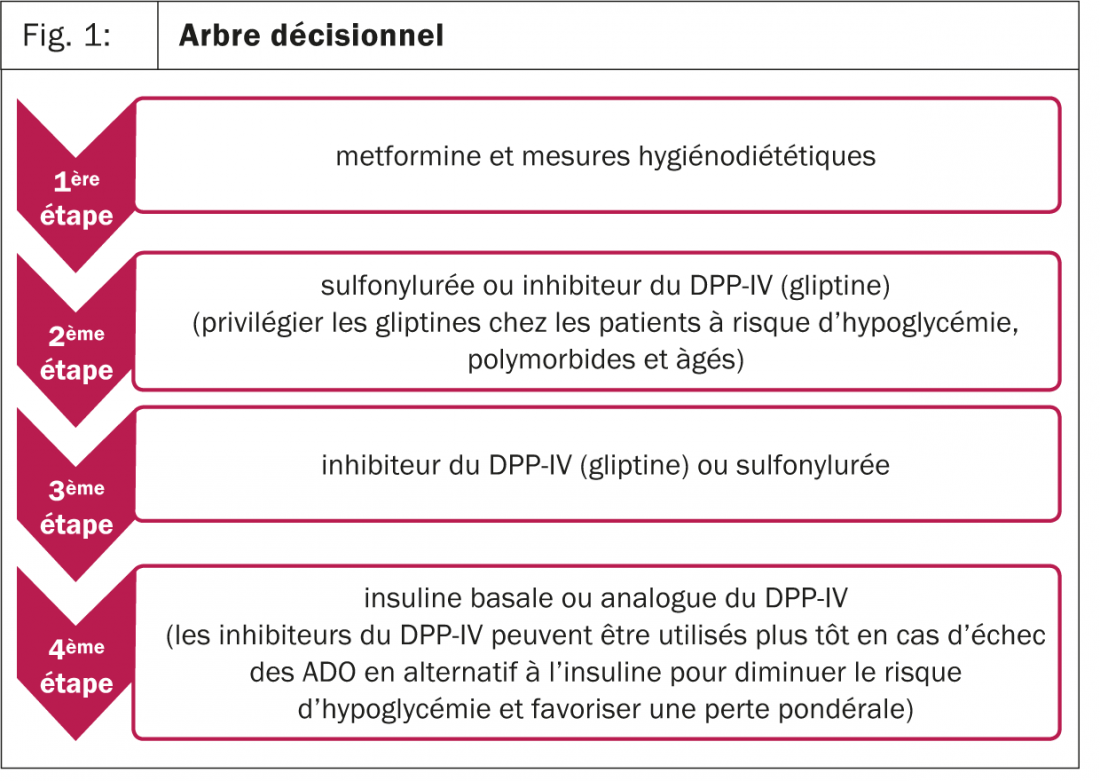
Quand les cibles d’HbA1C ne sont pas atteintes après trois à six mois sous monothérapie par metformine, il est indiqué d’ajouter un deuxième antidiabétique oral, un analogue du GLP-1 ou de l’insuline (fig. 1). Plusieurs études ont comparé différents types de bithérapie à la monothérapie par metformine, mais les études qui ont comparé directement les ADO de deuxième ligne entre eux quand ils sont ajoutés à la metformine sont peu nombreuses. On a en tout cas des indications que chacune des différentes classes thérapeutiques permet, quand ajoutée au traitement initial, une diminution de l’HbA1C de 0,9–1,1%.
Les glitazones
Toujours avec un effet sur l’insulinorésistance musculaire et hépatique et sur la production hépatique du glucose, les thiazolidinediones (TZDs) ou glitazones (rosiglitazone, pioglitazone) sont des molécules activatrices du PPR-γ et semblent avoir un effet qui perdure plus longtemps que celui de la metformine et des insulino-sécrétagogues, sans augmentation du risque d’hypoglycémie. Pourtant, la rosiglitazone (Avandia®) a été retirée du marché récemment suite à la mise en évidence d’un risque accru d’infarctus du myocarde sous ce traitement, et la pioglitazone (Actos®), qui aurait été associée à une diminution des événements chez les patients vasculaires a été incriminée d’une possible augmentation du risque de cancer de la vessie. Les glitazones sont actuellement très peu utilisées, malgré leurs avantages, en raison des effets indésirables, tels que la rétention hydrique (problématique surtout en cas d’insuffisance cardiaque) et l’augmentation du risque de fracture.
Les sulfonylurées
Parmi les traitements qui agissent sur l’insulino-sécrétion, les plus utilisés sont les sulfonylurées. Ces médicaments se lient sur le canal potassique ATP-dépendant de la cellule béta et stimulent par ce biais la production endogène d’insuline. Malgré leur efficacité sur l’hyperglycémie, les inconvénients principaux des sulfonylurées sont le risque accru d’hypoglycémie, une augmentation modérée du poids corporel et possiblement une durabilité restreinte, attribuée à un épuisement de la cellule béta. A noter que, parmi les différentes molécules disponibles sur le marché, la gliclazide est celle associée à un risque d’hypoglycémie relativement faible, étant donné qu’elle produit moins de métabolites actifs, mais avec, dans ce contexte, une puissance hypoglycémiante souvent moindre, comparée à la glibenclamide et la glimépiride.
Les glinides
Les glinides (meglitinides) agissent de manière similaire aux sulfonylurées mais avec une durée d’action plus courte, ce qui les rend surtout utiles sur le contrôle glycémique postprandial. La nateglinide (Starlix®) et la répaglinide (Novonorm®) sont responsables de moins d’hypoglycémies par rapport aux sulfonylurées et peuvent servir même dans le cadre d’une insuffisance rénale qui est, par ailleurs, un frein à l’utilisation des sulfonylurées comme pour la metformine.
Le concept des incrétines
Les traitements anti-hyperglycémiants basés sur les actions de l’incrétine «glucagon-like peptide 1» (GLP-1) sont les nouvelles thérapies prometteuses, commercialisées depuis moins de dix ans. Le GLP-1 est une hormone produite au niveau intestinal en réponse au passage de l’alimentation par le tube digestif, qui stimule la synthèse et la sécrétion d’insuline et diminue la sécrétion du glucagon (donc diminue la production hépatique du glucose) de manière glucose-dépendante, avec également des effets supplémentaires tels qu’un ralentissement du vidage gastrique et une augmentation de la satiété. Cependant, le GLP-1 endogène est relativement instable et est rapidement métabolisé avec comme enzyme clé de la cascade de dégradation, le DPP-IV. Deux types de traitement ciblés sur cette voie ont ainsi été développés, les inhibiteurs du DPP-IV, disponibles pour administration per os, et les agonistes des récepteurs du GLP-1, qui sont donnés uniquement en voie parentérale, sous forme d’injections sous-cutannées.
Les gliptines
Les inhibiteurs du DPP-IV (gliptines) commercialisés en Suisse sont la vildagliptine (Galvus®), la sitagliptine (Januvia®, Xelevia®), la saxagliptine (Onglyza®) et la linagliptine (Trajenta®). Ils existent également en association avec la metformine, pour favoriser la compliance au traitement (Galvumet®, Janumet®, Velmetia®, Kombiglyze®, Jentadueto®). Ils sont associés à un risque d’hypoglycémies moindre par rapport aux sulfonylurées, une bonne tolérance et l’absence de prise pondérale et peuvent également être utilisés dans le cadre d’une insuffisance rénale, avec une adaptation de la dose (sauf pour la linagliptine qui ne nécessite aucune adaptation). Leur utilisation a été initialement restreinte, ceci à cause de l’impression qu’ils restent moins efficaces que les sulfonylurées sur l’HbA1C, mais les premières études à moyen terme mettent en évidence un effet comparable sur l’équilibre glycémique.
Les analogues du GLP-1
Les analogues du GLP-1 (exénatide, liraglutide) sont des agents injectables (sc) avec comme avantage principal un effet bénéfique sur le poids corporel, action très intéressante pour le patient diabétique de type 2, obèse. Leur utilisation est surtout freinée par la mauvaise tolérance digestive initiale, souvent de courte durée. A noter qu’il est conseillé d’évaluer l’effet sur l’équilibre glycémique et/ou le poids quelques mois après l’introduction des GLP-1 analogues, dans le but d’éviter de poursuivre un traitement très coûteux chez un non-répondeur.
Pour ces deux nouvelles classes thérapeutiques, la crainte est principalement l’absence de données sur la sécurité à long-terme surtout par rapport à un possible effet sur le pancréas exocrine (augmentation du risque relatif de pancréatite aigüe/chronique, cancer du pancréas), qui n’est pour le moment pas retenu. Des éventuels effets bénéfiques sur le risque cardiovasculaire restent à être démontrés.
Conclusion
En résumé, après la metformine, les inhibiteurs du DPP-IV sont une alternative aux sulfonylurées, à considérer surtout chez les patients à risque d’hypoglycémie (fig. 1). Malgré tout, la tendance thérapeutique actuelle pour le patient diabétique de type 2 est d’adapter les cibles d’HbA1C au profil du patient, avec des objectifs moins ambitieux pour les patients âgés et poly-morbides, et des choix médicamenteux personnalisés.
Dr méd. Maria I. Mavromati
Références:
- Gerstein HC, Miller ME, Byington RP: Effects of intensive glucose lowering in type 2 diabetes. N Engl J Med 2008; 358: 2545–2559.
- Bolen S, Feldman L, Vassy J: Comparative effectiveness and safety of oral medications for type 2 diabetes mellitus. Ann Intern Med 2007; 147: 386–399.
- Nauck MA: Incretin-based therapies for type 2 diabetes mellitus: properties, functions and clinical implications. Am J Med 2011; 124(Suppl.): S3–S18.
- Inzucchi SE, et al.: Management of hyperglycemia in type 2 diabetes: a patient cantered approach: Position statement of the American diabetes association (ADA) and the European association for the study of diabetes (EASD). Diabetes Care 2012; 35: 1364–1379.
- ADA: Standards of medical care in diabetes-2013. Diabetes Care 2013: 36(Suppl.1): S11–S66.
CARDIOVASC 2013; 12(6): 4–9











