La conférence de l’American Heart Association à Chicago a surtout attiré l’attention avec deux mises à jour d’études attendues depuis longtemps. Nous allons maintenant examiner de plus près les principaux résultats des études IMPROVE-IT et DAPT. Comment les données doivent-elles être classées et quelle est leur pertinence pratique ?
(ag) Ce qui est certain, c’est que la réduction du cholestérol LDL est un pilier de la prévention cardiovasculaire. Les preuves proviennent principalement d’études sur les statines. Ceux-ci ont montré une réduction de la morbidité et de la mortalité (les statines à forte dose ont réduit encore plus le taux d’événements cardiovasculaires non fatals). A ce jour, aucun autre traitement hypolipémiant n’a pu démontrer un bénéfice clinique en complément des statines (fibrates, niacine, inhibiteurs de la CETP). Les lignes directrices de l’AHA/ACC soulignent également l’utilisation relativement agressive des statines. L’objectif d’IMPROVE-IT était de démontrer que la réduction du LDL attendue, environ 20 % plus importante avec l’ézétimibe (par rapport aux statines), se reflétait également dans les résultats cliniques. Il s’agit non seulement de la plus grande étude sur les hypolipémiants, mais aussi de la plus longue. Les données clés : 18 144 patients atteints de syndrome coronarien aigu (SCA) examinés, recrutés dans 1158 centres dans 39 pays et suivis pendant sept ans en moyenne. Il s’agissait de savoir dans quelle mesure les patients SCA à haut risque qui ont déjà des taux de LDL-cholestérol bas (50-125 mg/dl ou 50-100 mg/dl s’ils prenaient déjà une statine auparavant) tirent profit de l’ajout d’une non-statine à leur traitement standard par statine. Les résultats peuvent être considérés comme positifs.
Benefit confirme – Sécurité bien
Les patients, qui devaient être âgés d’au moins 50 ans, ont été inclus dans l’étude dans les 10 jours suivant leur hospitalisation (environ 5000 pour STEMI, les autres pour NSTEMI ou angine de poitrine instable). Ils présentaient tous au moins une caractéristique qui les caractérisait comme des patients à haut risque d’événements cardiovasculaires futurs, par exemple une crise cardiaque antérieure, du diabète, une maladie artérielle périphérique occlusive ou une maladie cérébrovasculaire, une maladie coronarienne sur plusieurs artères ou un pontage chirurgical. 9077 ont reçu la statine simvastatine (40 mg), 9067 ont également pris de l’ézétimibe (10 mg), un inhibiteur de la résorption du cholestérol.
Comparé au groupe recevant uniquement de la simvastatine et un placebo, le groupe ayant reçu l’ézétimibe en complément a montré une réduction de 6,4% du risque cardiovasculaire (critère d’évaluation principal composé de décès cardiovasculaire, d’infarctus du myocarde, de angor instable avec hospitalisation, de revascularisation coronarienne ou d’accident vasculaire cérébral). Le taux d’événements était de 34,7 vs. 32,7% dans le groupe de contrôle et le groupe d’étude respectivement (HR 0,936, IC 0,887-0,988, p=0,016). En ce qui concerne l’infarctus du myocarde et l’accident vasculaire cérébral, la probabilité était réduite de 14% (de manière significative pour le premier, mais pas pour le second). Les patients sous ézétimibe étaient également nettement moins exposés à un AVC ischémique (réduction du risque de 21%, p=0,008). Aucune différence n’a été observée entre les groupes en ce qui concerne la mortalité globale.
L’ajout d’ézétimibe n’a pas entraîné d’augmentation significative des effets secondaires (par exemple, problèmes musculaires ou de vésicule biliaire, cancer), et la sécurité était toujours bonne.
Plus c’est profond, mieux c’est ?
L’ajout d’ézétimibe au traitement par simvastatine réduit donc la probabilité de souffrir de problèmes cardiovasculaires tels qu’un infarctus du myocarde ou un accident vasculaire cérébral à l’avenir chez les patients SCA à haut risque. La réduction supplémentaire du LDL apporte donc un bénéfice significatif. Les résultats sont certes plutôt modérés en termes d’ampleur, mais compte tenu du bon profil de sécurité, certains experts les considèrent comme suffisants pour justifier un tel traitement en pratique clinique.
La bithérapie a réduit le cholestérol LDL à une valeur moyenne d’environ 54 mg/dl (contre 69 mg/dl dans le groupe témoin). Il est intéressant de noter que les patients dont le contrôle est déjà bas et qui ont atteint la valeur LDL cible cliniquement appropriée bénéficient d’une réduction encore plus importante. Dans la pratique clinique quotidienne, il ne viendrait probablement pas à l’idée de traiter de tels patients avec un autre hypolipémiant. Selon les auteurs, le principe “even lower is even better” s’applique toutefois ici. Cela peut être considéré comme une confirmation des résultats de l’étude TIMI, qui a montré de meilleurs résultats cliniques avec une statine particulièrement puissante, qui a également réduit le LDL plus que les statines à dose régulière. Il confirme l’hypothèse LDL selon laquelle un LDL-C plus bas prévient les événements cardiovasculaires. Les futurs guidelines pourraient se référer à ce résultat.
Les critiques ont fait remarquer que les choses avaient évolué depuis le début de l’étude IMRPOVE-IT et que Simvastatine 40 mg n’était plus très utilisé dans la pratique (car les directives américaines recommandent des statines plus fortement dosées). Selon cet avis, il aurait été plus intéressant de tester l’ajout d’ézétimibe avec des statines plus puissantes.
DAPT – Que s’est-il passé ?
La deuxième étude très attendue était l’étude DAPT (Fig. 1). Elle a testé la double inhibition plaquettaire prolongée chez des patients atteints de maladie coronarienne et équipés d’un stent à revêtement médicamenteux (DES). Soyons clairs : le double traitement antiplaquettaire de 30 mois (aspirine plus clopidogrel ou prasugrel) a entraîné significativement moins de caillots sanguins dans les stents et moins de crises cardiaques que le traitement correspondant plus court (12 mois plus 18 mois d’aspirine + placebo). Ces résultats vont au-delà de la pratique clinique actuelle : les recommandations américaines ne préconisent qu’une double antiagrégation plaquettaire de douze mois, les recommandations européennes préconisent même une double antiagrégation plaquettaire de six à douze mois maximum après l’implantation d’un DES.
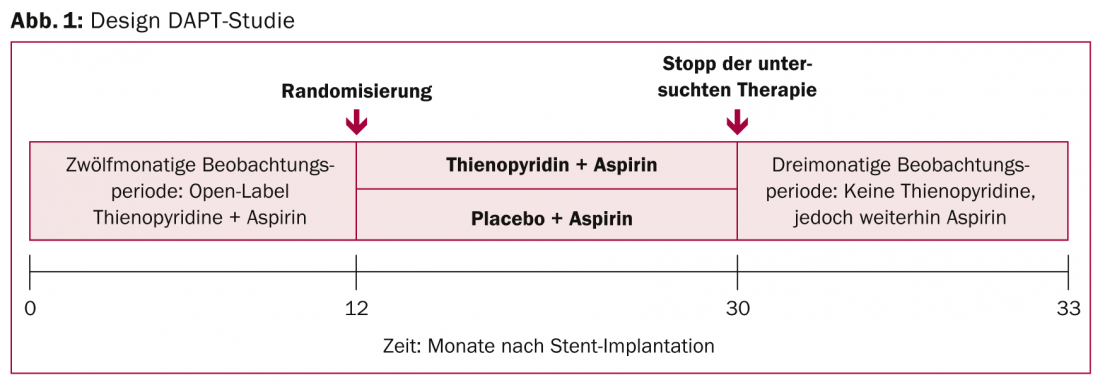
9961 patients ont été randomisés et suivis pendant environ trois ans (33 mois). Concrètement, le traitement prolongé (n=5020) a réduit de plus de moitié le risque de thrombose dite “in-stent” à 30 mois : Dans le groupe étudié, le taux de thrombose de stent, le critère d’évaluation principal, était de 0,4% (vs. 1,4%, HR 0,29, IC 0,17-0,48, p<0,001). Le critère d’évaluation coprimaire consistant en des événements indésirables cardiovasculaires ou cérébrovasculaires pertinents a également montré une différence significative de 29% en faveur de la variante de traitement de 30 mois. Une composante importante de celui-ci, le taux d’infarctus du myocarde, était de 2,1% (vs. 4,1%, HR 0,47, IC 0,37-0,61, p<0,001) et était donc également réduit de moitié. Le bénéfice en termes de thromboses intra-stents et d’infarctus du myocarde s’est étendu à toutes les combinaisons de médicaments, aux stents récents et anciens et à tous les groupes à risque. Les bénéfices ont compensé les risques liés à la prolongation du traitement, du moins dans l’analyse primaire : Bien que les hémorragies modérées à sévères aient été significativement plus fréquentes (critère de sécurité primaire : 2,5 vs. 1,6%), le taux d’évolution fatale était faible dans les deux groupes et ne présentait pas de différences significatives.
Augmentation surprenante de la mortalité
L’administration pendant 30 mois n’a pas permis de réduire la mortalité totale ou le taux d’AVC. Au contraire, une analyse secondaire incluant des données après l’arrêt du traitement (après 33 mois) a montré une augmentation de 0,8% de la mortalité totale pour le groupe étudié (apparemment due à un traumatisme et à un cancer et non à des causes cardiovasculaires). Cette différence est significative et totalement inattendue. Associée à des taux de saignement plus élevés, elle a terni des résultats par ailleurs satisfaisants. Les auteurs de l’étude supposent qu’il y avait des différences dans les groupes d’étude lors du recrutement. Les personnes dont le cancer a déjà été diagnostiqué peuvent avoir été réparties différemment. Face à ce résultat surprenant, ils ont entrepris une méta-analyse [1] de nombreux grands essais cliniques qui avaient également étudié la double inhibition des plaquettes (avec des durées de traitement différentes). Pour la durée de traitement plus longue, aucune différence n’a été observée en termes de mortalité totale ou non cardiovasculaire par rapport à l’aspirine seule ou à un traitement plus court. C’est pourquoi ils considèrent actuellement qu’il s’agit d’une découverte isolée.
Un résultat important avec des limites
Jusqu’à présent, il était clair que la double antiagrégation plaquettaire était absolument essentielle pour la prévention de tous ces patients – après tout, un caillot sanguin, que ce soit dans le stent ou dans d’autres vaisseaux sanguins, représente l’un des risques les plus dangereux après la mise en place d’un DES. Mais le fait que les bénéfices se poursuivent au-delà de la durée standard d’un an n’a jamais été confirmé par une étude aussi importante et bien menée. D’une part, la double antiagrégation plaquettaire à long terme peut donc être envisagée chez certains patients. La sélection des personnes éligibles est essentielle à cet égard (l’étude a exclu les patients présentant des saignements importants avant ou un an après l’administration d’un stent/d’une double antiagrégation plaquettaire). Il est intéressant de noter qu’il semble exister une sorte de phénomène de rebond : après l’arrêt de la double antiagrégation plaquettaire, le risque ischémique est augmenté pendant environ trois mois [2], raison pour laquelle l’option d’un traitement continu, voire à vie, par double antiagrégation plaquettaire pour certains patients à haut risque a été discutée lors du congrès.
D’autre part, l’augmentation du taux de saignement doit être prise en compte dans tous les cas. En outre, comme indiqué précédemment, l’étude n’a testé son hypothèse que chez des patients dont il était clair qu’ils avaient bien toléré la double antiagrégation plaquettaire pendant un an. De plus, les résultats ne peuvent pas être généralisés (seuls certains types de stents et d’antiagrégants plaquettaires ont été testés et non comparés entre eux).
L’étude a été publiée en parallèle dans le New England Journal of Medicine [3].
Source : American Heart Association (AHA) 2014 Scientific Sessions, 15-19 novembre 2014, Chicago
Littérature :
- Elmariah S, et al : Extended duration dual antiplatelet therapy and mortality. The Lancet (en anglais). Publié en ligne : 16 novembre 2014.
- Garratt KN, et al. : Circulation 2014 Nov 16. pii : CIRCULATIONAHA.114.013570 [Epub ahead of print].
- Mauri L, et al : N Engl J Med 2014 ; 371 : 2155-2166.
CARDIOVASC 2015 ; 14(1) : 36-38











