La privation de sommeil est une option de traitement chronothérapeutique des troubles dépressifs utilisée depuis plusieurs décennies. Le traitement de la privation de sommeil est rapide et bien efficace, facile à mettre en œuvre, non invasif, rentable et adapté au traitement de la dépression en ambulatoire et en hospitalisation. La privation de sommeil entraîne dans le cerveau une dissociation fonctionnelle du cingulum antérieur du réseau de repos, ainsi qu’un recrutement accru du cortex préfrontal dorsolatéral. Un traitement basé sur des lignes directrices inclut la privation de sommeil comme élément complémentaire pour une réponse rapide et pour augmenter un traitement existant. Les patients ayant des antécédents de convulsions ou de dépression délirante ne doivent pas être privés de sommeil.
Il existe un lien étroit entre l’affectivité et les rythmes chronobiologiques. Le cycle veille-sommeil joue un rôle particulier à cet égard : les modifications de l’architecture du sommeil et de l’affect, que ce soit vers le pôle dépressif ou vers le pôle maniaque, sont interdépendantes. Environ 60 à 80% des patients atteints de troubles dépressifs souffrent également de troubles insomniaques. Souvent, les troubles du sommeil – en particulier les réveils matinaux précoces – précèdent immédiatement un épisode dépressif. Ainsi, il semble à première vue paradoxal qu’une restriction du sommeil puisse entraîner une réduction des symptômes cliniquement pertinente dans le cas d’une dépression déjà manifeste. Le traitement de la privation de sommeil, ou thérapie d’éveil, est classé dans le groupe des médicaments chronothérapeutiques. Il s’agit de modifier les conditions environnementales de manière à influencer de manière ciblée les biorythmes des patients (par ex. privation de sommeil, décalage des phases de sommeil, luminothérapie, thérapie par l’obscurité). Plus de 60 études ont montré que 50 à 80% des patients dépressifs tirent un bénéfice significatif de la privation de sommeil. En particulier dans des conditions de traitement compliquées comme la dépression bipolaire, qui est associée à une faible réponse aux médicaments antidépresseurs, un effet antidépresseur peut être produit chez plus de la moitié des patients [1]. La puissance de l’effet est comparable à celle des antidépresseurs standard, avec une meilleure tolérance. Une caractéristique particulièrement importante est que le même effet antidépresseur, qui n’est obtenu qu’au bout de quatre à six semaines avec les médicaments antidépresseurs, se produit déjà dans les 24 à 48 heures. La privation de sommeil et le traitement par perfusion de kétamine, encore peu établi à ce jour, sont donc les deux seules stratégies thérapeutiques antidépressives disponibles avec un début d’action immédiat [2].
L’un des inconvénients de ce traitement est la courte durée de ses effets : plus de 80% des patients rechutent après une seule nuit de sommeil (appelée nuit de récupération) [3], et certains patients rechutent après de courtes “siestes” ou de courts épisodes de sommeil pendant la journée suivant la privation de sommeil. Néanmoins, certaines études ont montré une réponse soutenue après une privation totale de sommeil chez 5 à 10 % des patients bipolaires-dépressifs étudiés. Ces dernières années, diverses stratégies ont été développées pour produire une rémission durable (par exemple, des combinaisons avec du lithium, des antidépresseurs et la luminothérapie). L’effet antidépresseur puissant et immédiat, mais de courte durée, fait également de la privation de sommeil une méthode expérimentale privilégiée dans la recherche sur la dépression, car elle déclenche manifestement un mécanisme neurobiologique qui, sous la forme d’un “switch”, détermine l’état “dépressif” ou “non dépressif” du système. Après avoir initialement étudié les effets de la privation de sommeil sur la régulation électrophysiologique homéostatique et sur la neurotransmission, qui ont montré une augmentation du tonus sérotoninergique, noradrénergique et dopaminergique, les études récentes ont surtout fait appel à l’imagerie cérébrale fonctionnelle.
Modifications de la connectivité cérébrale après privation de sommeil
Les premières études utilisant la tomographie par émission de positons (TEP) ont montré que certains patients dépressifs présentaient une hyperactivité métabolique dans le cortex cingulaire antérieur (ACC) et une hypoactivité dans le cortex préfrontal dorsolatéral (DLPFC). Une normalisation inverse de ces changements a été corrélée à une atténuation des symptômes de la dépression. De nouvelles méthodes de recherche, telles que l’analyse de la connectivité des réseaux cérébraux à l’aide de l’imagerie par résonance magnétique fonctionnelle (IRMf), ont permis de mieux comprendre la pathophysiologie des syndromes dépressifs. Ainsi, une zone du cortex préfrontal appelée Dorsal Nexus a été identifiée comme présentant une hyperconnectivité marquée avec différents réseaux cérébraux chez les patients dépressifs [4]. Cette zone peut éventuellement servir de cible ou de biomarqueur pour la recherche sur les thérapies antidépressives.
Une étude menée par notre propre groupe de travail a montré que la privation de sommeil chez les sujets sains entraîne une dissociation fonctionnelle de l’ACC du réseau de repos, tout en augmentant le recrutement des zones du DLPFC via le nexus dorsal. D’autres études devront déterminer si les patients déprimés présentant une suractivation pathologique de l’ACC associée à une sous-activité du DLPFC – comme on le sait d’après des études antérieures – bénéficient spécifiquement d’une intervention corrigeant ce schéma par la privation de sommeil [5].
Pratique de la privation de sommeil dans le traitement de la dépression
Malgré des preuves scientifiques solides sur l’efficacité et la sécurité du traitement de la privation de sommeil, il n’occupe pas encore une place adéquate, surtout dans les soins primaires. Dans le guide de soins S3/national de la Société allemande de psychiatrie, psychothérapie, psychosomatique et de neurologie (DGPPN), elle est surtout considérée dans le cadre de l’offre multimodale des unités de soins psychiatriques et psychothérapeutiques. Le cadre hospitalier est avantageux dans la mesure où le maintien de l’éveil est facilité par la formation de groupes de patients privés de sommeil et le contrôle par le personnel soignant.
La facilité d’utilisation, le caractère non invasif et le rapport coût-efficacité de ces appareils les rendent également attractifs pour une utilisation ambulatoire. Selon les lignes directrices S3, la privation de sommeil devrait être utilisée comme mesure complémentaire à un traitement existant, surtout si une réponse rapide doit être obtenue ou si un traitement insuffisant doit être augmenté (tableau 1) [6].

Les indications sont aussi bien la dépression unipolaire que la dépression bipolaire, en particulier dans les cas où le traitement est réfractaire. Les patients bipolaires semblent même en tirer un meilleur profit que les patients unipolaires, si bien que certains auteurs considèrent que l’indication primaire du traitement par privation de sommeil concerne ce groupe de patients [7]. Les facteurs cliniques prédictifs d’une réponse à la privation de sommeil sont les variations de l’humeur au cours de la journée et la présence d’un syndrome somatique (“melancholic depression”).
La privation de sommeil entraînant une baisse du seuil de convulsion, les patients ayant des antécédents de convulsions ne doivent pas être traités de cette manière ou uniquement sous surveillance intensive et continue. Il en va de même pour les patients souffrant de dépression délirante, de tendances suicidaires aiguës et de multimorbidité. Le principal effet secondaire est évidemment une augmentation de la somnolence diurne, raison pour laquelle les patients ne doivent pas conduire de véhicules pendant les périodes d’éveil. De plus, des switchs maniaques ont été décrits chez des patients bipolaires, mais le risque n’est pas supérieur à celui des ISRS. Il convient donc d’être particulièrement prudent chez les patients pratiquant le vélo rapide. En raison du stress physique que provoque la privation de sommeil, il convient également d’être particulièrement attentif à la présence de maladies cardiovasculaires (tableau 2).

En pratique, deux formes de traitement de la privation de sommeil sont utilisées :
- Dans le cas de la privation partielle de sommeil , le patient se couche vers 22 heures, est réveillé à 1 heure (ou 3 heures) la même nuit, puis se rendort normalement la nuit suivante.
- Dans le cas de la privation totale de sommeil , le patient se lève à 7 heures le premier jour et passe par une phase d’éveil de 36 heures jusqu’à 19 heures le lendemain. Il est suivi d’un sommeil de récupération de douze heures jusqu’à 7 heures le lendemain, après quoi un nouveau cycle peut commencer (figure 1).
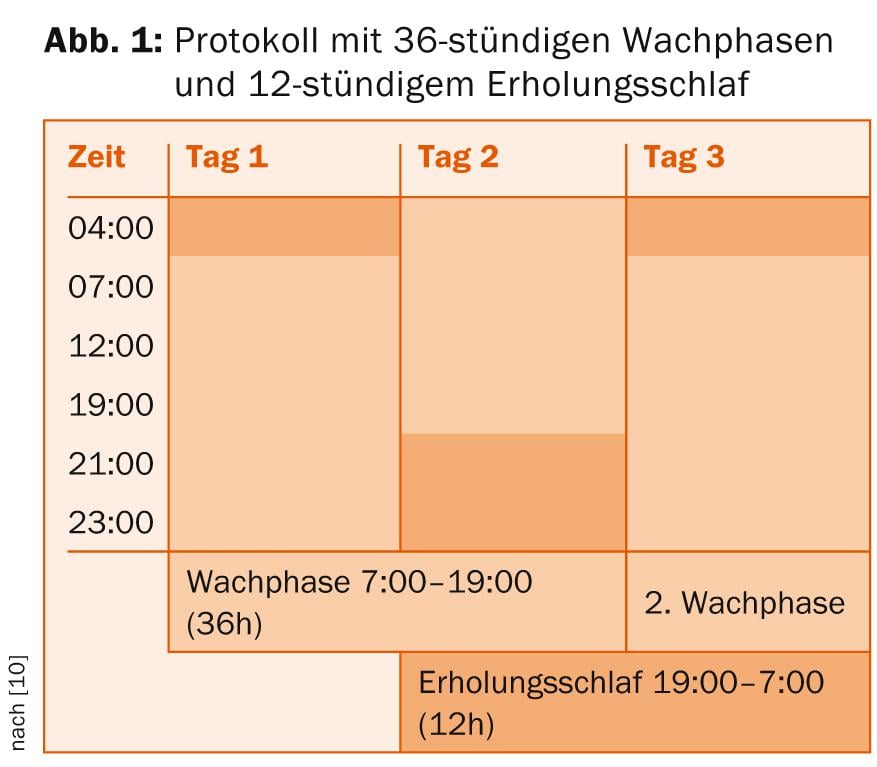
Les données probantes suggèrent de réaliser trois périodes de privation totale de sommeil en une semaine. Une médication déjà existante doit être poursuivie dans tous les cas, mais des ajustements doivent être faits si nécessaire pour les médicaments sédatifs afin de ne pas rendre le maintien de l’éveil inutilement difficile. Une autre possibilité de renforcer et, le cas échéant, de prolonger l’effet antidépresseur de la privation de sommeil consiste à utiliser des combinaisons d’antidépresseurs et de lithium (selon les lignes directrices S3, également du pindolol et des hormones thyroïdiennes). Toutefois, un traitement de la privation de sommeil peut être effectué sans qu’une médication supplémentaire ne soit nécessaire [8]. Un protocole dans lequel une luminothérapie supplémentaire (10 000 lux pendant au moins 30 minutes) est appliquée pendant les phases d’éveil et le matin après le sommeil réparateur semble particulièrement prometteur [9].
L’efficacité du traitement par privation de sommeil a été démontrée dans de nombreuses études internationales portant sur des milliers de patients dépressifs. Une combinaison rationnelle et scientifiquement fondée avec d’autres interventions chronothérapeutiques telles que la luminothérapie améliore les résultats, qui sont comparables à ceux d’un traitement pharmacologique, avec un début d’action beaucoup plus rapide et moins d’effets secondaires indésirables. Un manuel élaboré ces dernières années facilite en outre la mise en œuvre du traitement de la privation de sommeil dans les settings ambulatoires et hospitaliers [10].
L’utilisation de la privation de sommeil dans la recherche médicale a fourni des informations fascinantes sur les liens entre l’affectivité et la chronobiologie. En raison des preuves croissantes de l’efficacité et de la sécurité du traitement de la privation de sommeil, ainsi que de la pertinence de ses biomécanismes, de plus en plus de cliniciens et de chercheurs le considèrent comme un traitement de première ligne des troubles affectifs [7].
Littérature :
- Wirz-Justice A, Terman M : Handb Clin Neurol 2012 ; 106 : 697-713.
- Bunney BG, Bunney WE : Biol Psychiatry 2013 ; 73(12) : 1164-1171.
- Hemmeter UM, Hemmeter-Spernal J, Krieg JC : Expert Rev Neurother 2010 ; 10(7) : 1101-1115.
- Sheline YI, et al : Proc Natl Acad Sci U S A 2010 ; 107(24) : 11020-11025.
- Bosch OG, et al : Proc Natl Acad Sci U S A 2013 ; 110(48) : 19597-19602.
- DGPPN, et al. : 2010, Berlin, Heidelberg, New York : Springer-Verlag GmbH.
- Benedetti F, Colombo C : Neuropsychobiology 2011 ; 64(3) : 141-151.
- Bauer M, et al : World J Biol Psychiatry 2013 ; 14(5) : 334-385.
- Dallaspezia S, Benedetti F : Expert Rev Neurother 2011 ; 11(7) : 961-970.
- Wirz-Justice A, Benedetti F, Terman M : 2009, Bâle, Suisse : Karger.
InFo NEUROLOGIE & PSYCHIATRIE 2014 ; 12(2) : 16-18