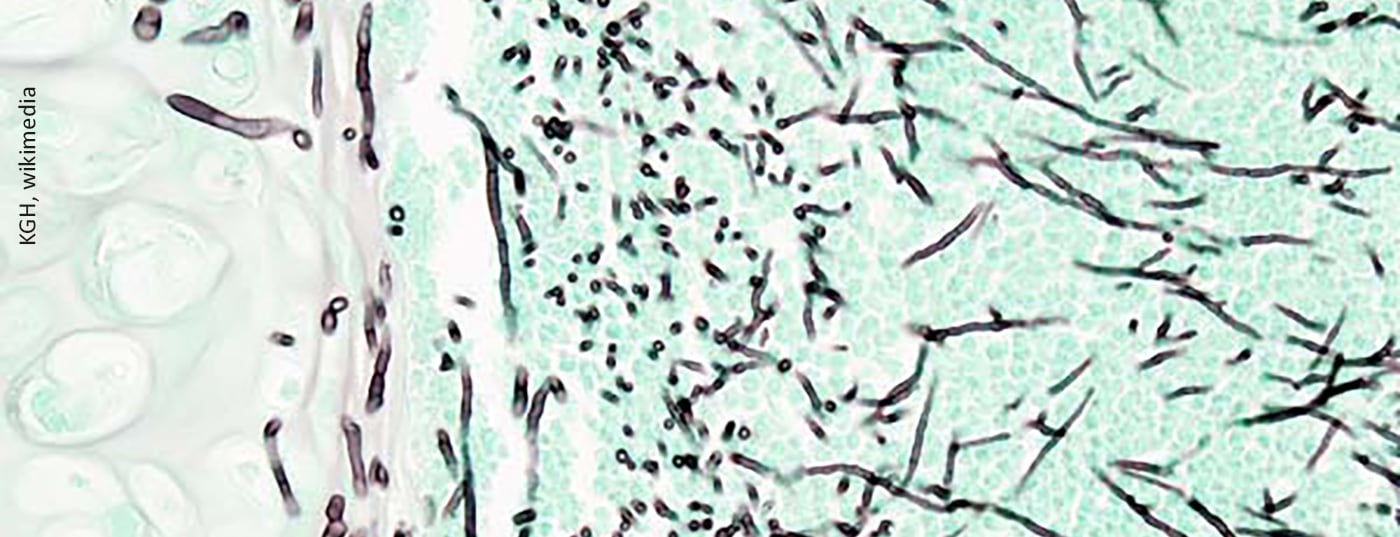
Corona n’est pas la seule à avoir des problèmes respiratoires dans ses bagages. L’aspergillose pulmonaire invasive peut également survenir de manière groupée, généralement très rapidement. C’est pourquoi il convient d’accorder une attention accrue à ce tableau clinique, en particulier chez les patients COVID-19 atteints de SDRA, afin de pouvoir prendre des mesures précoces appropriées en termes de diagnostic et de traitement.
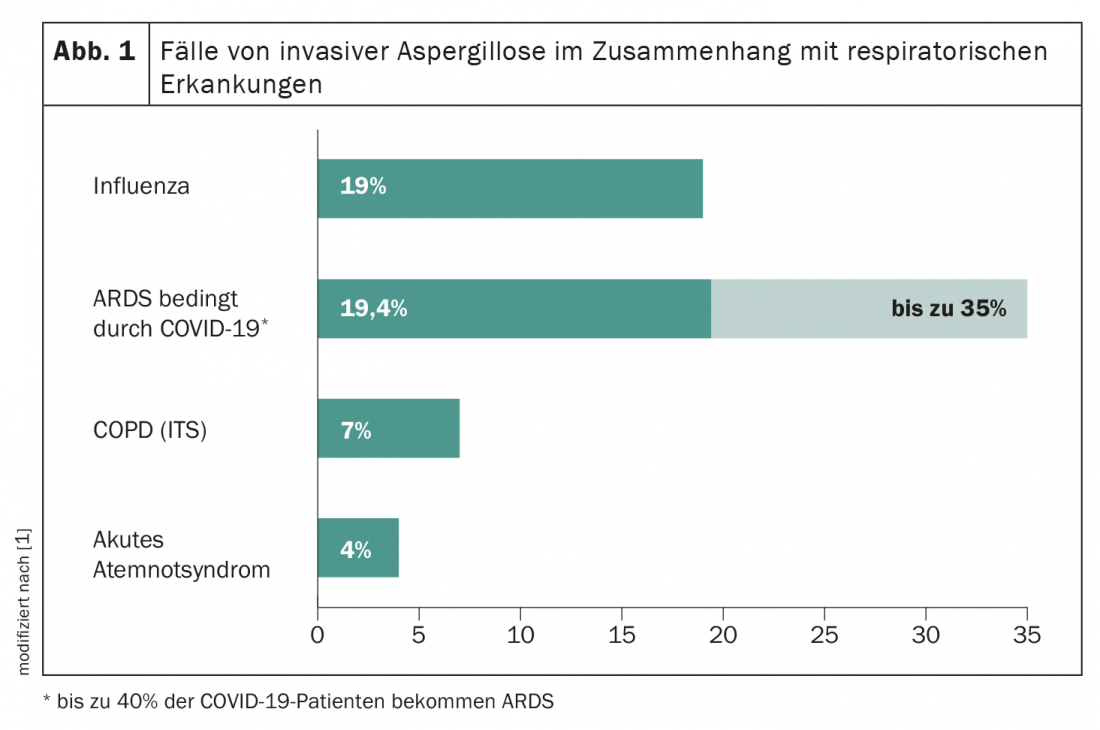
Des études récentes estiment que 35% des patients coronariens atteints du syndrome de détresse respiratoire aiguë (SDRA) développent une aspergillose pulmonaire invasive (API) associée au COVID-19. Le décryptage de la pathogenèse complexe du CAPA nécessite une compréhension moléculaire des processus physiologiques par lesquels l’infection par le SARS-CoV-2 facilite la pathogenèse fongique. Comme les autres coronavirus du SRAS, le SRAS-CoV-2 attaque et pénètre dans les cellules épithéliales et les pneumocytes de type II en liant la protéine spike du SRAS aux récepteurs de l’enzyme de conversion de l’angiotensine 2 (ACE2). Le clivage du domaine S1/S2 par la protéase transmembranaire de type 2 TMPRSS2 entraîne l’activation de la protéine spike, ce qui facilite l’entrée du virus dans la cellule cible via ACE2. Outre son rôle de récepteur du virus du SRAS, il a été démontré que l’ACE2 est également nécessaire pour la protection contre les lésions pulmonaires aiguës graves dans le SDRA. Ceci est soutenu par un polymorphisme d’insertion/délétion qui affecte l’activité de l’ECA et est associé à la susceptibilité au SDRA et à son issue. On ne sait pas si l’interaction préalable du SARS-CoV-2 avec les cellules hôtes, en perturbant la régulation du système rénine-angiotensine et/ou du système kallikréine-kinine, contribue au développement du CAPA.
La libération de modèles moléculaires associés à la menace au cours d’une infection grave par COVID-19 entraîne à la fois des dommages à l’épithélium pulmonaire et une maladie inflammatoire, qui sont des facteurs de risque prédisposant à l’aspergillose pulmonaire. De plus, les effets collatéraux des voies de reconnaissance de l’hôte, nécessaires à l’activation de l’immunité antivirale, peuvent paradoxalement contribuer à un environnement inflammatoire hautement permissif qui favorise la pathogenèse fongique.
Ne pas prendre le CAPA à la légère
Les facteurs de risque qui peuvent favoriser la CAPA sont notamment l’âge, le sexe masculin, l’hypertension, l’insuffisance rénale aiguë ou chronique, la BPCO et la prise d’inhibiteurs de la β-lactamase ou de corticostéroïdes. La plupart du temps, la co-infection par Aspergillus se produit dans les quatre premiers jours suivant le diagnostic de COVID-19. Des mesures diagnostiques pour l’aspergillose invasive devraient donc être mises en place chez les patients en état critique dont la maladie progresse. Pourtant, le diagnostic du CAPA reste difficile. Notamment parce que l’examen au galactomannane du liquide de lavage broncho-alvéolaire et la culture, qui sont les tests diagnostiques les plus sensibles pour l’aspergillose en soins intensifs, sont entravés par le fait que les bronchoscopies sont rarement réalisées chez les patients COVID-19 en raison du risque de transmission de la maladie. Les autopsies sont également rarement réalisées, ce qui peut conduire à une sous-estimation de la prévalence du CAPA.
Une gestion efficace de la thérapie souhaitée
Bien que l’on ne sache pas actuellement si le traitement antifongique de la CAPA associée au COVID-19 entraîne un avantage en termes de survie, le diagnostic devrait, dans la plupart des cas, déclencher un traitement antifongique précoce. Toutefois, cela n’est pas toujours facile en raison des interactions médicamenteuses possibles. L’utilisation du voriconazole, en particulier, peut être limitée. Comme il est métabolisé par le CYP2C19, le CYP2C9 et le CYP3A4, il fait partie des médicaments les plus fréquemment associés à des interactions médicamenteuses majeures dans les unités de soins intensifs. L’isavuconazole et l’amphotéricine B liposomale se sont avérés être les principales alternatives. Comparé au voriconazole, l’isavuconazole présente un profil pharmacocinétique plus favorable et est associé à moins de toxicités. L’amphotéricine B liposomale est une option de traitement alternative largement efficace, mais en unité de soins intensifs, l’insuffisance rénale rend souvent difficile l’introduction ou nécessite l’arrêt de cet antifongique. Cela est particulièrement vrai pour les patients infectés par le SRAS-CoV-2, qui présente un tropisme rénal et a été décrit comme une cause fréquente de lésions rénales. Les échinocandines pourraient être utilisées pour la thérapie combinée. Ils ne sont pas considérés comme des options de traitement de première intention de l’aspergillose invasive en raison de leur activité antifongique limitée contre Aspergillus spp. mais ils sont généralement bien tolérés et présentent une interaction synergique avec d’autres antifongiques.
Littérature :
- Arastehfar A, Carvalho A, van de Veerdonk FL, et al : COVID-19 Associated Pulmonary Aspergillosis (CAPA) -From Immunology to Treatment. J Fungi 2020 ; 6(2) : 91.
InFo ONKOLOGIE & HÉMATOLOGIE 2022 ; 10(2) : 16