Rapport de cas : En 2009, la patiente, alors âgée de 32 ans, a été opérée pour la première fois d’une tumeur cérébrale (glioblastome WHO °IV, DD : astrocytome anaplasique WHO °III, Mib-1 10%). Le traitement adjuvant recommandé [1] a été refusé en raison d’une grossesse existante. En 2011, une chirurgie de récidive a été effectuée avec une radiothérapie adjuvante (dose totale de 60 Gy). Histologiquement, la classification de la tumeur n’était toujours pas claire. L’indication d’une chimiothérapie a été discutée et recommandée en interdisciplinarité, mais n’a pas été réalisée à la demande de la patiente. Une nouvelle opération a eu lieu en cas de nouvelle récidive en décembre 2014 (glioblastome secondaire OMS °IV, IDH1 positif, MGMT méthylée, Mib-1 70%). Une radiochimiothérapie adjuvante avec un volume d’irradiation adapté a été planifiée, mais a été interrompue après trois irradiations (dose totale de 6 Gy) à la demande du patient ; la chimiothérapie a également été à nouveau refusée.
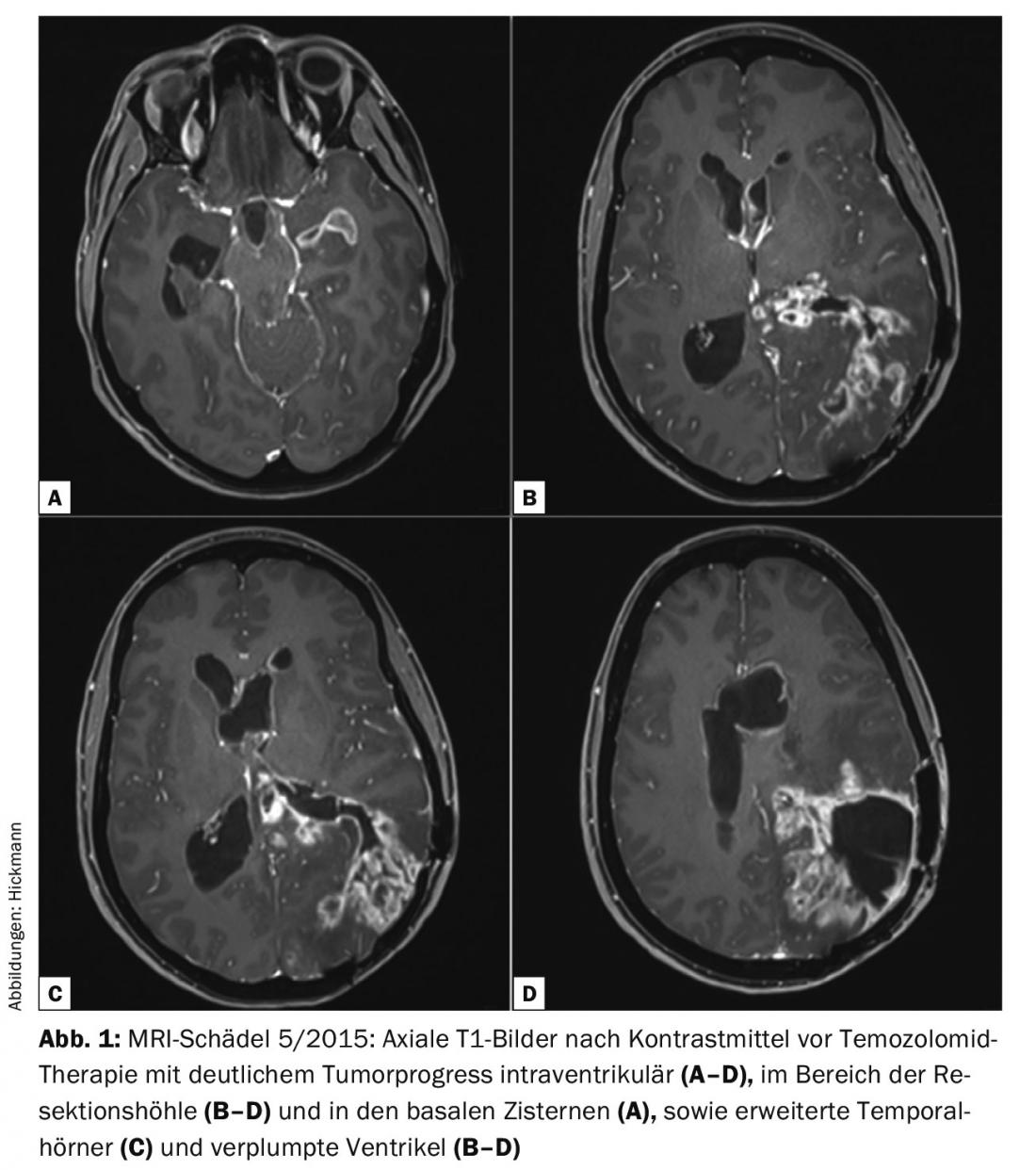
En mai 2015, la patiente somnolente a été admise en urgence avec une progression tumorale évidente et une manifestation tumorale intraventriculaire avec hydrocéphalie occlusive consécutive (Fig. 1).
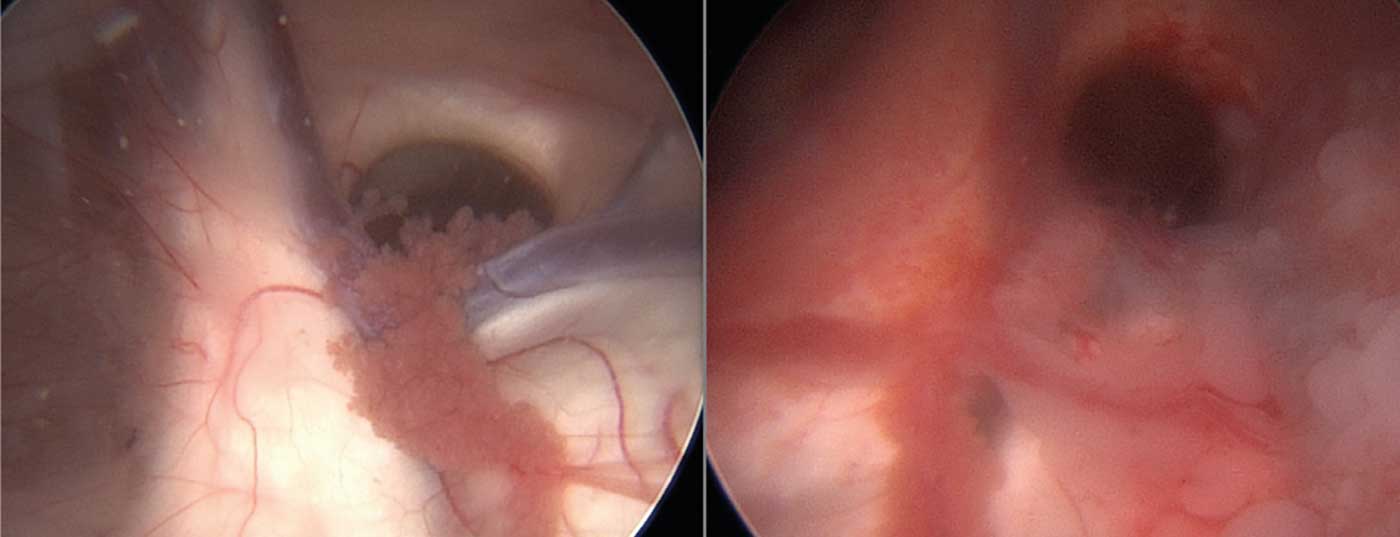
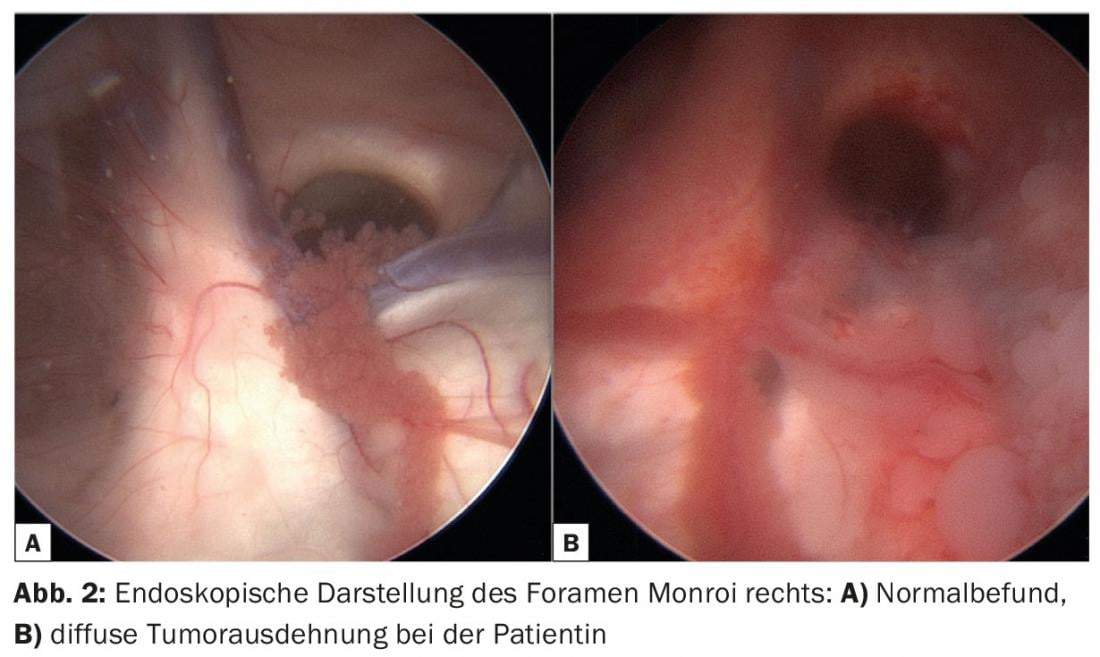
En cas de symptômes de pression intracrânienne progressifs, une ventriculo-cisternostomie palliative a été réalisée pour soulager l’hydrocéphalie (Fig. 2). Cette intervention a consisté à ouvrir le plancher du troisième ventricule par une technique endoscopique et à obtenir un passage libre du LCR vers les espaces sous-arachnoïdiens. Une récupération clinique rapide a été observée après l’opération, on a donc supposé que la symptomatologie préopératoire n’était pas uniquement due à la progression de la tumeur.
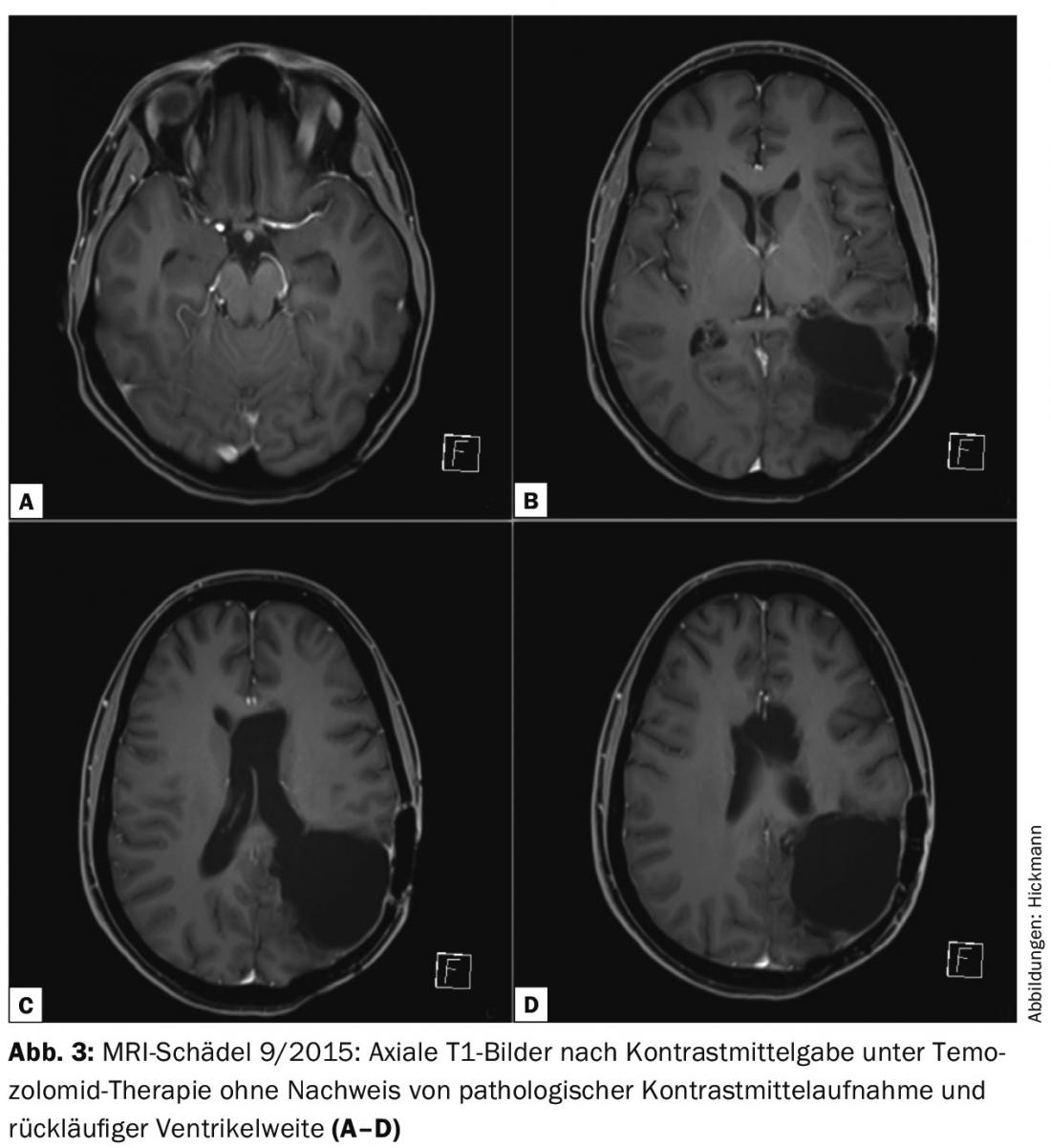
Malgré la situation globale inféconde, une chimiothérapie par Temozolomid (6 cycles, schéma 5/28) a donc été initiée. Sous traitement, l’état clinique de la patiente a continué à s’améliorer. En l’absence de nouveaux déficits neurologiques, le score de performance de Karnofsky est de 90%. Du point de vue de la morphologie de l’image, le dernier contrôle de l’évolution de septembre 2015, après quatre cycles de témozolomide, a montré une impressionnante régression de la tumeur sans mise en évidence de tissu tumoral prenant le contraste (fig. 3).
Discussion : L’évolution clinique et les résultats histologiques de 2014 sont ici en faveur de la présence d’un glioblastome WHO °IV secondairement malformé, qui était plutôt une tumeur de grade III en 2009. Globalement, la tumeur présente des marqueurs génétiques moléculaires favorables au pronostic et à la thérapie (IDH1 positif [sekundäre Malignisierung], MGMT méthylée) [2,3]. Des cas avec des résultats histologiques parfois difficiles à interpréter et des évolutions cliniques remarquables sont possibles en raison de la non-homogénéité des tumeurs.
Toutefois, la particularité de ce cas est son évolution depuis mai 2015. Une si bonne réponse à la chimiothérapie n’était pas attendue. Chez les patients présentant une progression tumorale intraventriculaire et une aggravation en termes d’hydrocéphalie aiguë (cornes temporales visibles, Fig. 1C) , le traitement de la congestion aiguë doit être envisagé. Cela permet d’évaluer dans quelle mesure les symptômes sont dus à une progression tumorale ou à l’accumulation, en particulier lorsque, comme dans ce cas, toutes les options de traitement adjuvant n’ont pas encore été épuisées et que la tumeur présente un profil génétique moléculaire prédictif favorable. La très bonne réponse de la tumeur récidivante à la chimiothérapie est probablement due, outre aux facteurs génétiques moléculaires (MGMT méthylée), à la naïveté du témozolomide [2]. En outre, la barrière hémato-encéphalique était largement perturbée, de sorte qu’il est possible qu’il y ait en outre une perméabilité particulièrement bonne du SNC au témozolomide. Même s’il s’agit d’un cas isolé impressionnant, cette évolution confirme notre idée selon laquelle des approches thérapeutiques plutôt controversées devraient être envisagées pour les patients atteints de tumeurs cérébrales malignes qui n’ont pas été traités.
Littérature :
- Stupp R, et al : Radiothérapie plus concomitant et adjuvant temozolomide pour le glioblastome. N Engl J Med 2005 ; 352(10) : 987-996.
- Stupp R, et al : Gliome de haut grade : Lignes directrices de pratique clinique de l’ESMO pour le diagnostic, le traitement et le suivi. Ann Oncol 2014 ; 25(Suppl 3) : iii93-101.
- Wen PY, Kesari S : Gliomes malins chez l’adulte. N Engl J Med 2008 ; 359(5) : 492-507.
InFo NEUROLOGIE & PSYCHIATRIE 2015 ; 13(6) : 34-35