En cas de symptômes typiques du syndrome du côlon irritable (SCI), le diagnostic initial complet avec recherche des signes d’alarme, éventuellement une coloscopie et surtout l’exclusion d’une sprue, revêt une importance décisive. Le traitement du SCI comprend une information détaillée du patient sur le type et la nature de la maladie, ainsi que des recommandations générales sur l’alimentation, le régime et le mode de vie. Le traitement médicamenteux dépend du sous-type et des symptômes, mais le gain thérapeutique par rapport au placebo n’est souvent que de 15-20%. Le linaclotide est un nouveau médicament prometteur mais coûteux pour les cas de SII-C jusqu’ici réfractaires, qui a également un effet modulateur de la douleur.
Le côlon irritable (en anglais IBS) est un trouble du transit intestinal. Syndrome de l’intestin irritable [IBS]) est la maladie gastro-intestinale chronique la plus fréquente. Environ 5 à 11% de la population générale est touchée, généralement entre la troisième et la cinquième décennie de la vie, les femmes étant environ deux fois plus nombreuses que les hommes. Bien que seuls 20 à 50% des patients concernés consultent un médecin, cette pathologie est à l’origine d’environ 40% des consultations chez les gastroentérologues et de 2% des visites chez les médecins généralistes. L’altération de la qualité de vie due à l’ensemble des symptômes peut être aussi évidente que dans le cas de maladies organiques graves.
Symptômes et physiopathologie
Le syndrome du côlon irritable se caractérise par des douleurs ou des troubles abdominaux chroniques récurrents, mais parfois intermittents, qui s’améliorent typiquement après la défécation et s’accompagnent d’une modification de la fréquence ou de la consistance des selles, sans que ces troubles puissent être expliqués par une maladie organique, infectieuse ou métabolique sous-jacente ou par un effet secondaire médicamenteux [1]. On distingue trois sous-types, selon que les symptômes consistent principalement en une constipation (SII-C, “constipation”), une diarrhée (SII-D) ou surtout en des douleurs ou une consistance variable des selles (SII-A, “alternance”, ou encore SII-M, “mixte”). Les troubles abdominaux fonctionnels sans douleur sont considérés comme des entités distinctes (diarrhée/constipation fonctionnelle), bien qu’il existe des recoupements significatifs [2].
La physiopathologie sous-jacente n’est pas encore totalement comprise. Bien que des modifications de la motilité gastro-intestinale aient été décrites chez les patients atteints du SII, aucun modèle de motilité spécifique n’a pu être identifié. Le facteur déterminant semble plutôt être une hypersensibilité viscérale, c’est-à-dire une perception accrue et douloureuse des stimuli physiologiques provenant du tractus gastro-intestinal. Les infections gastro-intestinales antérieures ou une modification du microbiote (moins de lactobacilles et de bifidobactéries) et du système immunitaire muqueux, ainsi que des facteurs psychosociaux, jouent également un rôle.
Diagnostic et diagnostics différentiels
Le diagnostic repose sur l’identification d’un ensemble de symptômes cliniques typiques en l’absence de signes d’alarme (tableau 1) et d’un examen physique normal, ainsi que sur l’exclusion individualisée de maladies organiques pertinentes dans le cadre du diagnostic différentiel. Il n’existe pas de tests spécifiques permettant de les distinguer clairement d’autres maladies. Le diagnostic doit être posé le plus tôt possible, avec le moins d’équipement et de frais possible [3,4].
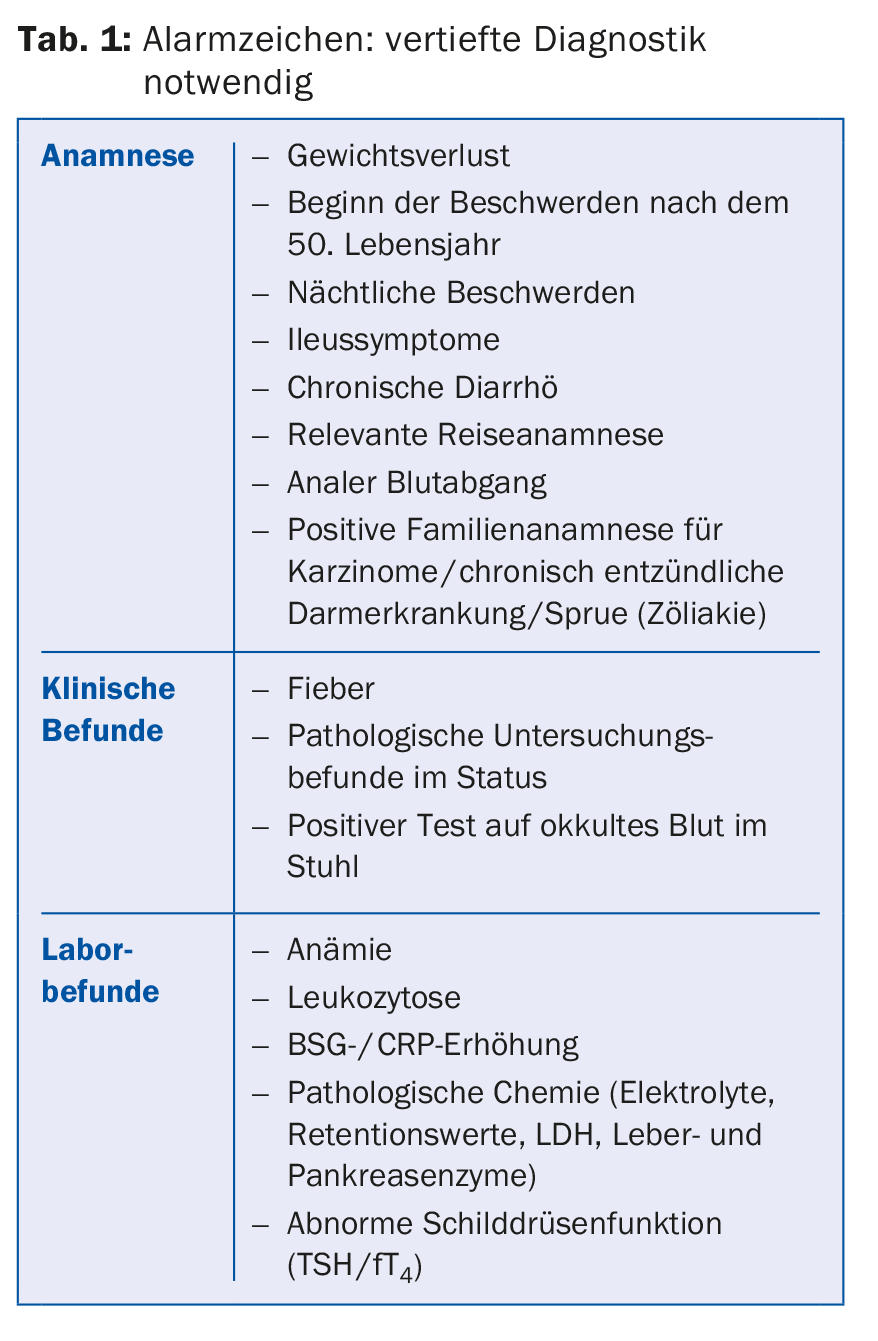
Le laboratoire de base typiquement normal (hémogramme avec BSG/CRP, chimie clinique, TSH) doit absolument être complété par la détermination de la sérologie de la sprue (anticorps antigliadine et anti-endomysium ainsi qu’anticorps contre la transglutaminsase tissulaire [IgG, IgA] et détermination des IgA totales), car la maladie cœliaque peut se manifester avec pratiquement la même symptomatologie qu’un SII [4]. Les patients atteints de SII ont une probabilité pré-test de diagnostic de sprue environ cinq fois plus élevée que la population normale [5]. Selon une méta-analyse récente, les patients Sprue ont un risque 5,6 fois plus élevé de présenter des symptômes de SCI et 38% d’entre eux présentent cliniquement le tableau complet du syndrome du côlon irritable [6]. C’est pourquoi un peu moins d’un tiers des patients Sprue (28%) sont d’abord traités à tort pour un syndrome du côlon irritable, dans un nombre non négligeable de cas pendant plusieurs années [7].
En particulier chez les patients ayant des antécédents de voyage positifs ou de diarrhée, il convient également de procéder à des analyses de selles pour détecter la présence de bactéries, de parasites (lamblias !) et de leucocytes, ainsi que de calprotectine (pour distinguer une maladie inflammatoire chronique de l’intestin) [8,9]. La calprotectine est une protéine qui se lie au calcium et qui n’est pas dégradable par les bactéries intestinales. Elle provient principalement des granulocytes neutrophiles lorsqu’ils sont libérés dans la lumière intestinale lors d’une inflammation intestinale. La calprotectine permet donc de distinguer les maladies inflammatoires des maladies fonctionnelles telles que le côlon irritable, mais ne permet pas de différencier les inflammations infectieuses et non infectieuses. Elle peut également être augmentée en cas d’hémorragie ou de tumeur gastro-intestinale, de diverticulite ou de cirrhose du foie.
En cas de signes cliniques d’intolérance au lactose, tels que des antécédents d’intolérance aux produits laitiers ou des ballonnements prononcés, il convient de rechercher cette intolérance au moyen d’un test respiratoire H2 ou d’un test génétique, ou de l’exclure au moyen d’un essai d’éviction de plusieurs semaines. Il est toutefois possible que les deux maladies coïncident.
Le plus souvent, une échographie abdominale est également réalisée initialement, mais elle ne révèle généralement pas de pathologie grave. Des calculs biliaires sont alors découverts chez environ 5% des patients, ce qui peut être à l’origine d’une indication chirurgicale inadéquate si la symptomatologie du SII est mal interprétée comme une cholécystolithiase symptomatique (tableau 2).

La décision de réaliser une iléocoloscopie doit être prise au cas par cas. Elle est indiquée chez tous les patients de plus de 50 ans, ne serait-ce que pour le dépistage des polypes ou du cancer, et devrait toujours être effectuée chez les patients présentant des signes d’alarme (tableau 1). L’iléocoloscopie est nécessaire pour confirmer le diagnostic dans la mesure où elle a une grande valeur pour la détection ou l’exclusion de diagnostics différentiels pertinents (maladie inflammatoire chronique de l’intestin, diverticulite, colite infectieuse ou microscopique), mais elle ne doit pas nécessairement être réalisée si le diagnostic de base est normal et si les patients sont jeunes et ne présentent pas de signes d’alarme. L’examen peut néanmoins être nécessaire pour ce groupe dans le cadre de la “réassurance” thérapeutique, afin de pouvoir convaincre les patients du caractère bénin des troubles.
“Réassurance” et style de vie
Pour traiter le SCI, il convient d’épuiser les mesures générales avant de recourir à un traitement médicamenteux. La “réassurance”, c’est-à-dire la réassurance et l’information du patient sur le caractère bénin des troubles et le bon pronostic avec une espérance de vie normale, revêt une très grande importance. Une étude a ainsi montré que le diagnostic du syndrome du côlon irritable n’avait pas besoin d’être révisé, même sur une période de suivi de 30 ans, c’est-à-dire qu’aucun carcinome ou autre maladie chronique ou inflammatoire grave n’a été négligé. Il convient donc d’éviter autant que possible les diagnostics répétés et superflus. L’attention personnelle dans le cadre de l’interaction médecin-patient, mais aussi la fréquentation de groupes d’entraide, l’évolution naturelle de la maladie et l’effet placebo peuvent contribuer à soulager les symptômes et à réduire les consultations médicales.
Il n’existe pas de recommandations générales concernant le mode de vie ou l’alimentation. Cependant, les facteurs déclencheurs individuels qui peuvent aggraver les symptômes (stress, manque de sommeil, consommation de nicotine/d’alcool, certains aliments, manque d’exercice, etc.) doivent être identifiés et évités.
Nutrition et probiotiques
Chez les patients souffrant de constipation (SII-C), une alimentation riche en fibres est recommandée, éventuellement avec l’aide d’agents gonflants. Il convient toutefois d’éviter les aliments qui provoquent des flatulences importantes (choux, haricots, oignons, etc.) et en particulier les fibres contenant du son, car elles aggravent souvent les symptômes de la douleur abdominale [4,8,10].
Le régime dit FODMAP vise également à éviter les composants alimentaires qui provoquent des flatulences. FODMAP signifie “glucides fermentescibles à chaîne courte”. Oligo-, di- et monosaccharides et polyols (“fermentable oligo-, di- and monosaccharides and polyols”). Les FODMAP comprennent notamment le fructose, le lactose et les alcools de sucre comme le sorbitol et le xylitol. Ces substances osmotiquement très actives sont mal absorbées dans la lumière intestinale, mais fermentées par les bactéries avec formation de gaz (hydrogène, méthane), ce qui provoque des ballonnements et une distension intestinale, et donc des douleurs. Plusieurs études ont montré une amélioration significative des symptômes du SCI sous un régime pauvre en FODMAP. Toutefois, un tel changement alimentaire ne doit être effectué qu’avec l’aide d’un nutritionniste qualifié, afin d’éviter une restriction trop importante, voire un régime malnutritif.
L’administration de probiotiques (Aktifit®, Actimel®, LC1®, Activia®, Perenterol®, VSL#3®) peut tenter d’influencer le microbiote, souvent altéré en cas de SCI, dans le sens d’un bénéfice pour la santé. Des préparations de souches individuelles ou de mélanges de lactobacilles, de bifidobactéries ou de saccharomyces sont utilisées, généralement dans du lait fermenté ou des yaourts (cave FODMAP !). L’effet est spécifique à la préparation et dépend de la dose. Il n’est pas encore clair quelles préparations doivent être utilisées chez quels patients et pour quel sous-type de SCI. En l’absence de réponse, il convient de changer de préparation [11]. La thérapie est conçue comme un traitement continu et a peu d’effets secondaires.
Traitement médicamenteux : aspects généraux
Le type de traitement médicamenteux dépend du sous-type de SCI prédominant et a principalement un caractère probatoire. En cas de réponse insuffisante, la médication doit être arrêtée au plus tard après trois mois ou complétée par des alternatives thérapeutiques. De manière générale, il faut savoir que les preuves de l’efficacité des médicaments dans le SCI sont globalement faibles ; le taux de réponse au placebo dans les études en double aveugle est d’environ 50% et le gain thérapeutique du verum n’est que de l’ordre de 15-20%.
Régulateurs de selles
Les régulateurs de selles, tels que les enveloppes de psyllium (Metamucil®) ou la gomme de sterculiae (Normacol®, Colosan mite®), sont des médicaments de premier choix, notamment dans le traitement du SII-C. Ils peuvent être administrés par voie orale ou par voie intraveineuse. Il s’avère que les préparations contenant des enveloppes de psyllium sont particulièrement utiles en cas de constipation et de douleurs [10]. De plus, il existe des preuves qu’ils ont également un effet positif sur le sous-type de diarrhée en augmentant la consistance des selles. Les patients doivent toutefois être informés que les médicaments mentionnés peuvent également entraîner l’apparition ou l’aggravation de ballonnements. Les laxatifs osmotiques de type macrogol (Transipeg forte®, Movicol® Sachets) sont utilisés lorsque les substances régulatrices des selles ne permettent pas d’obtenir une amélioration satisfaisante de la constipation.
L’effet positif du lopéramide (Imodium®) dans le SCI de sous-type diarrhéique a été démontré dans plusieurs études prospectives randomisées, avec une amélioration de la consistance des selles et du besoin impérieux d’aller à la selle. Cependant, certains patients ont présenté une augmentation des douleurs abdominales nocturnes, peut-être dans le cadre d’une constipation d’origine médicamenteuse. Il est particulièrement recommandé d’appliquer du sirop de lopéramide, qui peut être dosé et titré plus précisément jusqu’à ce que l’effet souhaité soit atteint.
Traitement de la douleur
Les analgésiques tels que les anti-inflammatoires non stéroïdiens (AINS), le métamizole ou le paracétamol n’ont pas leur place dans le traitement du SCI en raison de leur manque d’efficacité. Les opiacés ne sont pas non plus recommandés en raison du manque de données et sont en outre connus pour avoir un effet obstructif.
La mébévérine (Duspatalin® retard), un antispasmodique, a montré un gain thérapeutique de 22 points de pourcentage sur la douleur par rapport au placebo [10]. Cela correspond à un NNT (“number needed to treat”) de 5, de sorte que cette préparation peut être utilisée principalement pour le traitement de la douleur (IBS-A/IBS-M).
Produits phytothérapeutiques
Iberogast®, un mélange de neuf extraits de plantes différentes (menthe poivrée, camomille, mélisse, cumin, chélidoine, chardon-Marie, racine de réglisse, angélique et moutarde paysanne), est également un médicament phytothérapeutique scientifiquement bien étudié pour le traitement des troubles gastro-intestinaux fonctionnels (dyspepsie fonctionnelle et SCI). Dans une méta-analyse de quatre études, une réduction de 19% des symptômes graves et très graves du SCI a été obtenue par rapport au placebo, ce qui correspond à un NNT de 5, quel que soit le sous-type de SCI [12].
L’huile de menthe poivrée seule est disponible sous forme de capsules (Colpermin®) et, selon une méta-analyse de quatre études, elle entraîne une réduction des troubles persistants de 65 à 26%, ce qui correspond à un risque relatif de 0,43 [10].
Antidépresseurs
Les antidépresseurs tricycliques (par exemple, amitriptyline 10 mg, Tryptizol®) et les inhibiteurs de la recapture de la sérotonine (IRS) ont un effet positif sur les symptômes du SCI, quel que soit le sous-type. Dans les méta-analyses, le risque relatif de persistance de la douleur était de 0,68 et 0,62, respectivement, ce qui correspond à un gain thérapeutique par rapport au placebo d’environ 33% et à un NNT de 3-4, bien que très peu d’études aient évalué séparément la composante douleur [13]. Les effets secondaires de l’amitriptyline incluent la rétention urinaire et la constipation, ce qui peut être problématique dans le cas du SII-C. L’amitriptyline est également utilisée dans le traitement de l’hypertension artérielle. En outre, l’amitriptyline non retardée 10 mg (tryptizol) n’est disponible en Suisse que via l’importation de l’UE.
Linaclotide (Constella®)
Un médicament de nouvelle génération pour le traitement du SII-C modéré à sévère chez l’adulte est le linaclotide (Constella®).). Il augmente la concentration locale de GMPc dans la muqueuse intestinale en activant directement la guanylate cyclase C luminale (GC-C), ce qui entraîne l’activation d’un canal d’ions chlorure et donc la sécrétion de chlorure, de bicarbonate et d’eau dans la lumière intestinale. Ce mécanisme d’action correspond au mécanisme pathologique de la diarrhée sécrétoire provoquée par des toxines bactériennes (“diarrhée du voyageur”), dans laquelle l’entérotoxine thermostable d’E. coli. provoque également une activation de la GC-C. En outre, le médicament a également un effet analgésique direct en inhibant les fibres nerveuses viscérales afférentes. Le dosage pour le SII-C est de 290 μg/d, à prendre 30 minutes avant le premier repas principal.
Dans l’étude pivot portant sur 800 patients, il y a eu une amélioration à la fois des douleurs abdominales (55 vs 42%) et des symptômes du SCI (37 vs 19%), ce qui correspond à un NNT de 8 [14]. Les premières améliorations apparaissent dès la première semaine de traitement et se poursuivent pendant toute la période de traitement. Il a été démontré que le linaclotide ne provoque pas d’effet de rebond lorsque le traitement est arrêté après trois mois de traitement continu. Un effet secondaire très fréquent est une diarrhée aqueuse sécrétoire prononcée chez environ 16% des patients, qui entraîne l’arrêt du traitement chez environ 4% des patients. De plus, il n’existe pas encore de données sur les effets secondaires à long terme. Le linaclotide est donc considéré comme un médicament de réserve pour les cas réfractaires ; son prix, 94 francs pour quatre semaines, est nettement supérieur à celui des autres médicaments.
Rifaximine (Xifaxan®)
Avec l’autorisation attendue de la rifaximine (Xifaxan®) pour le traitement de l’encéphalopathie hépatique, on disposera probablement bientôt en Suisse d’un antibiotique synthétique à large spectre, oral et non résorbable, destiné à influencer le microbiote et pouvant être utilisé hors étiquette pour le SII (non SII-C). Il a déjà été approuvé dans l’UE pour le traitement des infections entérales et de la diarrhée du voyageur et aux États-Unis pour la décontamination intestinale en cas d’encéphalopathie hépatique, et a également été utilisé dans des études pour modifier le microbiome dans le syndrome du côlon irritable. Probablement en raison d’une réduction de la fermentation bactérienne et des métabolites bactériens nocifs ou d’une modification de la réponse immunitaire au microbiome intestinal, une amélioration des symptômes du SCI et plus particulièrement des ballonnements a été décrite chez environ 42% des patients (contre 32% sous placebo) [15]. Le gain thérapeutique par rapport au placebo n’est toutefois que de 10%, ce qui est à la limite de la pertinence clinique, et ce pour un coût thérapeutique attendu de 450 euros pour un traitement de 14 jours.
Le risque de développement d’une résistance est considéré comme faible sur la base des données disponibles à ce jour, qui ne portent que sur des périodes d’observation relativement courtes. Bien que certains patients autrement difficiles à traiter ou considérés comme réfractaires en bénéficient certainement, le traitement antibiotique large et non sélectif d’une maladie chronique non fatale à forte prévalence reste néanmoins discutable en raison du développement potentiel de résistances et d’effets à long terme incertains. Surtout qu’il existe d’autres moyens d’influencer le microbiome, par exemple par des mesures diététiques comme la réduction des FODMAP, l’administration de probiotiques ou même un transfert de microbiome (“transplantation fécale”). En outre, des effets indésirables gastro-intestinaux peuvent également survenir sous rifaximine.
Littérature :
- Longstreth GF, et al : Gastroenterology 2006 ; 130(5) : 1480-1491.
- Wong RK, et al : Am J Gastroenterol 2010 ; 105(10) : 2228-2234.
- Chang L, et al : Gastroenterology 2014 ; 147(5) : 1149-1472 e2.
- Layer P, et al : S3-Leitlinie Reizdarmsyndrom. Z Gastroenterol 2011 ; 49(2) : 237-293.
- Cash BD, et al : Am J Gastroenterol 2002 ; 97(11) : 2812-2819.
- Sainsbury A, et al : Clin Gastroenterol Hepatol 2013 ; 11(4) : 359-365 e1.
- Card TR, et al : Scand J Gastroenterol 2013 ; 48(7) : 801-807.
- Spiller R, et al : Gut 2007 ; 56(12) : 1770-1798.
- Tibble J, et al : Gut 2000 ; 47(4) : 506-513.
- Ford AC, et al. : BMJ 2008 ; 337 : a2313.
- McKenzie YA, et al : J Hum Nutr Diet 2012 ; 25(3) : 260-274.
- Madisch A, et al : Z Gastroenterol 2001 ; 39(7) : 511-517.
- Ford AC, et al : Gut 2009 ; 58(3) : 367-378.
- Rao S, et al. : Am J Gastroenterol 2012 ; 107(11) : 1714-1724 ; quiz p. 25.
- Menees SB, et al : Am J Gastroenterol 2012 ; 107(1) : 28-35 ; quiz p. 6.
PRATIQUE DU MÉDECIN DE FAMILLE 2015 ; 10(4) : 10-15