La pédiculose pubienne se transmet principalement lors des rapports sexuels. Dans le cas de la scabiose, le lien de causalité n’est souvent pas établi. Néanmoins, ces deux parasitoses sont considérées comme de possibles “infections sexuellement transmissibles” (IST). Les partenaires sexuels doivent donc être traités en même temps.
La scabiose est une maladie infectieuse transmise par Sarcoptes scabiei var. hominis. La transmission se fait par contact direct de peau à peau, entre autres pendant les rapports sexuels, plus rarement par l’intermédiaire d’objets contaminés comme les draps, les vêtements ou les serviettes. Les facteurs de risque de transmission sont les mauvaises conditions d’hygiène et la présence de nombreuses personnes dans un espace restreint, comme c’est généralement le cas dans les camps de réfugiés. Une épidémie de scabies peut également se propager rapidement dans les foyers et les hôpitaux, en particulier si le patient index présente une scabiose croûteuse non diagnostiquée.
La femelle de la scabieuse s’enfonce dans l’épiderme, dont elle se nourrit. Dans les tunnels, elle pond des œufs qui, en l’espace de deux semaines, donnent d’abord naissance à des nymphes, puis à des adultes. Sans son hôte, l’acarien scabieux meurt dans les 24 à 36 heures, en fonction notamment de la température et de l’humidité ambiantes.
Un à cinq acariens suffisent à provoquer les symptômes typiques de la scabiose. La réaction eczémateuse, qui se traduit par des démangeaisons prononcées, surtout nocturnes, et des papules, est due à une réaction de type IV à médiation cellulaire aux acariens, aux œufs ou aux pelotes de réjection. C’est pourquoi, en cas de primo-infection, les symptômes ne commencent qu’au bout de trois à six semaines, alors qu’en cas de réinfection, les démangeaisons apparaissent au bout d’un à trois jours.
Clinique
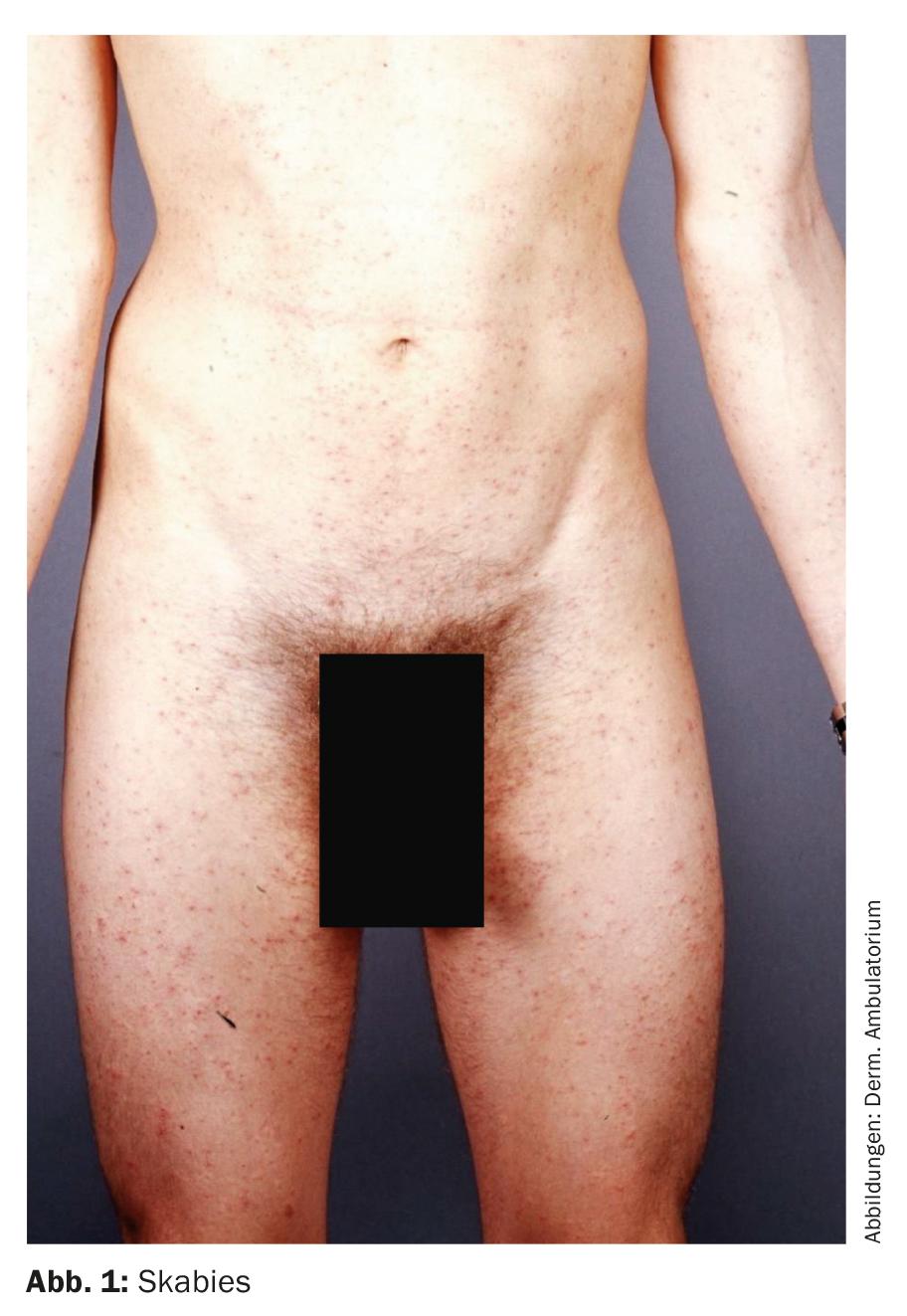
La scabiose se manifeste typiquement par des démangeaisons intenses et des petites papules disséminées (Fig. 1). Des vésicules, une eczématisation secondaire et une impétiginisation sont également possibles. Chez les réfugiés, une surinfection par des streptocoques β-hémolytiques du groupe A a souvent pu être trouvée.
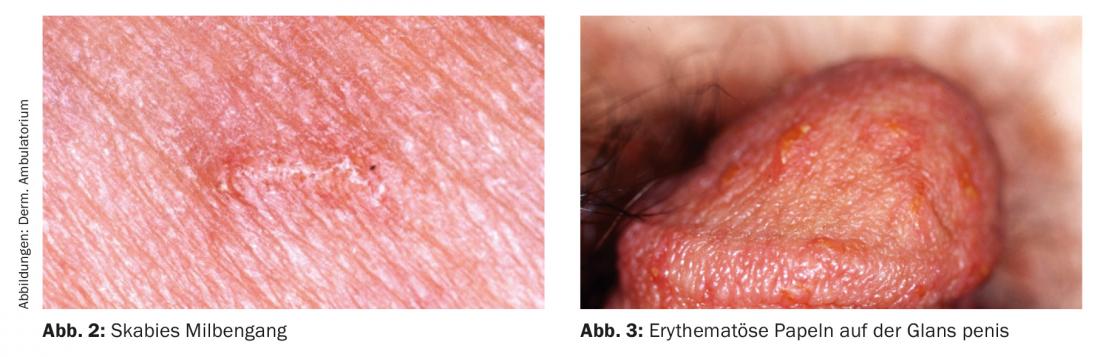
La scabiose classique survient chez les patients immunocompétents. Un prurit intense avec aggravation la nuit est typique. Les sites de prédilection des papules sont la région périombilicale, les hanches, les organes génitaux, les seins, les fesses, les plis axillaires, les doigts et les espaces interdigitaux ainsi que les poignets. Chez les adultes, les palmiers, les plantes et le visage sont exclus. La florescence primaire, une fine ligne gris-brun de 5 à 10 mm de long qui représente le conduit de l’acarien (avec le tumulus d’acariens à son extrémité), est rarement observée, car elle est généralement déjà grattée (Fig. 2).
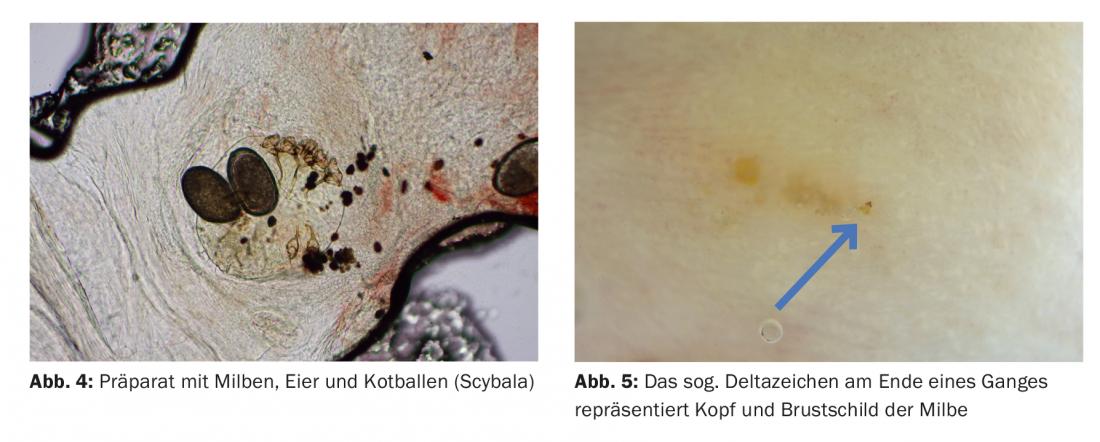
Des papules érythémateuses typiques sur le gland du pénis sont presque pathognomoniques d’une scabiose (Fig. 3).
La scabiose croûteuse (anciennement appelée scabiose norvegica) est visible chez les patients immunodéprimés. Les plaques squameuses généralisées, psoriasiformes et croûteuses s’accompagnent de relativement peu de démangeaisons. Une surinfection bactérienne est fréquente. La scabiose croûteuse est très contagieuse.
Diagnostic
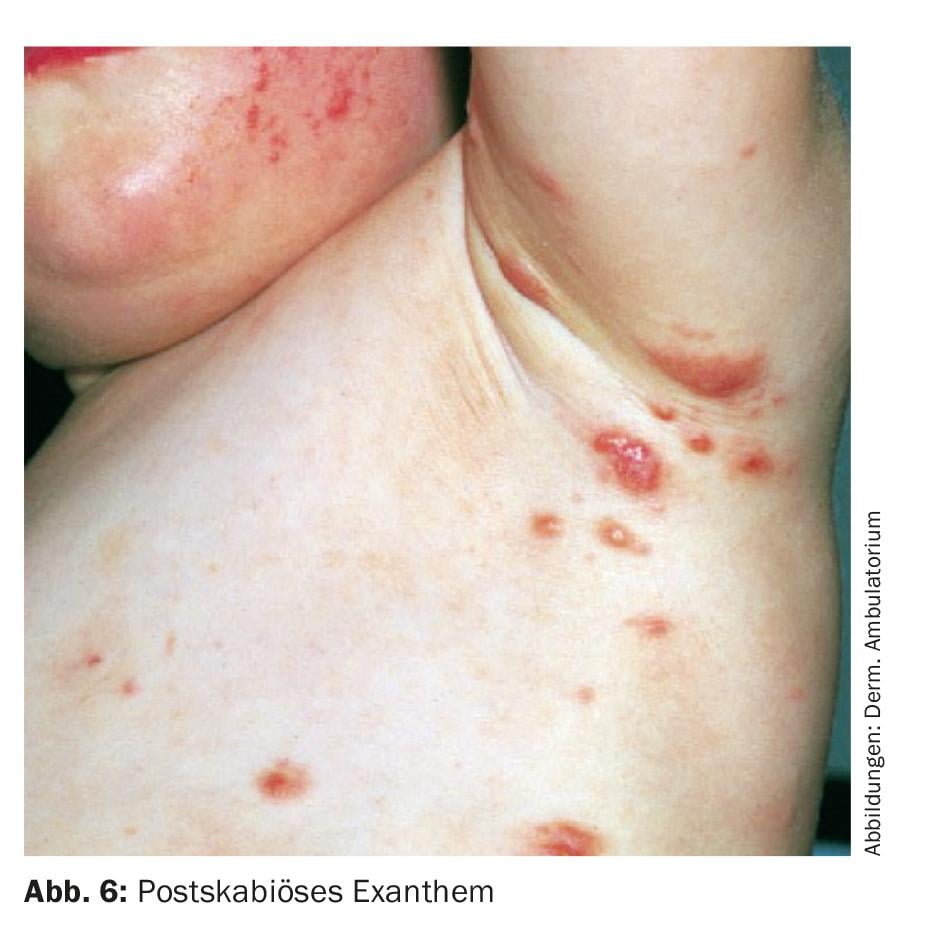
L’anamnèse et la clinique typiques permettent généralement d’orienter le diagnostic. Le diagnostic est établi par l’examen au microscope de la peau grattée dans la zone du monticule d’acariens. Dans la préparation, il est possible, avec un peu de chance, de trouver des acariens, plus souvent des œufs ou des pelotes de réjection (scybala) (fig. 4). Une méthode alternative pour obtenir du matériel pour la microscopie est la méthode de la “colle instantanée” : une petite goutte de cyanoacrylate est déposée sur une lame de microscope. La lame est ensuite pressée sur le monticule d’acariens et retirée par à-coups au bout de 30 secondes. On peut ensuite procéder à l’examen microscopique.
Le dermatoscope permet également de détecter les galeries d’acariens, les œufs et les acariens scabieux. Le signe appelé delta à l’extrémité d’une galerie représente la tête et le plastron de l’acarien (Fig. 5).
Clarifications
En cas d’antécédents de comportements sexuels à risque, un dépistage des IST est indiqué.
Thérapie
La scabiose peut être traitée par voie topique ou systémique. Pour le traitement topique, la perméthrine 5% en crème est recommandée avec le plus d’évidence. La perméthrine a l’avantage de pouvoir être utilisée en toute sécurité chez les nourrissons à partir de deux mois, les femmes enceintes et pendant l’allaitement. La préparation à 5 % n’était pas disponible en Suisse jusqu’à récemment, de sorte qu’il fallait la prescrire par voie magistrale ou commander une préparation équivalente à l’étranger. Cette anomalie est heureusement corrigée depuis juillet 2018 avec la mise sur le marché de la crème Scabi-med®.
La crème doit être appliquée sur une peau sèche et fraîche de la tête aux pieds, en particulier sur les zones telles que les plis du corps, les organes génitaux externes et les espaces entre les orteils et les doigts. Après huit à douze heures, il est possible de prendre une douche. Il est désormais recommandé, tant pour les enfants de moins de trois ans que pour les personnes âgées de plus de 60 ans, de traiter également la tête en évitant la région des yeux et de la bouche. En raison du faible effet ovicide de la perméthrine, les directives européennes actuelles recommandent en outre de répéter le traitement après sept jours.
Pour le traitement systémique, on utilise l’ivermectine orale 200 µg/kg, en deux doses à une semaine d’intervalle, qui doivent être prises deux heures avant ou deux heures après le repas. Le produit n’est pas disponible en Suisse et doit être commandé en Allemagne ou en France. Le traitement systémique n’est préférable au traitement topique que dans certaines situations : en cas d’échec du traitement préalable à la perméthrine, chez les patients immunodéprimés et lorsque l’observance n’est pas garantie pour diverses raisons.
Le traitement de la scabiose croûteuse doit être combiné et prolongé (tab. 1).

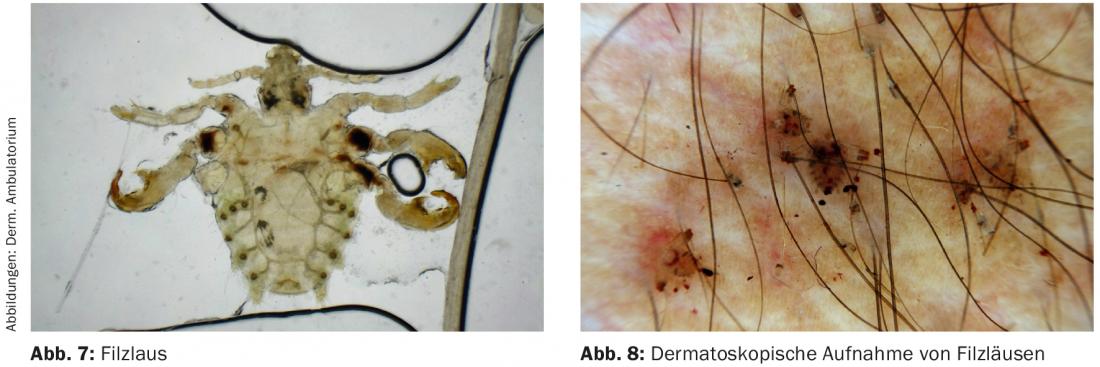
L’exanthème post-scabieux est peu documenté dans la littérature ; il peut survenir principalement chez les jeunes enfants après une scabiose correctement traitée, sous la forme de papules et de nodules enflammés persistant pendant plusieurs semaines. (ill.6). Dans cette situation, il s’agit de rassurer les parents sur le fait qu’il n’y a plus de scabies actives et de mettre en place un traitement symptomatique et anti-inflammatoire.
Défis à relever
Dans le cadre du mouvement des réfugiés de ces dernières années, la scabiose a pris de l’ampleur en Europe. Dans les pays d’origine des réfugiés, la prévalence de la scabiose est nettement plus élevée qu’en Europe et les conditions pendant la fuite favorisent la transmission. Si une scabiose classique est diagnostiquée chez un réfugié, il n’est pas nécessaire d’isoler le patient. Il est bien plus important de commencer immédiatement le traitement avec de la perméthrine, car grâce à son effet neurotoxique sur l’acarien de la scabiose, il n’y a plus de risque de contagion après l’application de perméthrine.
Dans ce contexte, des rapports de cas australiens faisant état d’une résistance documentée à la perméthrine sont inquiétants, bien qu’aucun rapport de résistance n’ait été publié à ce jour en dehors de l’Australie.
Pédiculose pubienne
La pédiculose pubis est, avec la pédiculose capitis et la pédiculose corporis, une infection parasitaire causée par l’une des trois variantes de poux, qui sont obligatoirement pathogènes pour l’homme. Elles ont toutes en commun le fait qu’elles peuvent se propager lorsque les logements sont exigus et que les conditions d’hygiène sont mauvaises, comme c’est le cas dans les zones de guerre ou dans les foyers de réfugiés.
Le principal mécanisme de transmission de la pédiculose pubienne – contrairement aux deux autres maladies des poux – est le contact sexuel, raison pour laquelle cette parasitose est considérée, jusqu’à preuve du contraire, comme une “infection sexuellement transmissible”, ce qui a une influence sur les investigations et le co-traitement des partenaires sexuels.
Épidémiologie
Il y a quelques décennies encore, les morpions étaient une maladie courante. Ils sont présents dans le monde entier, mais leur incidence a considérablement diminué dans le monde occidental et les infections par les morpions ne sont plus observées que de manière très sporadique. Le service ambulatoire de dermatologie de l’hôpital municipal Triemli traite encore environ un à trois patients par an contre les morpions. Souvent, ces patients ont été infectés à l’étranger.
Les raisons du recul de cette parasitose sont d’une part l’amélioration des conditions d’hygiène, mais surtout le fait qu’un changement de conscience de la mode a conduit de plus en plus de personnes à s’épiler les aisselles, les jambes et le pubis dans les pays industrialisés occidentaux. Cela entraîne une disparition progressive de l’habitat du morpion. Une étude britannique a montré que la prévalence de Phthirus pubis a diminué de manière significative entre 1997 et 2003, alors que dans le même temps, la prévalence des infections à chlamydia et à gonocoque a augmenté. Comme ces données ne permettent pas d’attribuer la diminution à un changement de comportement sexuel, les auteurs supposent que l’apparition des techniques de “waxing” pour l’épilation des parties génitales est responsable de la diminution des morpions.
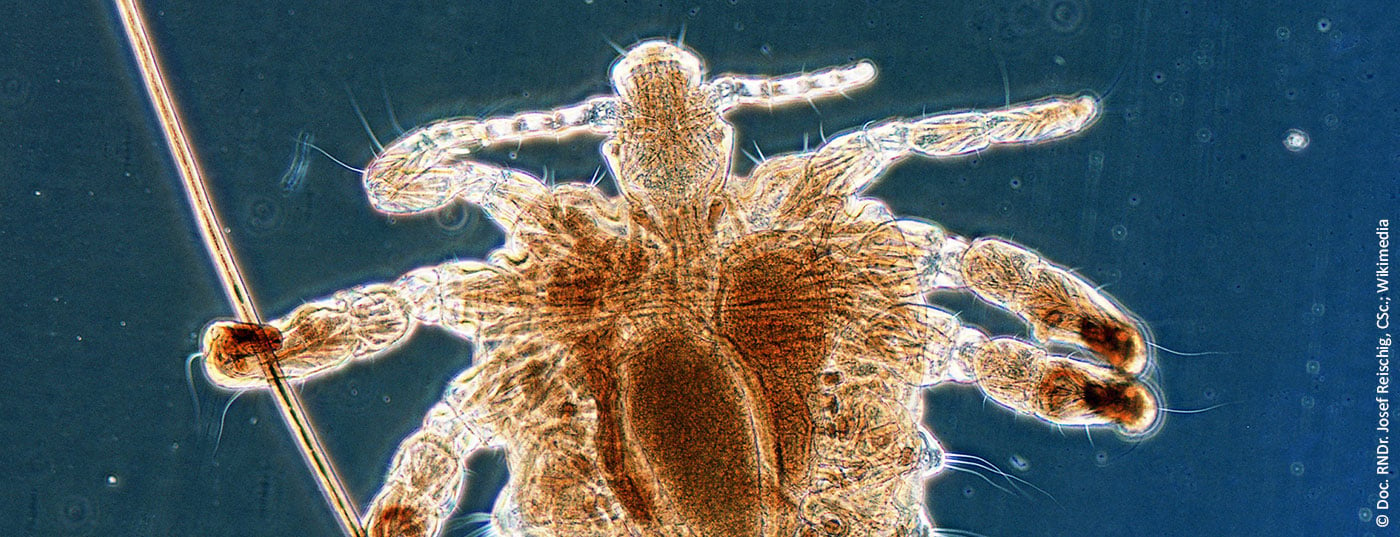
La transmission du morpion se fait principalement par contact physique étroit, typiquement lors de rapports sexuels. Une contamination par le contenu d’un lit, des vêtements ou des serviettes de bain souillés est possible, mais plutôt exceptionnelle, car le pou ne peut survivre qu’environ 24 à 48 heures en dehors du corps humain sans repas sanguin. Le contact sexuel est à l’origine de la transmission des parasites, qui se propagent dans les poils terminaux de la région pubescente et périanale. Le corps large du morpion, avec ses trois paires de pattes, est parfaitement conçu pour s’agripper aux poils pubiens puissants et espacés (fig. 7). En revanche, il ne peut guère ramper, mais il peut néanmoins s’étendre sur les poils du corps.
La période d’incubation est généralement inférieure à une semaine. De même, il faut une semaine pour que les nymphes éclosent à partir des œufs pondus par les adultes. Avec une taille de 1,5 à 2 mm, les poux sont tout juste visibles à l’œil nu (Fig. 8).
Clinique
Dans la majorité des cas, la contamination initiale passe inaperçue. Ce n’est qu’après les repas de sang des poux qu’apparaît le prurit, qui est le symptôme principal. On trouve des macules/papules érythémateuses aux endroits des piqûres, mais les taches bleutées (macules coeruleae) ne sont que rarement présentes. De temps en temps, on trouve aussi de petites traces de sang sur les sous-vêtements.
Outre la région génitale et périanale, les poux peuvent également être trouvés sur d’autres parties poilues du corps, rarement sur les cils et les sourcils.
Diagnostic
Le diagnostic est établi sur la base d’une clinique typique avec des morpions ou des lentes identifiés à l’œil nu ou au dermatoscope.
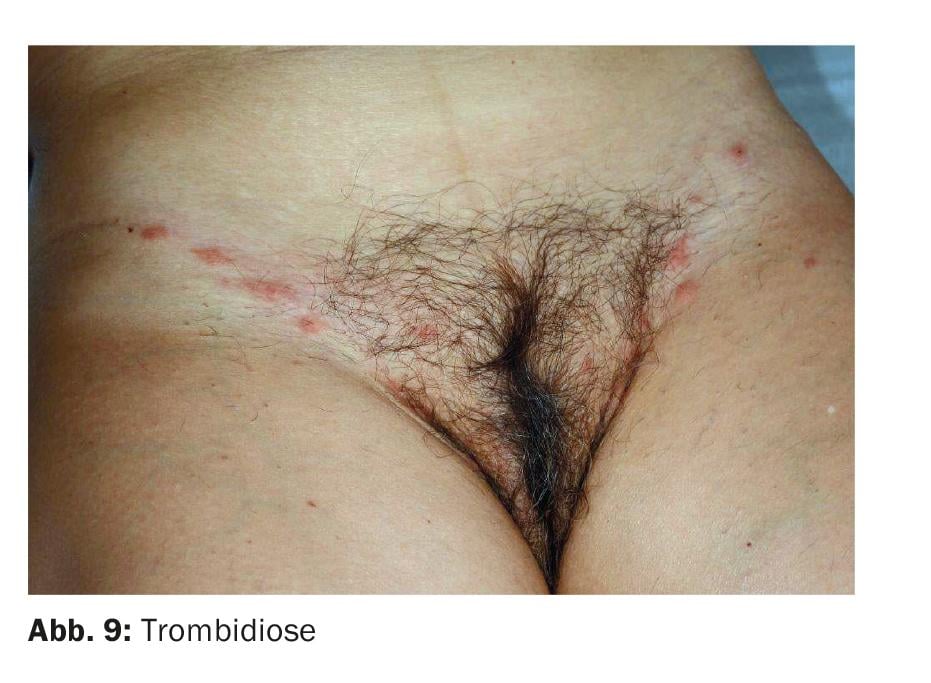
Le diagnostic différentiel peut inclure une trombidiose, car les réactions aux piqûres de ces acariens se produisent de préférence dans la région génitale chaude et humide (Fig. 9).
Clarifications
Les lignes directrices recommandent clairement d’exclure les IST concomitantes, qui peuvent être trouvées dans jusqu’à 30% des cas. Au moins un test de dépistage du VIH et de la syphilis doit être effectué, ainsi qu’un test PCR pour les chlamydiae et les gonocoques.
Thérapie
Comme pour la scabiose, le traitement de première ligne de la pédiculose pubienne est la perméthrine, conformément aux directives européennes, la formulation à 1 % étant suffisante pour les morpions. En Suisse, le Loxazol® est disponible sous forme de produit confectionné. La lotion de rinçage doit être appliquée pendant plus de dix minutes, après quoi elle peut être rincée. Le traitement doit être répété après sept à dix jours. La perméthrine peut également être utilisée pendant la grossesse. Il est également possible d’utiliser le malathion (Prioderm®) comme traitement local à la place de la perméthrine.
En cas d’infestation massive et étendue de morpions ou d’échec du traitement local, l’ivermectine (Stromectol®) est disponible comme traitement “off-label”. Il doit être acheté à l’étranger, raison pour laquelle il convient d’obtenir au préalable une garantie de prise en charge auprès de la caisse d’assurance maladie. La dose habituelle est de 200 µg/kg de poids corporel en une seule prise. Il est également recommandé de renouveler le traitement avec ce médicament après sept jours.
Si les cils sont atteints, il convient d’appliquer de la vaseline 2×/jour. Les poux sont ainsi étouffés et peuvent être retirés des cils avec les lentes à l’aide d’une pince à épiler.
Il est important de traiter tous les partenaires sexuels en même temps. Toutes les personnes concernées doivent s’abstenir d’avoir des relations sexuelles jusqu’à ce que le succès du traitement soit prouvé, une semaine après le dernier traitement.
Il n’est pas nécessaire de raser les poils génitaux pour que le traitement soit efficace. Après la thérapie, les vêtements portés, les draps, les serviettes éponges, etc. doivent être lavés à au moins 60 degrés ou séchés dans un sèche-linge. Alternativement, les vêtements peuvent être stockés dans un sac plastique fermé pendant trois jours.
Littérature :
- Salavastru CM, et al : European guideline of the management of scabies. J Eur Acad Dermatol Venereol 2017 ; 31 : 1248-1253.
Littérature complémentaire :
- Neynaber S, et al. : Use of superficial cyanoacylate biopsy (SCAB) as an alternative for mite identification in scabies. Arch Dermatol 2008 ; 144 ; 114-115.
- Di Meco E, et al. : Infectious and dermatological diseases among arriving migrants on the Italian coasts. Eur J Public Health 2018 Oct 1 ; 28 : 910-916.
- Salavastru CM et al : European guideline of the management of pediculosis pubis. J Eur Acad Dermatol Venereol 2017 ; 31 : 1425-1428.
- Armstrong NR, et al : Le “Brazilian” a-t-il tué le pou pubien ? Sex Transm Infect 2006 ; 82 : 265-266.
DERMATOLOGIE PRATIQUE 2018 ; 28(6) : 16-21