Le traitement de la polyarthrite rhumatoïde (PR) a fait de grands progrès au cours des 20 dernières années. Cela concerne à la fois l’éventail des médicaments disponibles et les évolutions en termes de rapidité d’action et de taux de réponse. Les inhibiteurs JAK se sont avérés être une alternative aux médicaments biologiques, avec certains avantages.
Le traitement de la polyarthrite rhumatoïde (PR) a fait de grands progrès au cours des 20 dernières années. Cela concerne à la fois l’éventail des médicaments disponibles et les évolutions en termes de rapidité d’action et de taux de réponse. Les inhibiteurs JAK se sont avérés être une alternative aux médicaments biologiques, avec certains avantages.
Compte tenu de leur maniement difficile (nécessité de réfrigération, administration parentérale), les médicaments biologiques ne représentent pas la forme de traitement optimale pour tous les patients, d’autant plus que seule une minorité d’entre eux obtient une rémission clinique continue. En revanche, la douleur, les limitations fonctionnelles, la fatigue et la dépressivité représentent une charge de morbidité importante pour les personnes concernées. Les inhibiteurs de JAK sont positionnés dans le traitement de la polyarthrite rhumatoïde après l’échec du traitement par les csDMARD ou les produits biologiques.
La European League Against Rheumatism (EULAR) a recommandé de traiter les patients ayant une mauvaise réponse aux csDMARD (par ex. méthotrexate, MTX) et un pronostic défavorable soit par un bDMARD soit par un inhibiteur de JAK [1]. Si cela n’entraîne pas de réponse thérapeutique, il convient d’essayer de changer de substance ou de classe (de bDMARD à JAKi ou inversement). Pour les DMARD biologiques et synthétiques ciblés (b/tsDMARD), un traitement combiné avec un csDMARD est recommandé. Si cela est exclu (par exemple en raison de contre-indications), l’EULAR conseille de privilégier les inhibiteurs de l’IL-6 et des JAK par rapport aux autres bDMARD.
Trois inhibiteurs JAK sont actuellement disponibles en Suisse pour le traitement de la PR : Tofacitinib, Baricitinib et Upadacitinib. En outre, le filgotinib est autorisé en Allemagne depuis 2020 et le peficitinib est disponible sur le marché japonais depuis 2019, mais n’est pas encore autorisé aux États-Unis ou en Europe. Lors du choix d’un inhibiteur JAK, les différences d’efficacité et de sécurité entre les substances sont souvent d’un grand intérêt pour les praticiens.
Tofacitinib
Les études se concentrent sur la sélectivité des inhibiteurs de JAK, c’est-à-dire sur l’inhibition des différentes isoformes à une concentration intracellulaire donnée. On recherche ainsi le meilleur rapport efficacité/effets secondaires, comme dans le cas d’une anémie par exemple. Pour le tofacitinib, déjà autorisé en Suisse depuis 2013, une analyse post-hoc concernant les patients séropositifs et séronégatifs a montré une réponse comparable dans les deux groupes [2]. Les taux de rémission de DAS28 étaient légèrement inférieurs à ceux des patients atteints de CCP. Dans l’analyse, les données de cinq études de phase III ont été regroupées et des sous-groupes ont été définis sur la base de la sérologie : RF+CCP+, RF+CCP-, RF-CCP+ et RF-CCP-. Au final, les patients atteints de RF+CCP+ étaient plus susceptibles d’obtenir une réponse ACR-20, -50 ou -70 que les patients atteints de RF-CCP. Ce résultat a été démontré pour les réponses ACR-20 et -50, tant pour le tofacitinib 5 mg deux fois par jour que pour le tofacitinib 10 mg deux fois par jour. En revanche, la réponse de l’ACR-70 n’était meilleure qu’avec la dose la plus élevée.
Une autre étude a porté sur le risque d’événements cardiovasculaires sous tofacitinib. L’évaluation d’une étude de phase IV comparant le tofacitinib aux bloqueurs du TNF (adalimumab, étanercept) chez des patients de plus de 50 ans présentant au moins un facteur de risque supplémentaire d’événements cardiovasculaires a montré que le risque d’événements thromboemboliques associé au tofacitinib doit être considéré comme accru.
Le risque d’embolie pulmonaire était également nettement plus élevé sous tofacitinib à la dose de 10 mg et également plus élevé sous 5 mg deux fois par jour que dans les études précédentes. De même, la mortalité globale était plus élevée avec 10 mg deux fois par jour qu’avec 5 mg deux fois par jour. En 2019, l’EMA a donc émis une recommandation selon laquelle le tofacitinib ne devrait pas être utilisé chez les patients présentant un risque thromboembolique élevé. Les patients atteints de PR âgés de plus de 65 ans ne doivent être traités par tofacitinib qu’en l’absence d’alternative thérapeutique.
Upadacitinib
Dans l’étude SELECT-COMPARE, l’upadacitinib a été comparé à l’adalimumab contre placebo chez des patients atteints de PR active et traités par MTX-IR [3]. Dans cette étude, il était possible de passer de l’upadacitinib à l’adalimumab et vice versa (aux semaines 14, 18, 22 et 26) en cas d’amélioration de moins de 20% des articulations douloureuses et gonflées (critères d’évaluation primaires ACR20 et DAS28-CRP <2,6) à la semaine 12.
L’étude menée sur 1629 patients atteints de PR active malgré le MTX a montré que l’upadacitinib (autorisé en Suisse depuis le printemps 2020) est statistiquement plus efficace que l’adalimumab : 71% des patients ont obtenu une réponse ACR20 sous upadacitinib, contre seulement 63% sous adalimumab et 36% sous placebo. 29% des patients ont obtenu une rémission selon le DAS28-CRP, contre seulement 18% sous adalimumab et 6% sous placebo. Parmi les effets secondaires, le zona et l’augmentation des CK étaient plus fréquents avec l’upadacitinib, et des thromboembolies veineuses (TEV) sont survenues chez 3 patients sous adalimumab contre 2 patients sous upadacitinib. En regardant les non-répondeurs, on a pu voir que 13% ont atteint la rémission en passant de l’upadacitinib à l’adalimumab, tandis qu’inversement, le passage de l’adalimumab à l’upadacitinib a donné les résultats escomptés chez 26%.
Dans l’étude SELECT-MONOTHERAPY, 648 patients atteints de PR active malgré le MTX ont été randomisés pour continuer le traitement par MTX ou pour recevoir de l’upadacitinib 15 mg ou 30 mg en monothérapie [4]. Là encore, l’upadacitinib a permis d’obtenir une réponse significativement meilleure : après 14 semaines, 68% des patients sous upadacitinib 15 mg et 71% sous upadacitinib 30 mg ont obtenu une réponse ACR20, contre 41% seulement des patients qui ont poursuivi le traitement par MTX.
Baricitinib
Le baricitinib est autorisé en Suisse depuis 2017 à la dose de 4 mg (2 mg chez les patients âgés ou en cas d’insuffisance rénale). Dans les études cliniques, la substance active une fois par jour à des doses de 2 mg et 4 mg a déjà montré dans le passé une efficacité clinique significative avec une sécurité acceptable [5,6]. Les événements indésirables graves (EIG) les plus fréquemment rapportés au cours de la période contrôlée par placebo étaient des infections.
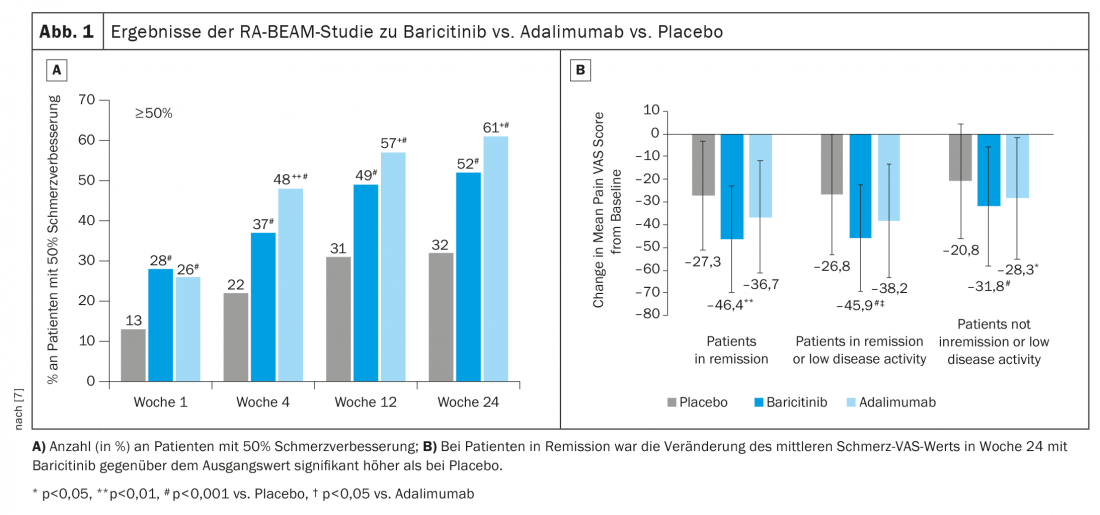
L’étude RA-BEAM a comparé le baricitinib 4 mg + MTX à l’adalimumab + MTX et au placebo + MTX [7]. Ici, il s’est avéré que l’amélioration de 50% de la douleur est meilleure sous baricitinib (Figure 1A). Si l’on ne considère que les patients en rémission ou en faible activité, le baricitinib a un effet significatif sur la douleur. (Fig. 1B). L’effet positif a été observé même après le passage de l’adalimumab au baricitinib après la semaine 16.
En ce qui concerne la réponse vaccinale sous baricitinib, le PCV13 et le tétanos toxoïde (TT) ont été testés. 106 patients de l’étude RA-BEYOND recevant 2 mg ou 4 mg de baricitinib (avec ou sans MTX) ont été vaccinés contre le PCV13 et le tétanos. Au total, 68% des patients ont présenté une réponse vaccinale suffisante contre le pneumocoque et 43% ont obtenu une augmentation de plus de 4 fois des titres vaccinaux contre le tétanos. Une augmentation de plus de 2 fois après le PCV13 a été atteinte par 74% des patients [8].
Nouvelle étude sur les effets à long terme
La sécurité à long terme du baricitinib chez 3770 patients (10 127 patients-années d’exposition, PYE) au cours du programme de développement clinique a déjà été rapportée [9]. Étant donné que le baricitinib, comme d’autres médicaments antirhumatismaux modificateurs de la maladie (DMARD), est utilisé de manière chronique chez les patients atteints de PR, il est important de surveiller et d’évaluer en permanence le profil de sécurité à long terme qui se développe. Ces données à long terme sont les plus pertinentes pour évaluer l’incidence et le risque d’événements indésirables inhabituels d’intérêt particulier (AESI), y compris les affections malignes et les événements cardiovasculaires indésirables graves (MACE). Depuis l’analyse précédente, l’étude d’extension à long terme (long-term-extension, LTE) est terminée et le professeur Peter C. Taylor, du département d’orthopédie, de rhumatologie et de sciences musculo-squelettiques de l’université d’Oxford, et ses collègues ont présenté des résultats dans une mise à jour des données allant jusqu’à 9,3 années de traitement [10].
Leur évaluation a analysé les données regroupées de patients ≥18ans atteints de PR active modérée à sévère, issues de neuf essais cliniques randomisés (cinq de phase III, trois de phase II, un de phase Ib) et d’un LTE achevé. Les critères d’exclusion comprenaient des infections récentes ou en cours (<30 jours avant l’entrée dans l’étude), des infections cliniquement graves nécessitant un traitement antimicrobien et des anomalies de laboratoire sélectionnées (par exemple, tests de fonction hépatique/rénale, hématologie sélectionnée et marqueurs d’infection). Les doses de baricitinib allaient de 1 mg à 15 mg par jour, les doses quotidiennes de 2 mg et 4 mg étant utilisées dans les études de phase III et LTE.
Les patients ayant participé à des études de phase III et de phase II étaient éligibles pour le LTE. Les patients randomisés pour recevoir le baricitinib 2 mg et qui n’ont pas été sauvés dans l’étude initiale ont poursuivi le traitement avec la même dose dans l’ETL ; tous les autres patients ont reçu le baricitinib 4 mg à l’entrée dans l’ETL. Les patients qui ont reçu 4 mg pendant au moins 15 mois sans être secourus et qui ont atteint un niveau d’activité de la maladie durablement faible (score CDAI (Clinical Disease Activity Index) ≤10) ou une rémission (score CDAI ≤2,8) ont été randomisés à l’aveugle à 4 mg ou réduits à 2 mg.
Patients atteints de PR présentant un risque accru d’infection
L’incidence des décès, des événements indésirables graves (y compris les infections), des MACE et de la malignité est similaire pour le baricitinib à celle observée pour d’autres essais thérapeutiques avec des inhibiteurs de JAK et des DMARD biologiques, selon les auteurs. Peu de patients (taux d’incidence ajusté à l’exposition, EAIR, 4,7) ont interrompu le traitement en raison d’événements indésirables. Dans les sous-groupes baricitinib 2 mg et 4 mg, l’incidence de l’AESI était similaire entre les deux groupes de dosage.
Le risque de mortalité chez les patients traités par baricitinib n’a pas augmenté par rapport à la population générale après contrôle de l’âge et du sexe, le taux de mortalité standardisé (SMR) pour le baricitinib étant <1. Les causes de décès des patients traités par baricitinib correspondent aux pourcentages de décès totaux dans la population générale américaine et à ceux rapportés dans les essais cliniques d’autres traitements de la PR.
En raison de la maladie et des interventions thérapeutiques, les patients atteints de PR présentent un risque accru d’infection. L’incidence globale des infections graves est restée stable au fil du temps. Les EAIR d’infections graves dans le groupe baricitinib 2 mg pourraient être numériquement plus faibles que sous 4 mg, ce qui est lié à une activité plus faible de la maladie et à une utilisation plus faible de corticostéroïdes et de MTX au départ. Les infections ayant entraîné la mort étaient rares dans cette population de patients. L’incidence de l’herpès zoster est restée stable et similaire à celle des autres inhibiteurs de JAK, y compris le tofacitinib [11] et l’upadacitinib [12].
Depuis leur évaluation précédente, il y a eu 54 cas supplémentaires de malignité (sans NMSC) avec un IR similaire (0,9 dans l’analyse actuelle vs 0,8), écrivent Taylor et al. [10]. Les patients atteints de PR seraient prédisposés à un risque accru de malignité, notamment de lymphome, de cancer du poumon et de NMSC (cancer de la peau non mélanocytaire). L’incidence des lymphomes est restée inchangée à 0,06 par rapport aux rapports précédents sur le baricitinib et similaire aux autres traitements de la PR, y compris un RI de 0,1 pour l’adalimumab et de 0,096 pour les patients utilisant des inhibiteurs du TNF.
Les risques de malignité restent incertains
Les effets des inhibiteurs de JAK sur le risque de malignité restent incertains et nécessitent des recherches supplémentaires. Les données d’une récente revue systématique et méta-analyse ont conclu qu’il n’y avait pas d’augmentation du risque de malignité chez les patients traités par un inhibiteur de JAK combiné au MTX par rapport aux patients traités par MTX seul [13]. Le professeur Taylor et ses collègues soulignent que 79% des patients inclus dans leur analyse ont utilisé du MTX en même temps. En outre, aucune augmentation du risque de malignité n’a été rapportée dans les études d’observation entre les autres inhibiteurs de JAK (tofacitinib) par rapport aux DMARD synthétiques traditionnels ou aux DMARD biologiques tels que le TNFi [14].
L’IR pour la malignité (sans NMSC) pendant les 48 premières semaines était de 0,6 (IC à 95% 0,34-0,91) dans votre évaluation et est resté stable à environ 1,0 par la suite (IR total 0,9, IC à 95% 0,77-1,09). (Figure 2A). Les types de tumeurs malignes les plus fréquemment rapportés étaient respiratoires et médiastinales (n=26, EAIR=0,17), mammaires (n=23, EAIR=0,15) et gastro-intestinales (n=19, EAIR=0,13). L’IR pour les NMSC était de 0,3 (IC à 95% : 0,25-0,44) et n’a pas augmenté au fil du temps (figure 2B). L’IR pour les lymphomes était de 0,06 (IC à 95% : 0,03-0,11), le lymphome diffus à grandes cellules B restant le sous-type le plus fréquent.
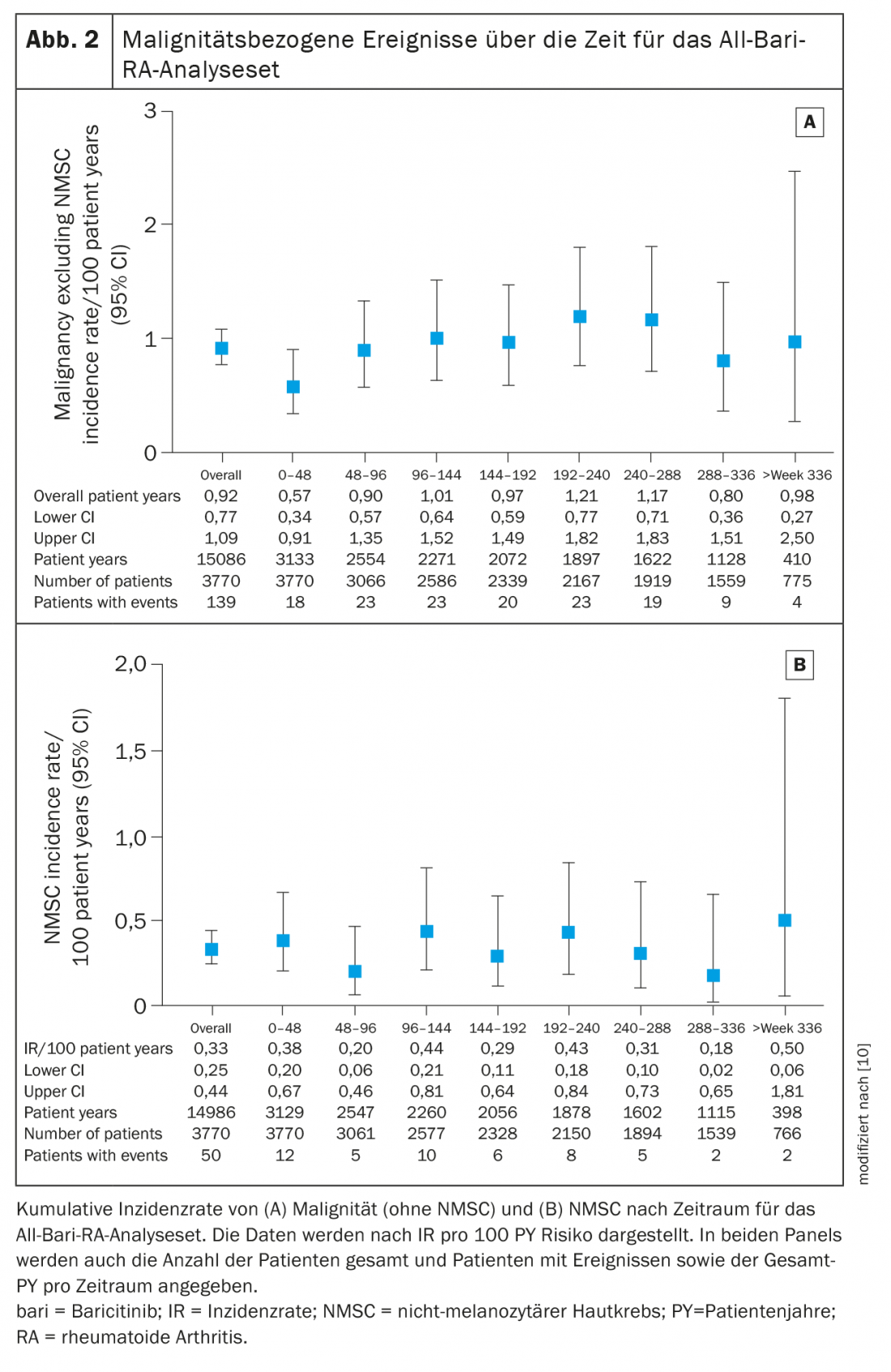
Les patients atteints de PR ont un risque accru de thrombose veineuse profonde (TVP) et d’embolie pulmonaire (EP) (RI 0,3-0,8/100 années-patients) par rapport à la population générale [15,16]. Dans cette analyse, la RI de TVT/PE chez les patients traités par baricitinib était cohérente avec les données précédemment rapportées et comparable à celle des autres inhibiteurs JAK [9]. Dans le sous-groupe de patients ayant reçu 2 mg ou 4 mg de baricitinib, les EAIR entre les groupes de doses étaient similaires et comparables à ceux rapportés précédemment. Alors que des méta-analyses récentes d’essais contrôlés randomisés portant sur les inhibiteurs JAK (y compris le tofacitinib, le baricitinib et l’upadacitinib) n’ont pas montré d’augmentation du risque d’événements thromboemboliques veineux chez les patients atteints de PR au cours des périodes contrôlées par placebo, des données à plus long terme seraient nécessaires, selon les auteurs, pour caractériser pleinement le risque de ces événements. L’incidence de la MACE dans l’étude actuelle (0,5) est également restée faible et stable par rapport aux rapports précédents. L’EAIR de MACE était similaire entre le baricitinib 2 mg (0,42) et 4 mg (0,54). Parmi les patients, 55% présentaient au moins un des cinq facteurs de risque cardiovasculaire au début de l’étude utilisés dans l’analyse (fumeur actuel, hypertension, diabète, antécédents de troubles athérosclérotiques ou cholestérol HDL <40 mg/dl), comme prévu, l’IR pour l’ECAM était plus élevé (0,70) dans cette sous-population à risque.
L’EAIR pour la diverticulite dans l’étude actuelle (0,15) est en accord avec les données publiées chez les patients atteints de PR [17]. Les principaux facteurs de risque de diverticulite dans la population générale sont l’âge, l’obésité, l’alimentation, le tabagisme et la consommation de médicaments, en particulier les opioïdes, les corticostéroïdes et les anti-inflammatoires non stéroïdiens. La diverticulite dans l’étude à long terme est apparue chez les patients présentant des facteurs de risque. L’IR pour les perforations gastro-intestinales (0,06) reste faible dans le contexte des rapports sur le tofacitinib, le tocilizumab et d’autres DMARD biologiques en données réelles et en ce qui concerne l’upadacitinib (0,08/100 patients-années) [18].
Messages Take-Home
- En tant qu’antirhumatismaux modificateurs de la maladie, les inhibiteurs JAK sont utilisés de manière chronique chez les patients atteints de PR. Il est important de surveiller et d’évaluer en permanence le profil de sécurité à long terme qui se développe.
- Le profil de sécurité des inhibiteurs de JAK dans les essais cliniques comprend un risque accru d’herpès zoster et des associations avec une augmentation des événements cardiovasculaires, des événements thromboemboliques veineux (TEV) et des maladies malignes.
- Dans une étude récente à long terme sur le baricitinib, la molécule s’est montrée stable en termes d’événements liés à la sécurité, y compris les décès, les tumeurs malignes, les MACE et les TVT/PE, sur une période allant jusqu’à 9,3 ans, et était généralement similaire entre les groupes 2 mg et 4 mg.
- Les résultats indiquent que le baricitinib présente un profil de sécurité cohérent et cohérent avec les autres inhibiteurs de JAK et les antirhumatismaux biologiques modificateurs de la maladie.
- Un suivi continu et des recherches supplémentaires, y compris des études à long terme basées sur la population, sont nécessaires pour comprendre pleinement le risque de critères d’évaluation, y compris les tumeurs malignes, la MACE et la TEV, et le risque réel comparé du baricitinib et des traitements de la PR.
Littérature :
- Smolen JS, et al : Recommandations de l’EULAR pour la prise en charge de l’arthrite rhumatoïde avec des médicaments antirhumatismaux de synthèse et biologiques modifiant la maladie : mise à jour 2019. Ann Rheum Dis 2020;79 : 685-699 ; doi : 10.1136/annrheumdis-2019-216655.
- Bird P, Hall S, Nask P, et al : RMD open 2019 ; 5 : e000742 ; doi : 10.1136/rmdopen-2018-000742.
- Fleischmann R, Pangan AL, Song ICH et al : Arthritis Rheumatol 2019 ; 71(11) : 1788-1800.
- Smolen JS, Pangan AL, Emery P, et al : Lancet 2019 ; 393 : 2303-2311.
- Taylor PC, Keystone EC, van der Heijde D, et al : Baricitinib versus placebo or adalimumab in rheumatoid arthritis. N Engl J Med 2017 ; 376 : 652-662 ; doi : 10.1056/NEJMoa1608345
- Genovese MC, Kremer J, Zamani O, et al : Baricitinib in patients with refractory rheumatoid arthritis. N Engl J Med 2016 ; 374 : 1243-1252 ; doi : 10.1056/NEJMoa1507247
- Fautrel B, Kirkham B, Pope JE, et al : J Clin Med 2019 ; 8 : 1394-1408.
- Winthrop K, Bingham CO, Komocsar WJ, et al : Arthritis Res Ther 2019 ; 21 : 102-112.
- Genovese MC, Smolen JS, Takeuchi T, et al : Safety profile of baricitinib for the treatment of rheumatoid arthritis over a median of 3 years of treatment : an updated integrated safety analysis. Lancet Rheumatol 2020 ; 2 : e347-e357 ; doi : 10.1016/S2665-9913(20)30032-1.
- Taylor PC, Takeuchi T, Burmester GR, et al : Sécurité du baricitinib pour le traitement de l’arthrite rhumatoïde sur une durée médiane de 4,6 et jusqu’à 9,3 ans de traitement : résultats finaux de l’étude d’extension à long terme et de la base de données intégrée. Annals of the Rheumatic Diseases 2021 (online first) ; doi : 10.1136/annrheumdis-2021-221276.
- Winthrop KL, Curtis JR, Lindsey S, et al : Herpes zoster and tofacitinib : clinical outcomes and the risk of concomitant therapy. Arthritis Rheumatol 2017;69 : 1960-1968 ; doi : 10.1002/art.40189.
- van Vollenhoven R, Takeuchi T, Pangan AL : A phase 3, randomized, controlled trial comparing upadacitinib monotherapy to MTX monotherapy in MTX-naïve patients with active rheumatoid arthritis [abstract]. Arthritis Rheumatol 2018 ; 70.
- Solipuram V, Mohan A, Patel R, et al : Effect of Janus kinase inhibitors and methotrexate combination on malignancy in patients with rheumatoid arthritis : a systematic review and meta-analysis of randomized controlled trials. Auto Immun Highlights 2021 ; 12(8) ; doi : 10.1186/s13317-021-00153-5.
- Xie W, Yang X, Huang H, et al : Risk of malignancy with non-TNFi biologic or tofacitinib therapy in rheumatoid arthritis : a meta-analysis of observational studies. Semin Arthritis Rheum 2020 ; 50 : 930-937 ; doi : 10.1016/j.semarthrit.2020.08.007.
- Kim SC, Schneeweiss S, Liu J, et al : Risk of veinous thromboembolism in patients with rheumatoid arthritis. Arthritis Care Res 2013 ; 65 : NA-7 ; doi : 10.1002/acr.22039.
- Ogdie A, Kay McGill N, Shin DB, et al : Risk of veinous thromboembolism in patients with psoriatic arthritis, psoriasis and rheumatoid arthritis : a general population-based cohort study. Eur Heart J 2018 ; 39 : 3608-3614 ; doi : 10.1093/eurheartj/ehx145.
- Bharucha AE, Parthasarathy G, Ditah I, et al : Temporal trends in the incidence and natural history of diverticulitis : a population-based study. Am J Gastroenterol 2015 ; 110 : 1589-1596 ; doi : 10.1038/ajg.2015.302.
- Cohen SB, van Vollenhoven RF, Winthrop KL : Correction : profil de sécurité de l’upadacitinib dans l’arthrite rhumatoïde : analyse intégrée du programme clinique SELECT phase III. Ann Rheum Dis 2021 ; 80 : 304-311 ; doi : 10.1136/annrheumdis-2020-218510.
InFo DOULEUR & GERIATRIE 2021 ; 3(2) : 6-9













