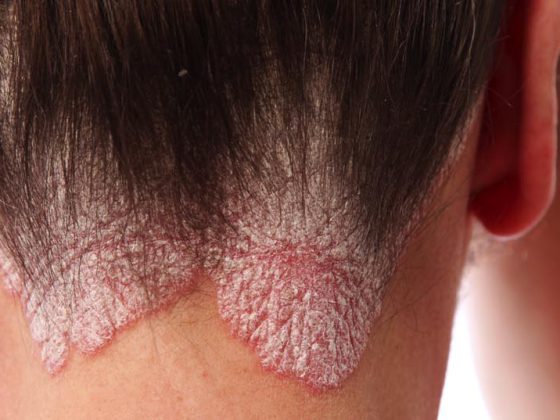
Le psoriasis est une maladie de la peau provoquée par un dérèglement du système immunitaire suivi d’une forte croissance cellulaire. On peut le distinguer en plusieurs formes : Psoriasis en plaques (psoriasis vulgaire), psoriasis guttata, psoriasis inversé, psoriasis pustuleux et psoriasis érythrodermique. La plupart du temps, les personnes concernées ne souffrent que d’un seul type, mais celui-ci peut se rétracter et réapparaître sous une autre forme, déclenché par un élément déclencheur. Lors du congrès de l’AAD à Denver, les progrès dans le domaine du traitement du psoriasis vulgaire ont été discutés.
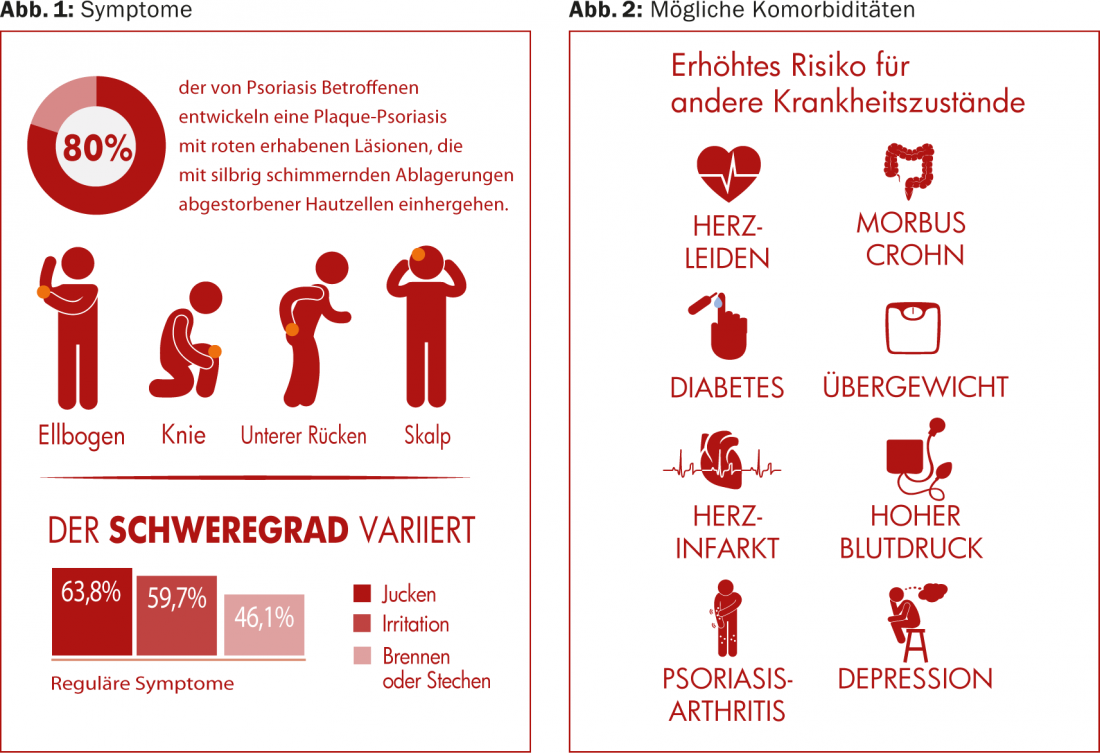
(ag) Le psoriasis vulgaire est le plus fréquent dans cette pathologie (dans environ 80% des cas de psoriasis). Elle provoque des lésions rouges en relief, accompagnées de dépôts de cellules mortes aux reflets argentés. Elles se situent généralement au niveau des coudes, des genoux, du scalp et du bas du dos (Fig. 1). La prévalence varie considérablement dans le monde, allant d’environ 1% de la population adulte aux États-Unis à 8,5% en Norvège [1]. La maladie se manifeste souvent entre 15 et 30 ans. Les femmes sont presque aussi touchées que les hommes, tandis que les enfants sont un peu moins touchés que les adultes (0 à Taïwan, 2,1% en Italie [1]).
Causes et risques du psoriasis
Bien qu’il n’existe pas simplement un “gène du psoriasis”, les experts s’accordent à dire que la maladie est très probablement génétiquement déterminée. La prédisposition génétique dans l’ensemble de la population est cependant plus élevée que le taux de prévalence réel, car seule une fraction développe un psoriasis, généralement déclenché par un facteur déclenchant externe tel que le stress, les blessures ou les médicaments.
Le psoriasis entraîne un risque accru d’autres problèmes de santé, notamment les maladies cardiovasculaires (athérosclérose, infarctus du myocarde), le syndrome métabolique et d’autres maladies inflammatoires à médiation immunitaire (arthrite psoriasique, maladie de Crohn). (Fig. 2). Alors que l’on a longtemps pensé que les maladies cardiovasculaires étaient liées à l’obésité et à la consommation de tabac, également fréquentes, plutôt qu’au psoriasis en soi, on se demande aujourd’hui si ce n’est pas plutôt l’inflammation chronique du psoriasis lui-même qui est responsable. Le psoriasis est particulièrement souvent associé à une inflammation et des douleurs articulaires, l’arthrite psoriasique [2], les symptômes cutanés pouvant apparaître plusieurs années avant les symptômes articulaires.
Comment le système immunitaire contrôle-t-il l’inflammation ?
Pour la guérison, il est essentiel que le système immunitaire soit en mesure d’arrêter la réaction inflammatoire et de revenir à un état de calme. Ceci est réalisé en rééquilibrant les facteurs pro- et anti-inflammatoires [3].
La phosphodiestérase-4 (PDE4) est une enzyme présente dans les cellules immunitaires qui entretient l’inflammation en réduisant le niveau d’adénosine monophosphate cyclique (AMPc) au sein de la cellule [4,5]. Il joue donc un rôle central dans la production de facteurs pro-inflammatoires, qui sont sécrétés par de nombreux types de cellules. En même temps, il diminue la production de facteurs anti-inflammatoires.
Bien que les voies exactes menant à l’inflammation de la peau dans le psoriasis soient encore à l’étude, on peut supposer que le cœur du problème réside dans la réponse inflammatoire qui ne s’arrête jamais et dans laquelle la PDE4 pourrait jouer un rôle central.
ESTEEM 1
Les médicaments qui inhibent la PDE4 augmentent les niveaux d’AMPc dans les cellules immunitaires, ce qui se traduit par une diminution de la production de médiateurs de l’inflammation (par ex. TNF-α IL-23, IL-17). Ainsi, en modifiant l’interaction entre les signaux immunitaires pro-inflammatoires et anti-inflammatoires, ils peuvent réduire l’inflammation [6].
Lors du congrès de l’AAD qui s’est tenu cette année à Denver, Kim Papp, MD, Waterloo, a évoqué les nouveaux résultats de l’étude randomisée et contrôlée de phase III ESTEEM 1 [7]. L’étude portait sur l’aprémilast (APR), un inhibiteur de la PDE4 par voie orale.
844 patients atteints de psoriasis modéré à sévère (PASI ≥12, “body surface area” [BSA] ≥10%, “static physician’s global assessment” [sPGA] ≥3) ont été randomisés pour recevoir un placebo (PBO) ou un APR 30 mg selon un rapport 2:1. A la semaine 16, tous ceux du groupe placebo sont passés à l’APR. Ils y sont restés jusqu’à la semaine 32, après quoi tous les patients APR ayant entre-temps atteint un PASI-75 ont été randomisés pour recevoir soit l’APR 30 mg, soit le placebo (1:1). En cas de perte du statut PASI-75, les patients précédemment re-randomisés vers le placebo ont à nouveau pris de l’APR.
Résultats : A la semaine 16, un nombre significativement plus élevé de patients sous APR 30 mg avaient atteint un PASI-75 (33,1%) et un PASI-50 (58,7%) que ceux sous placebo (5,3 et 17,0%, p<0,0001). Le pourcentage moyen/médian de variation du PASI depuis la ligne de base était de -52,1/-59,0% pour l’APR et de -16,8/-14,0% pour le placebo. Cette différence était également hautement significative d’un point de vue statistique (p<0,0001).
En général, les changements se sont poursuivis jusqu’à la semaine 32. Des réponses PASI similaires ont été obtenues cette semaine chez les patients qui étaient passés du placebo à l’APR 16 semaines auparavant.
Lors de la phase d’arrêt randomisée (semaine 52), 61,0% des 77 patients randomisés pour l’APR à la semaine 32 étaient répondeurs au PASI-75. En comparaison, seuls 11,7% (n=77) des patients re-randomisés vers le placebo à la semaine 32 ont atteint un tel statut. Dans ce groupe, le délai médian de perte du PASI-75 était de 5,1 semaines. Après que ces patients soient repassés à l’APR comme décrit ci-dessus, 70,3% d’entre eux ont à nouveau atteint un PASI-75.
Les effets secondaires : Dans l’ensemble, l’APR a été bien toléré pendant 52 semaines. Le nombre de nouveaux effets secondaires n’a pas augmenté au fil des semaines. Les plus fréquents étaient la diarrhée (18,7%), les “infections des voies respiratoires supérieures” (URTI, 17,8%), les nausées (15,3%), la rhinopharyngite (13,4%), les maux de tension (9,6%) et les céphalées normales (6,5%). La plupart des effets indésirables ont été considérés comme légers à modérés et n’ont pas entraîné l’arrêt du traitement. Les cas graves tels que les infections, la malignité et les événements cardiovasculaires étaient cohérents avec les études APR précédentes.
Conclusion : “L’aprémilast est efficace dans les cas de psoriasis modérés à sévères”, a résumé le Dr Papp en présentant les résultats. “Lors de la phase d’arrêt randomisée, les réponses PASI se sont maintenues chez les patients qui avaient été re-randomisés à l’APR 30 mg. L’aprémilast a en outre présenté un profil de sécurité acceptable et a été bien toléré jusqu’à la semaine 52”.
Source : American Academy of Dermatology (AAD) Annual Meeting, 21-25 mars 2014, Denver
Littérature :
- Parisi R, et al : Global epidemiology of psoriasis : a systematic review of incidence and prevalence. J Invest Dermatol 2013 Feb ; 133(2) : 377-385.
- Mease PJ : Psoriatic arthritis – update on pathophysiology, assessment, and management. Bull NYU Hosp Jt Dis 2010 ; 68(3) : 191-198.
- Van Parijs L, Abbas AK : Homeostasis and self-tolerance in the immunity system : turning lymphocytes off. Science 1998 Avril 10 ; 280(5361) : 243-248.
- Taskén K, Aandahl EM : Effets localisés de l’AMPc médiés par des voies distinctes de la protéine kinase A. Physiol Rev 2004 Jan ; 84(1) : 137-167.
- Bäumer W, et al : Inhibiteurs hautement sélectifs de la phosphodiestérase 4 pour le traitement des maladies allergiques de la peau et du psoriasis. Inflamm Allergy Drug Targets 2007 Mar ; 6(1) : 17-26.
- Castro A, et al : Cyclic nucleotide phosphodiesterases and their role in immunomodulatory responses : advances in the development of specific phosphodiesterase inhibitors. Med Res Rev 2005 Mar ; 25(2) : 229-244.
- Papp K, et al. : Apremilast, an Oral Phosphodiesterase 4 Inhibitor, in Patients With Moderate to Severe Psoriasis : Results From the Randomized Treatment Withdrawal Phase of a Phase 3, Randomized, Controlled Trial (ESTEEM 1). Poster AAD 2014 #8359.
SPÉCIAL CONGRÈS 2014 ; 5(2) : 11-13