L’épidémiologie des bactéries multirésistantes a changé en Suisse : nette diminution des SARM et forte augmentation des entérobactéries productrices de BLSE. Les germes ESBL peuvent être acquis par le biais d’aliments (viande de volaille, légumes, etc.). Les patients de retour de voyage et les patients rapatriés de l’étranger présentent un risque accru de micro-organismes multirésistants. En cas d’absence de réponse à une antibiothérapie empirique, un examen microbiologique est indiqué en raison d’une possible résistance. Les E. coli, y compris les isolats de BLSE, sont toujours bien sensibles à la fosfomycine et à la nitrofurantoïne.
La résistance croissante aux antibiotiques menace de nombreux acquis de la médecine moderne. Les autorités sanitaires de l’UE et des États-Unis estiment que la résistance aux antibiotiques est responsable d’environ 25 000 décès par an chacune. Les patients sont déstabilisés par les articles de presse sur les infections bactériennes qui ne peuvent plus être traitées.
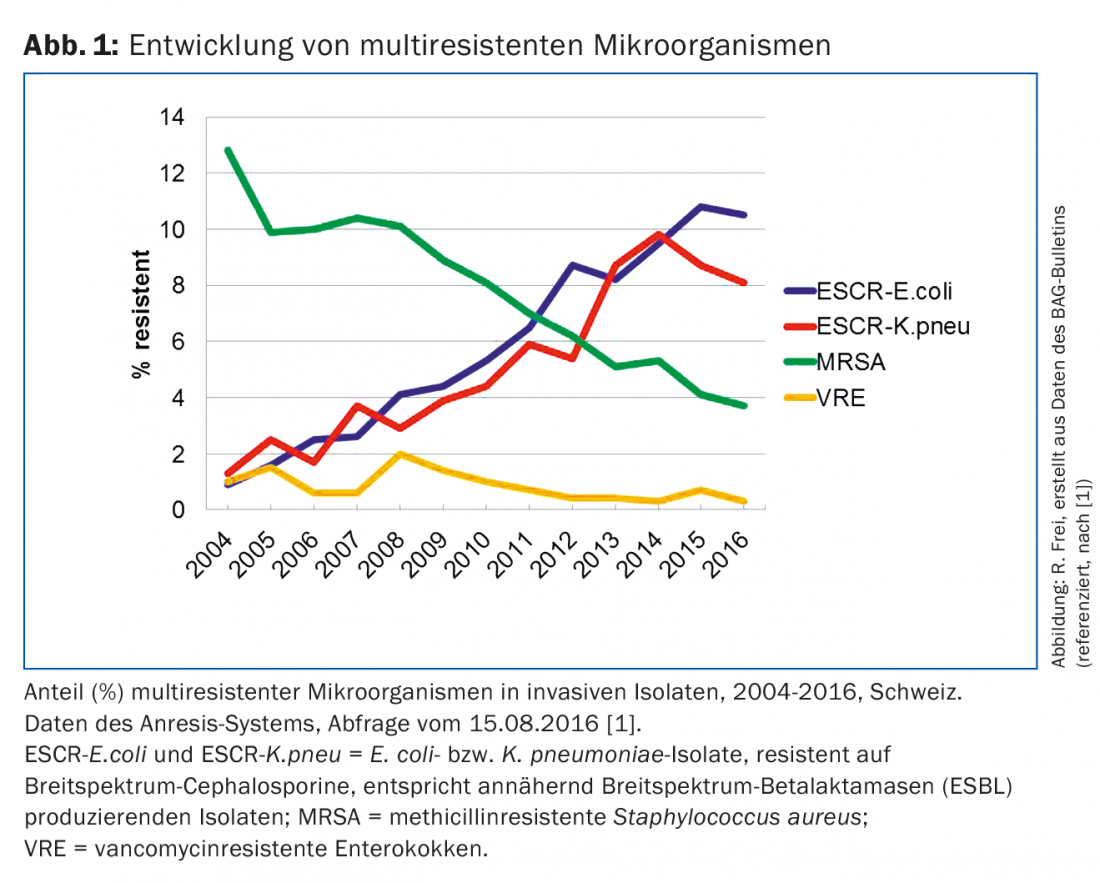
Les bactéries multirésistantes sont résistantes à plusieurs classes d’antibiotiques. Les micro-organismes multirésistants posent de gros problèmes dans les hôpitaux du monde entier, notamment diverses entérobactéries, Pseudomonas aeruginosa, Acinetobacter baumannii, Staphylococcus aureus et entérocoques. Par rapport à de nombreux autres pays, la plupart des taux de résistance sont plus faibles en Suisse. Dans notre pays, un médecin de premier recours est principalement confronté à des Escherichia coli multirésistants , plus rarement à d’autres isolats d’entérobactéries résistantes et à des S. aureus résistants à la méthicilline (SARM). Il n’entre en contact qu’occasionnellement avec d’autres germes multirésistants, parmi lesquels des campylobacters, des gonocoques et des agents de la tuberculose résistants. Selon le système de surveillance suisse Anresis (www.anresis.ch), la prévalence des bactéries multirésistantes a évolué différemment au cours des 12 dernières années [1]. Alors que la proportion d’isolats de SARM a nettement diminué, les entérobactéries résistantes aux céphalosporines à large spectre et à d’autres classes de substances ont connu une augmentation constante et importante (figure 1 ) [1].
SARM
En 2015, en Suisse alémanique, près de 6% des isolats de S. aureus testés chez des patients ambulatoires étaient encore résistants à la méthicilline (SARM). Dans les pays du sud et du centre de l’Europe, le taux de SARM était en revanche nettement plus élevé, par exemple en France 17%, en Italie 34% et au Portugal même 47%. Auparavant, les SARM se propageaient principalement dans les hôpitaux et autres institutions médicales (healthcare-associated MRSA). Depuis plusieurs années, de nouvelles souches aux caractéristiques différentes apparaissent et peuvent provoquer des infections agressives dans les services ambulatoires, même chez des patients plus jeunes et sans contact préalable avec les services de santé (community-associated MRSA). Ces dernières années, on a également observé que les personnes en contact étroit avec des animaux avaient plus de risques d’être porteuses de SARM. Le SARM a été trouvé chez différents animaux, en particulier chez les chevaux et les chiens, mais surtout chez les animaux d’élevage comme les poulets et les porcs [2]. En Suisse, le taux de colonisation de SARM chez les porcs d’engraissement à l’abattoir a augmenté depuis 2009, passant de 2% à 26,5% en 2014. Le responsable est une lignée clonale de SARM (CC398) que l’on trouve également fréquemment chez les animaux d’élevage d’autres pays européens. Elle fait partie des SARM “associés aux animaux d’élevage” (livestock-associated), qui affectent particulièrement les personnes en contact professionnel avec les porcs, comme les agriculteurs et les vétérinaires [3]. Les autres personnes à risque pour les infections à SARM sont les personnes et les voyageurs de retour d’Europe du Sud ou des États-Unis, les patients et les employés des établissements de santé tels que les centres de rééducation ou les maisons de soins qui présentent un taux élevé de SARM.
Mesures à prendre en cas de SARM
En cas d’infections agressives de la peau et des tissus mous et/ou d’absence de réponse aux antibiotiques bêtalactames (tels que l’amoxicilline-acide clavulanique), le SARM doit être suspecté et un diagnostic microbiologique doit être demandé. Le meilleur moyen de détecter les porteurs est d’effectuer un prélèvement dans le nez et la gorge. Après un contact avec un patient dans un cabinet médical, il est important de désinfecter les mains et les surfaces de contact avec des préparations à base d’alcool. En cas de contact plus étroit, par exemple lors d’un examen, il est préférable de porter une surblouse, un masque et des gants. Les patients hospitalisés doivent être isolés par contact. En raison de la résistance croisée aux pénicillines et aux céphalosporines, tous les antibiotiques bêtalactamines per os actuellement disponibles sont inefficaces. En monothérapie, la clindamycine, le cotrimoxazole ou le linézolide (Zyvoxid®) par voie perorale conviennent en ambulatoire en cas de sensibilité avérée. La clindamycine ne doit être utilisée que si la souche a également été testée sensible aux macrolides ou si la résistance aux MLSB a été exclue. Un traitement de décolonisation du SARM peut être administré aux patients immunodéprimés colonisés ou au personnel des établissements de santé, après consultation d’un centre.
Entérobactéries productrices de BLSE
En Suisse, 7% des isolats d’Escherichia coliprovenant du tractus urogénital de patients ambulatoires sont actuellement résistants aux céphalosporines de troisième génération (tab. 1). Environ 95% de ces souches produisent des bêtalactamases à large spectre (extended-spectrum beta-lactamases, ESBL), dont les gènes sont localisés de manière mobile sur des plasmides. Elles peuvent ainsi être transmises à d’autres cellules bactériennes, espèces et genres, et se propager rapidement. Ces souches sont souvent multirésistantes.
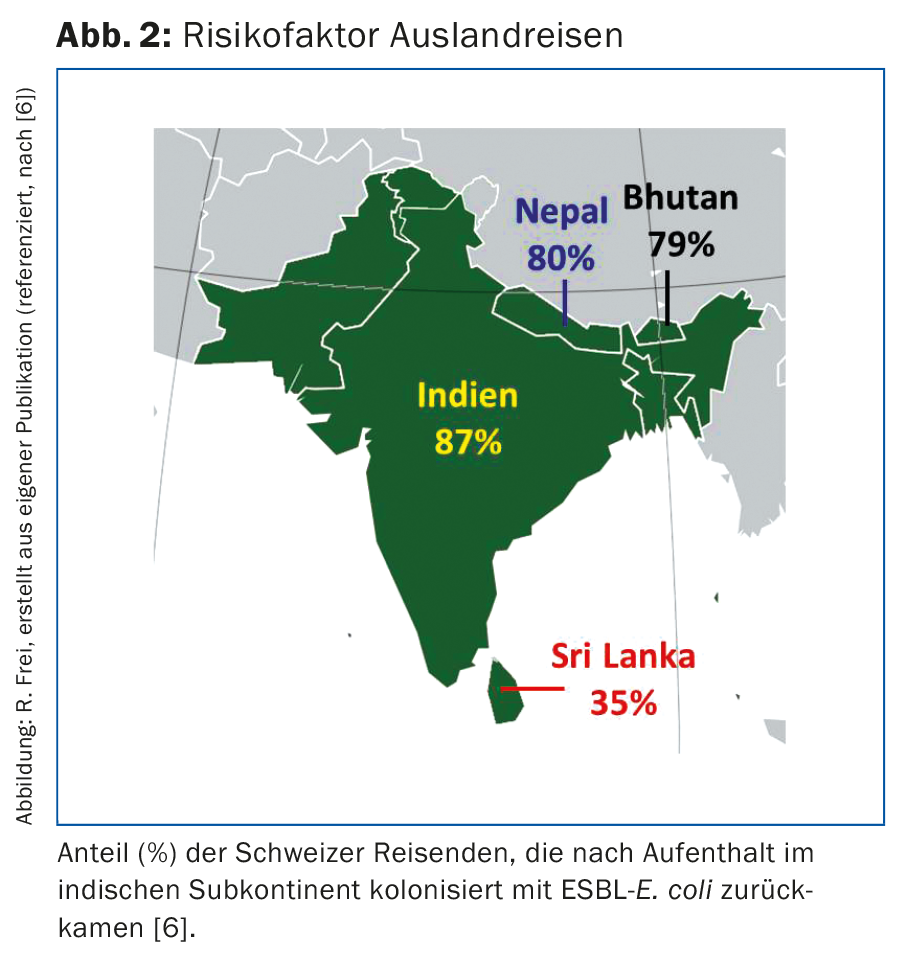
Avant l’an 2000, les isolats d’E. coli et de Klebsiella pneumoniae produisant des BLSE étaient principalement présents chez les patients des hôpitaux et des maisons de soins. Aujourd’hui, les E. coli ESBL sont majoritairement acquis en dehors des institutions médicales. Les bactéries produisant des BLSE peuvent être trouvées dans divers aliments [2,4]. Ainsi, des E. coli ESBL ont été détectés dans 66% des échantillons de viande de poulet de production suisse, et même dans 86% des échantillons de viande de poulet d’origine étrangère [2]. De telles souches ont également été retrouvées dans des échantillons d’autres viandes de volaille, de porc et de bœuf, ainsi que dans divers échantillons de légumes. L’utilisation d’antibiotiques en médecine vétérinaire favorise la sélection, la multiplication et la propagation de bactéries résistantes chez les animaux d’élevage et dans l’agriculture. En 2014, près de 50 000 kg d’antibiotiques destinés à la médecine vétérinaire ont été vendus en Suisse [2]. Aux États-Unis, la quantité d’antibiotiques utilisée pour les animaux est quatre fois plus importante que celle utilisée pour les humains. Même si un chauffage suffisant des aliments tue les bactéries, des germes peuvent être transmis à l’homme par des ustensiles de cuisine, des mains et des aliments crus contaminés. Nos propres recherches ont montré qu’après le traitement de la viande de poulet, 8% des planches de cuisine chez les particuliers et 16% dans les cuisines d’hôpitaux étaient contaminées par des germes ESBL [5]. Les gants des cuisiniers étaient même positifs pour les BLSE dans 50% des cas. Les voyages à l’étranger représentent un autre risque : Les voyageurs suisses en Inde étaient 87% à être colonisés par ESBL-E. coli par voie rectale à leur retour, alors que seulement 3% étaient porteurs d’ESBL avant leur départ (Fig. 2) [6]. Un taux de portage d’au moins 30 % a été observé chez les voyageurs en provenance d’autres pays du sous-continent indien, d’Asie du Nord et du Sud-Est, d’Afrique et d’Amérique du Sud [7]. Les autres personnes présentant un risque accru de BLSE sont les employés des abattoirs, les cuisiniers, les résidents des maisons de retraite et de soins, les patients de plus de 65 ans ou ceux qui ont reçu un prétraitement antibiotique [8].
Traitement des infections à BLSE
ESBL-E. coli ont également augmenté de manière dramatique en Suisse [1]. Entre 2004 et 2014, leur proportion d’isolats invasifs d’E. coli a été multipliée par dix (de 1 à 10%). Des taux similaires ou plus élevés ont été rapportés dans la plupart des pays européens, avec des taux dépassant même 25% en Italie, en Roumanie et en Bulgarie. La prolifération des bactéries productrices de BLSE dans toutes les régions de Suisse, tant chez les enfants que chez les patients adultes et âgés, a rendu le traitement des infections à E. coli et K. pneumoniae plus difficile. Le tableau 1 résume la résistance actuelle des isolats d’E. coliprovenant de patients ambulatoires. Le tableau montre également la multirésistance des isolats de BLSE, avec des taux de résistance de 70% aux quinolones et au cotrimoxazole. En revanche, la fosfomycine, la nitrofurantoïne et les carbapénèmes présentent des taux de résistance faibles, compris entre 0 et 4%, ce qui peut être utilisé à des fins thérapeutiques pour les infections urinaires non compliquées. Le traitement d’autres infections par des souches de BLSE peut être difficile et nécessite un test de résistance aux antibiotiques. Pour les infections graves, les carbapénèmes sont considérés comme le traitement de choix. Comme l’ertapénème (Invanz®) ne doit être administré qu’une fois par jour (1 g i.v.), il peut également être utilisé en ambulatoire. L’effet clinique de l’amoxicilline-acide clavulanique est incertain, même en cas de sensibilité avérée de l’agent pathogène BLSE, sauf en cas d’infections des voies urinaires. Les porteurs de BLSE sont détectés de la manière la plus fiable à l’aide d’un frottis rectal ou d’un échantillon de selles, d’urine et d’échantillons prélevés sur des sites cliniquement infectés [8]. Cependant, jusqu’à présent, aucun schéma de décolonisation n’a malheureusement montré de succès à long terme. Comme la transmission de ESBL-E. coli s’est déplacée de l’hôpital vers la communauté et que le taux de transmission dans les hôpitaux de soins aigus est faible, de nombreux hôpitaux de soins aigus ont abandonné l’isolement de contact strict pour ESBL-E. coli [8]. Pour les patients colonisés ou infectés par d’autres entérobactéries productrices de BLSE (par ex. K. pneumoniae), l’isolement par contact reste recommandé.
Le cauchemar des carbapénèmes
On connaît aujourd’hui plus de 1000 bêtalactamases bactériennes différentes. Parmi elles, les carbapénèmases sont les plus redoutables, car elles inactivent non seulement les carbapénèmes, mais aussi pratiquement tous les antibiotiques bêtalactames. La plupart des bâtonnets à Gram négatif producteurs de carbapénémases sont également extrêmement multirésistants. Même un test avancé de résistance aux antibiotiques ne révèle souvent que 1 ou 2 substances actives, comme la colistine. Parfois, aucune des préparations disponibles sur le marché n’est plus efficace in vitro. Jusqu’à présent, de telles souches n’apparaissaient que sporadiquement en Suisse et étaient presque toujours importées d’autres pays. Les carbapénèmases de type KPC sont plus fréquentes en Italie, en Grèce, en Israël et aux Etats-Unis et sont jusqu’à présent le type le plus fréquent en Suisse (environ 45% des carbapénèmases identifiées) [9]. Les carbapénèmes de type NDM se sont principalement répandus en Inde et dans les Balkans et ont été transportés dans d’autres pays par des voyageurs, des patients et des migrants. Les enzymes du groupe OXA-48 ont été introduites dans les pays européens depuis la Turquie, l’Afrique du Nord et le Moyen-Orient et représentent environ un tiers des carbapénèmases en Suisse. Récemment, un mécanisme de résistance à la colistine (MCR-1) a été découvert dans des isolats provenant de Chine et d’autres pays, y compris la Suisse, et s’est propagé par le biais de plasmides [10]. Il est recommandé à un praticien qui prend en charge un patient atteint d’une bactérie productrice de carbapénémase de consulter un service d’infectiologie.
Littérature :
- Office fédéral de la santé publique. Anresis.ch : Déclarations d’une sélection de micro-organismes multirésistants en Suisse. Bulletin 2016 ;(35) : 530.
- Office fédéral de la sécurité alimentaire et des affaires vétérinaires OFAG : ARCH-Vet. Rapport sur la distribution des antibiotiques en médecine vétérinaire et la surveillance de la résistance aux antibiotiques chez les animaux de rente en Suisse. Rapport général 2014. www.blv.admin.ch/blv/de/home/tiere/tierseuchen/tierarzneimittel/antibiotika/vertrieb.html
- Larsen J, et al : Evidence for human adaptation and foodborne transmission of livestock-associated methicillin-resistant Staphylococcus aureus. Clin Infect Dis 2016 ; Sep 20. pii : ciw532. [Epub ahead of print]
- Zogg AL, et al. : Caractéristiques des entérobactéries productrices de BLSE et des Staphylococcus aureus résistants à la méthicilline (SARM) isolés à partir de viande de volaille crue suisse et importée collectée au niveau du commerce de détail. Schweiz Arch Tierheilkd 2016 ; 158(6) : 451-456.
- Tschudin-Sutter S, et al. : Enterobacteriaceae produisant de la β-lactamase à spectre étendu (ESBL) : une menace de la cuisine. Infect Control Hosp Epidemiol 2014 ; 35(5) : 581-584.
- Kuenzli E, et al : High colonization rates of extended-spectrum β-lactamase (ESBL)-producing Escherichia coli in Swiss travellers to South Asia – a prospective observational multicentre cohort study looking at epidemiology, microbiology and risk factors. BMC Infect Dis 2014 ; 14:528.
- Ostholm-Balkhed A, et al : Travel-associated faecal colonization with ESBL-producing Enterobacteriaceae : incidence and risk factors. J Antimicrob Chemother 2013 ; 68(9) : 2144-2153.
- Tissot F, et al. : Enterobacteriaceae avec bêta-lactamases à large spectre (BLSE) à l’hôpital : nouvelles recommandations Swissnoso 2014. www.swissnoso.ch/wp-content/uploads/pdf/v18_2_de.pdf
- Babouee B, et al. : Emergence de quatre cas de Klebsiella pneumoniae porteuse de KPC-2 et KPC-3 introduits en Suisse, 2009-10. Euro Surveill 2011 ; 16(11). pii : 19817.
- Nordmann P, et al : Plasmid-mediated colistin resistance : an additional antibiotic resistance menace. Clin Microbiol Infect 2016 ; 22(5) : 398-400.
PRATIQUE DU MÉDECIN DE FAMILLE 2016 ; 11(12) : 16-19