Les troubles du sommeil et des performances cognitives augmentent avec l’âge. Le sommeil et la cognition sont étroitement liés. C’est pourquoi le traitement des troubles du sommeil chez les personnes âgées revêt une grande importance pour le bon fonctionnement de la vie quotidienne.
Avec l’âge, les performances physiques et mentales diminuent. Les changements dans les processus métaboliques et l’apparition accrue de maladies en sont responsables. Ces deux facteurs ont un impact à la fois sur le sommeil et sur les performances cognitives : Les troubles du sommeil augmentent avec l’âge, tandis que la forme intellectuelle diminue. Le sommeil, et plus particulièrement ses différentes composantes, est étroitement lié à cette dernière.
Comment le sommeil change-t-il avec l’âge ?
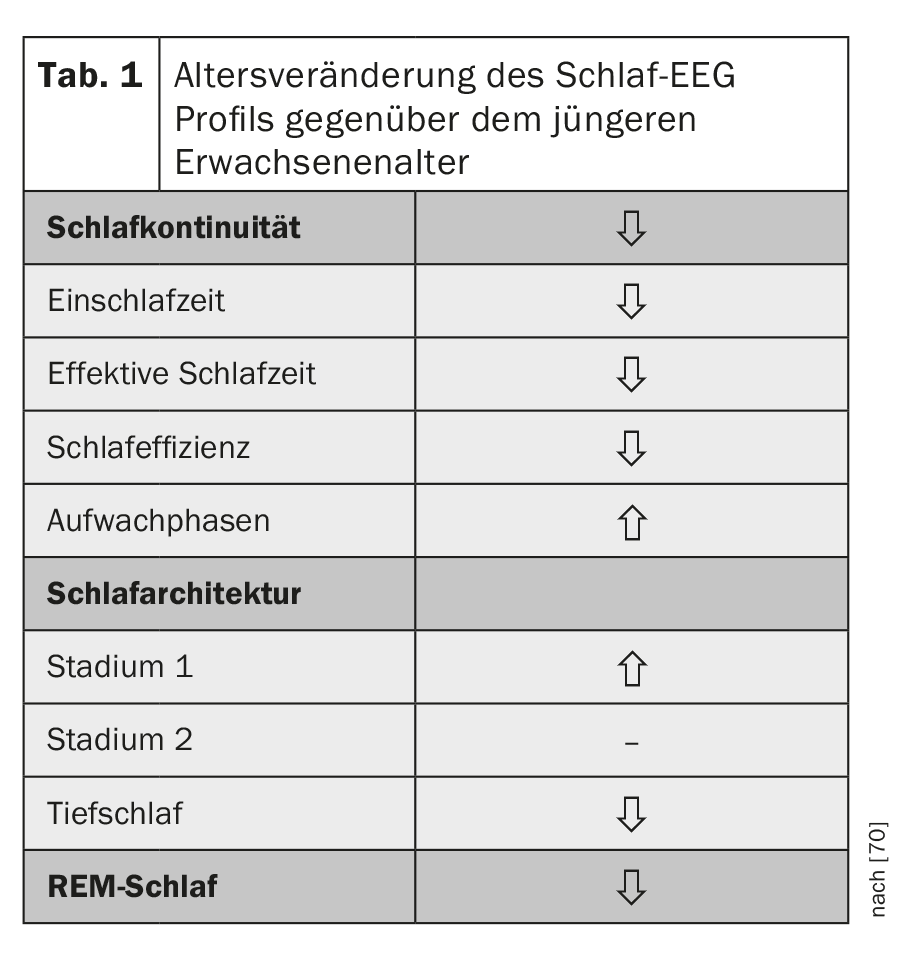
Avec l’âge, le sommeil devient plus court et plus léger. L’objectivation de ces troubles du sommeil observables par une dérivation EEG du sommeil montre que la continuité du sommeil se caractérise par une moindre efficacité du sommeil, avec un temps d’endormissement plus long et des phases d’éveil nocturnes plus fréquentes. Le sommeil est moins profond qu’au début de l’âge adulte, les stades légers du sommeil non-REM (stades 1 et 2) sont plus fréquents et le sommeil profond ainsi que le sommeil REM, bien que moins prononcé que le sommeil profond, augmentent avec l’âge [1,2] (tableau 1).
La régulation sommeil-éveil ainsi que la régulation du sommeil non-REM et REM sont soumises à des processus neurochimiques et neuroendocriniens couplés à des processus circadiens et homéostatiques. Pour les premiers, le cortisol est d’une grande importance, pour les seconds, l’hormone de croissance (GH). Ces deux hormones sont régulées de manière centrale par des neuropeptides, dont l’hormone de libération de l’hormone de croissance (GHRH), la somatostatine, la CRH et la vasopressine [3,4]. Avec l’âge, l’activité sécrétoire de la composante GH-GHRH diminue, ce qui rend le sommeil non-REM moins profond. Ces modifications des deux axes neuroendocriniens sont associées à un sommeil plus léger et plus court, avec davantage de phases d’éveil et moins de sommeil profond chez les personnes âgées (Fig. 1).
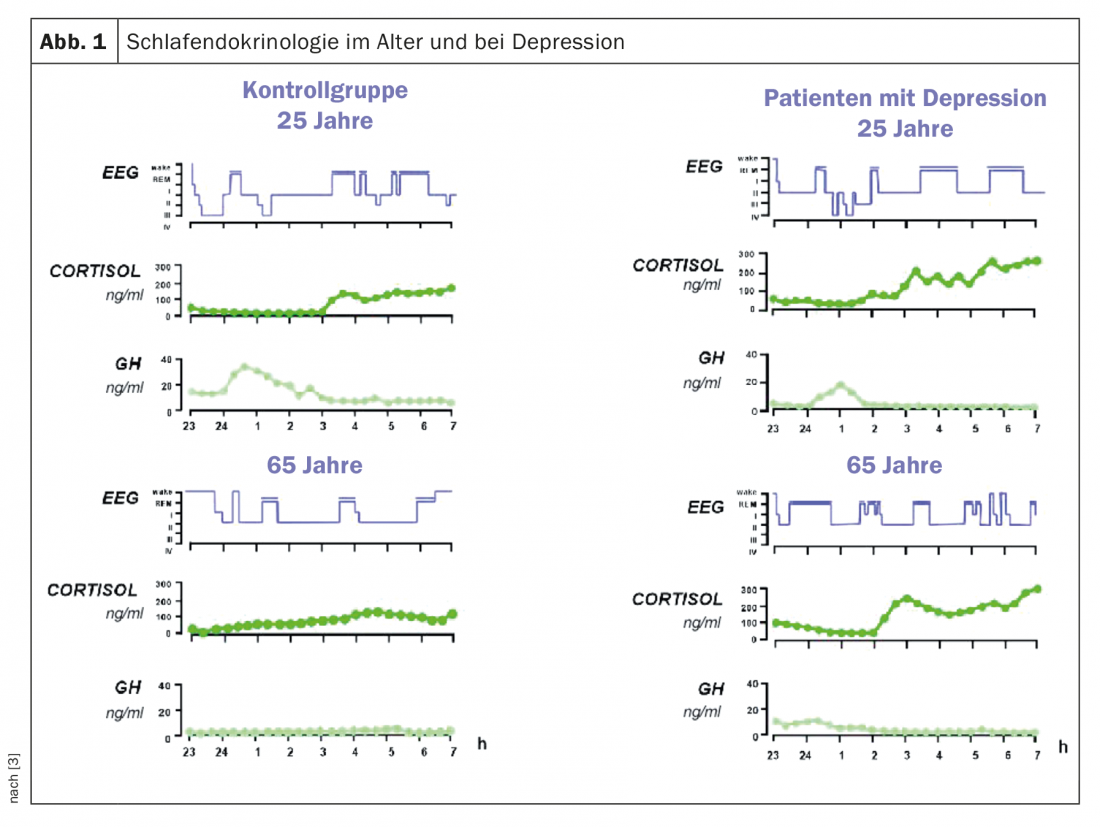
La composante circadienne de la régulation du sommeil évolue également avec l’âge. Les rythmes circadiens de la température corporelle centrale, de la mélatonine et du cortisol sont décalés d’environ une heure vers l’avant (“phase advance”) chez les personnes âgées, avec une amplitude plus faible, jusqu’à 30% de moins [5]. Cela entraîne également un sommeil plus léger et plus agité avec un réveil précoce. Une réduction de l’activité neuronale dans le noyau suprachiasmatique, le pacemaker circadien endogène, est considérée comme la base neuropathologique de ce changement circadien [6].
En raison de ces changements liés à l’âge dans la sécrétion hormonale de cortisol et d’hormone de croissance associée au sommeil, ainsi que de la modification du rythme circadien, il existe une vulnérabilité accrue aux perturbations du sommeil dues à des facteurs exogènes (facteurs de stress).
La “forme” cognitive diminue également
Les performances cognitives comprennent, outre la fonction de mémoire pure, les fonctions d’attention, les aptitudes linguistiques, les fonctions exécutives au sens de la pensée et de l’action planifiées et résolvant des problèmes, ainsi que les capacités visuelles et constructives ou d’orientation et la vitesse psychomotrice [7].
Dans le cadre du processus normal de vieillissement, l’altération des performances cognitives affecte certaines composantes de la cognition de différentes manières : les performances de la mémoire de travail et de la mémoire épisodique (connaissance des événements subjectivement vécus) diminuent. La mémoire sémantique, la mémoire autobiographique, la reconnaissance d’informations apprises antérieurement et la mémoire émotionnelle sont moins affectées [8,9].
En revanche, l’accès au contenu sémantique de la mémoire, qui concerne la connaissance des faits ou la “connaissance du monde”, ainsi que la vitesse d’accès à ce contenu, ne semblent pas être affectés [10]. L’information sémantique, qui fait l’objet d’un nouvel apprentissage, constitue une exception. Tout comme l’information épisodique, elle est soumise à un effet d’âge [11].
Une diminution de la capacité du circuit frontostriatal est supposée être le substrat neuropathologique des changements cognitifs dans le cadre du vieillissement sain, tandis que des changements dans le système de mémoire temporale médiale sont considérés comme la base des troubles cognitifs dans la maladie d’Alzheimer [8,9]. Au niveau neurochimique et neuroendocrinien, la sécrétion de cortisol et les modifications de la neurotransmission dopaminergique et cholinergique, en particulier, sont étroitement liées au fonctionnement de la mémoire déclarative (comprenant la mémoire sémantique, épisodique et autobiographique) chez les personnes âgées [9,12,13].
Contrairement à la mémoire déclarative, la mémoire procédurale – l’apprentissage de séquences d’actions automatiques complexes comme le ski – est en grande partie indépendante des structures hippocampiques [14] et n’est que peu affectée avec l’âge, bien que l’acquisition soit plus lente [11]. Du point de vue neuropathologique, les régions cérébrales néostriatales et cérébelleuses sont particulièrement pertinentes, car elles présentent une réduction du volume et du taux métabolique de glucose en fonction de l’âge [15–18].
Les performances dans les tâches exécutives, comme le test de Trail Making, montrent un effet d’âge significatif, en particulier en ce qui concerne la vitesse [19]. Le cortex préfrontal est considéré comme un substrat neurobiologique général. De plus, on observe avec l’âge une réduction générale et continue de la vitesse des processus cognitifs, surtout à partir de la soixantaine [20].
Quel est le lien entre le sommeil et la mémoire ?
Un sommeil perturbé entraîne une détérioration des performances cognitives [21,22]. Cela peut concerner toutes les dimensions cognitives, mais de préférence la mémoire épisodique, la mémoire de travail et les fonctions exécutives [23].
Des études antérieures sur des sujets sains ont déjà montré que l’activité neurophysiologique des différents stades du sommeil est étroitement liée à des aspects spécifiques des fonctions cognitives [24,25]. A quelques exceptions près, on constate notamment un lien entre le sommeil et la mémoire déclarative. Il en ressort une corrélation entre la fréquence des fuseaux de sommeil et du sommeil profond et la consolidation de la mémoire [26,27]. Les contenus mnésiques teintés d’émotion semblent particulièrement bénéficier d’un sommeil non perturbé, mais semblent être associés à des phases de sommeil paradoxal plutôt qu’à un sommeil profond [28]. Les interactions entre le cortex préfrontal et l’hippocampe, qui peuvent être interprétées comme un transfert de mémoire de l’hippocampe vers le néocortex, jouent ici un rôle essentiel [29].
L’observation selon laquelle la privation de sommeil entraîne une suppression de la potentialisation à long terme et de la neurogenèse dans l’hippocampe [30], soutient cette hypothèse. Une courte sieste pendant la journée a également des effets positifs sur la consolidation de la mémoire déclarative [31,32].
Pour la mémoire procédurale, on trouve des associations avec le stade 2 du sommeil [33,34] et le sommeil paradoxal [35]. Après avoir été privés de sommeil pendant la seconde moitié de la nuit, les sujets sains ont montré une performance de mémoire procédurale inférieure à celle observée pendant un sommeil non perturbé. En revanche, la privation de sommeil pendant la première moitié de la nuit n’a pas d’effet sur la mémoire procédurale [26]. Une courte sieste a un effet positif [36,37], à condition qu’elle comprenne du sommeil paradoxal [38].
Ces résultats indiquent un rôle actif du sommeil dans la formation de la mémoire – dans le sens d’un effet favorisant la consolidation de la mémoire.
La forme mentale grâce au sommeil profond
Dans le cadre d’une grande étude longitudinale (plus de 6000 personnes de plus de 65 ans sans perte cognitive), les troubles cognitifs sont apparus après trois ans de suivi, surtout chez les personnes qui avaient déclaré un trouble du sommeil à la ligne de base [39]. Les fonctions exécutives, en particulier, semblent se détériorer au cours du processus de vieillissement. Ils peuvent être aggravés par une privation de sommeil (expérimentale) ou par un trouble du sommeil (chronique) [40].
D’autres pertes associées au sommeil concernent les fonctions d’attention et de vigilance. Certaines études indiquent que la consolidation de la mémoire dépendante du sommeil est altérée avec l’âge, mais ont pu montrer que les personnes âgées qui ont un certain niveau de sommeil profond ont également une consolidation de la mémoire [41]. On pense donc que la réduction du sommeil profond est liée à la réduction des performances cognitives, en particulier des fonctions exécutives [40].
Troubles du sommeil et cognition réduite : quelques pathologies
Outre la prédisposition à développer des insomnies primaires avec l’âge, l’incidence des insomnies résultant d’autres maladies physiques (par exemple, syndromes douloureux, troubles métaboliques, maladies respiratoires ou cardiovasculaires) et psychiatriques (par exemple, dépression, troubles anxieux) augmente également. Il faut également tenir compte du fait que le traitement médicamenteux de ces maladies peut également avoir un impact sur le sommeil (par exemple, les préparations à base de théophyline pour l’asthme bronchique) [42].
Le développement de l’insomnie chez les personnes âgées a été démontré par l’étude longitudinale EPESE. Après un suivi de trois ans, 57% des personnes âgées ont déclaré au moins un trouble chronique du sommeil, en particulier un trouble de l’endormissement et de la continuité du sommeil [43]. Une analyse plus poussée des données a montré un lien étroit entre l’insomnie et l’apparition d’une humeur dépressive, de troubles respiratoires, d’une mauvaise santé ou d’un handicap physique. On trouve des résultats similaires pour la Suisse [44]. A cela s’ajoutent des troubles primaires spécifiques du sommeil, tels que le syndrome des jambes sans repos (SJSR) ou les troubles respiratoires du sommeil [45,46], qui peuvent entraîner des altérations supplémentaires des performances cognitives [47].
Outre ces troubles primaires ou secondaires du sommeil, on retrouve dans la population âgée des pathologies psychiatriques, notamment neuropsychiatriques, dont la symptomatologie comprend à la fois des troubles de la cognition et des troubles du sommeil. On peut citer en premier lieu la dépression, les différentes démences et la maladie de Parkinson, y compris le trouble du comportement du sommeil paradoxal.
Dépression liée à l’âge : avec les démences, les dépressions représentent le tableau clinique le plus fréquent en psychiatrie et neuropsychiatrie de la personne âgée. Si l’on inclut les épisodes dépressifs légers, certaines études indiquent des prévalences allant jusqu’à 25% [48]. En cas de dépression, on observe une modification caractéristique du profil de sommeil, qui se caractérise par un allongement du temps d’endormissement, une perturbation du sommeil continu et un réveil précoce. L’architecture du sommeil montre une réduction du sommeil profond et une augmentation et une anticipation du sommeil paradoxal [49,50].
Les troubles cognitifs décrits chez les patients souffrant de dépression sénile sont des troubles de l’attention et de la psychomotricité, des fonctions exécutives et de l’apprentissage et de la mémoire verbale et visuelle [51]. Ces troubles sont associés à des taux de rechute plus élevés et à une évolution plus instable [52]. Les troubles chroniques du sommeil sont également associés à un risque jusqu’à quatre fois plus élevé de dépression [53].
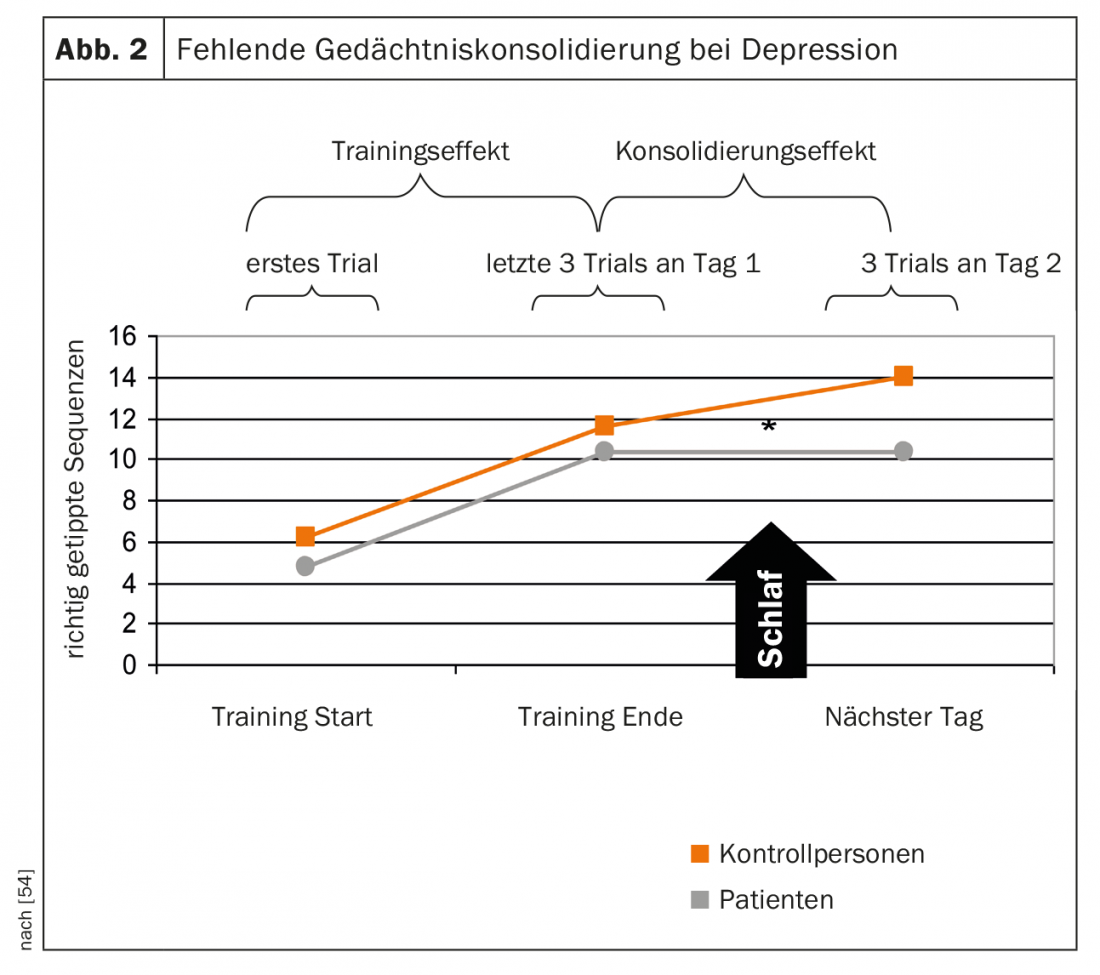
On peut supposer que la perturbation de la continuité du sommeil et la réduction du sommeil profond ont un effet négatif sur la cognition, principalement sur la consolidation de la mémoire associée au sommeil, chez les patients souffrant de dépression. Cela a également été démontré dans une étude sur la consolidation de la mémoire associée au sommeil chez des patients dépressifs, dans la mesure où, contrairement aux sujets sains, il n’y a pas eu d’augmentation de l’apprentissage pendant la nuit pour une tâche apprise avant le sommeil [54] (Fig. 2).
Troubles cognitifs légers (MCI) et démence : les patients atteints de démence souffrent également souvent de troubles du sommeil. Le groupe le plus étudié est celui des patients atteints de la maladie d’Alzheimer. Outre la perturbation de la continuité du sommeil, les autres caractéristiques sont une réduction du sommeil paradoxal tout au long de la nuit, un sommeil plus léger et, chez certains de ces patients, une réduction du sommeil profond et une diminution du nombre de fuseaux de sommeil [55,56]. Dans les études sur la relation entre les paramètres EEG du sommeil et la cognition dans ce groupe de patients, une association étroite a été trouvée entre une performance cognitive plus faible, en particulier dans la mémoire déclarative, et une activité réduite du fuseau [57] ainsi qu’un stade 2 réduit [58].
De plus, il a été démontré que des troubles du sommeil de longue durée entraînent non seulement des troubles cognitifs, mais aussi une augmentation de l’incidence de la démence manifeste [59,60]. Une base possible de cette observation pourrait être le lien récemment trouvé entre l’apparition de bêta-amyloïde (Aβ comme substrat neuropathologique de la démence d’Alzheimer) et une durée de sommeil réduite au fil des ans (<6 heures) chez les personnes âgées [61]. L’un des mécanismes possibles évoqués est que les troubles du sommeil empêchent le cerveau d’assurer la nuit sa fonction de clairance des métabolites toxiques comme Aβ et Tau via le système glymphatique A [62].
La maladie de Parkinson et le trouble comportemental du sommeil paradoxal (TCSP) : le TCSP se caractérise par une absence d’inhibition du tonus musculaire physiologiquement diminué pendant le sommeil paradoxal et par une activité musculaire accrue qui en résulte. En conséquence, des mouvements moteurs se produisent pendant le sommeil paradoxal. Cela conduit à l’expression du contenu du rêve jusqu’à un comportement préjudiciable à autrui ou à soi-même [63]. La RBD, qui fait partie des parasomnies, peut être considérée comme un symptôme de la maladie de Parkinson ou de la démence à corps de Lewy. Elle peut également être symptomatique d’autres lésions cérébrales de tout type (ischémies, tumeurs, sclérose en plaques), de processus inflammatoires ou encore de l’administration de certains médicaments (par ex. antidépresseurs). Elle est également décrite comme une pathologie isolée au sens d’une RBD idiopathique (iRBD) [64].
Les problèmes de sommeil supplémentaires sont plus susceptibles d’apparaître dans la RBD à un stade avancé de la maladie et sont caractérisés par une réduction significative du temps total de sommeil. En outre, des déficits cognitifs apparaissent principalement au niveau de la mémoire déclarative et de la visuoconstruction, ainsi que des fonctions exécutives [65]. Outre la présence éventuelle d’une RBD, les troubles du sommeil observés chez les patients atteints de la maladie de Parkinson dépendent à la fois de la durée, de la sévérité et de la progressivité de la maladie [64]. Outre une réduction de l’efficacité du sommeil ou du temps de sommeil total, on observe également une perturbation de l’architecture du sommeil [66,67]. Sur le plan cognitif, les patients atteints de la maladie de Parkinson développent régulièrement des déficits dans certaines parties des fonctions exécutives, de la mémoire de travail et de la mémoire déclarative. Jusqu’à 50% des patients développent une démence au cours de la maladie [68,69].
Étant donné que les domaines de la performance cognitive sensibles au sommeil sont affectés dans les deux maladies, on peut supposer qu’il existe un lien entre les deux.
Conclusions et perspectives
Le lien étroit entre le sommeil et la performance cognitive suggère une meilleure performance cognitive en cas de bonne continuité du sommeil et d’architecture du sommeil non perturbée avec une répartition physiologique et suffisante du sommeil profond, du sommeil paradoxal et d’autres structures du sommeil comme les fuseaux de sommeil.
Les troubles du sommeil, tout comme les troubles cognitifs, augmentent globalement avec l’âge. Les troubles du sommeil peuvent être un facteur pertinent pour le développement de troubles cognitifs pouvant aller jusqu’à la démence, la dépression et d’autres maladies somatiques (troubles métaboliques, syndrome métabolique). C’est pourquoi les troubles du sommeil chez les personnes âgées doivent être détectés rapidement et traités de manière cohérente. Il en va de même pour les patients atteints des maladies décrites précédemment et qui présentent des troubles du sommeil et de la cognition comme symptômes.
Messages Take-Home
- L’influence du sommeil sur les performances cognitives est empiriquement prouvée. Non seulement les phases d’endormissement et de maintien du sommeil, mais aussi les phases de sommeil profond et de sommeil paradoxal, ainsi que des micro-éléments tels que les fuseaux de sommeil et les complexes K, sont étroitement liés à des fonctions cognitives spécifiques.
- Différents paramètres du sommeil changent au cours du processus de vieillissement. Il existe des preuves que cela interagit avec une diminution des performances cognitives corrélée à l’âge.
- Les troubles du sommeil qui jouent un rôle dans les pathologies qui affectent les fonctions cognitives chez les personnes âgées, comme la démence et la dépression sénile, sont particulièrement importants.
Littérature :
- Ohayon MM, et al : Méta-analyse des paramètres quantitatifs du sommeil de l’enfance à la vieillesse chez des individus en bonne santé : développement de valeurs normatives du sommeil tout au long de la vie humaine. Sleep 2004 ; 27(7) : 1255-1273.
- Vitiello MV : Sleep in normal aging. Sleep Medicine Clinics 2006 ; 1 : 171-176.
- Steiger A : Endocrinologie du sommeil. Neurologue 1995 ; 66 : 15-27.
- Steiger A : Régulation neurochimique du sommeil. J Psychiatr Res 2007 ; 41(7) : 537-552.
- Pace-Schott EF, Spencer RM : Changements liés à l’âge dans la fonction cognitive du sommeil. Prog Brain Res 2011 ; 191 : 75-89.
- Hofman MA, Swaab DF : Living by the clock : the circadian pacemaker in older people. Ageing Res Rev 2006 Feb ; 5(1) : 33-51. Epub 2005 Aug 25.
- Zimbardo PG : Psychologie. Berlin, Heidelberg : Springer 1995.
- Buckner RL : Mémoire et fonction exécutive dans le vieillissement et la MA : multiples facteurs de déclin et facteurs de réserve qui compensent. Neuron 2004 ; 44(1) : 195-208.
- Hedden T, Gabrieli JD : Insights into the ageing mind : a view from cognitive neuroscience. Nat Rev Neurosci 2004 ; 5(2) : 87-96.
- Mayr U, Kliegl R : Traitement sémantique complexe chez les personnes âgées : est-ce que ça reste ou est-ce que ça part ? Psychol Aging 2000 ; 15(1) : 29-43.
- Prull MW, Gabrieli JDE, Bunge SA : Age-related changes in memory : a cognitive neuroscience perspective. Dans : Craik FIM, Salthouse SA (Eds.) : The Handbook of Aging and Cognition 2000 (second edition) ; pp. 91-153. NJ : Lawrence Erlbaum Associates, Mahwah.
- Lupien SJ, et al : Les niveaux de cortisol au cours du vieillissement humain prédisent l’atrophie hippocampique et les déficits de la mémoire. Nat Neurosci 1998 ; 1(1) : 69-73.
- Terry AV, Buccafusco JJ : The cholinergic hypothesis of age and Alzheimer’s disease-related cognitive deficits : recent challenges and their implications for novel drug treatment. J Pharmacol Exp Ther 2003 ; 306(3) : 821-827.
- Squire LR, Zola SM : Structure et fonction des systèmes de mémoire déclarative et non déclarative. Proc Natl Acad Sci USA 1996 ; 93(24) : 13515-13522.
- Brickman AM, et al : Taille striatale, taux métabolique de glucose, et apprentissage verbal dans le vieillissement normal. Brain Res Cogn Brain Res 2003 ; 17(1) : 106-116.
- Doyon J, et al : Changements dépendants de l’expérience dans les contributions cérébelleuses à l’apprentissage des séquences motrices. Proc Natl Acad Sci USA 2002 ; 99(2) : 1017-1022.
- Laforce R, Doyon J : Rôle différentiel pour le striatum et le cervelet en réponse à de nouveaux mouvements en utilisant un paradigme d’apprentissage moteur. Neuropsychologia 2002 ; 40 : 512-517.
- Raz N, et al : Vieillissement différentiel du striatum humain : preuve longitudinale. Am J Neuroradiol 2003 ; 24 : 1849-1856.
- Mayr U, Kliegl R, Krampe RT : Dynamique séquentielle et coordinative du traitement dans les transformations figuratives tout au long de la vie. Cognition 1996 ; 59(1) : 61-90.
- Salthouse TA : Quand commence le déclin cognitif lié à l’âge ? Neurobiol Aging 2009 ; 30(4) : 507-514.
- Van Dongen HPA, et al : Systematic interindividual differences in neurobehavioral impairment from sleep loss : evidence of trait-like differential vulnerability. Sleep 2004 ; 27(3) : 423-433.
- Gadie A, et al : Comment les différences agerelated dans la qualité du sommeil sont-elles associées aux résultats de santé ? An epidemiological investigation in a UK cohort of 2406 adults. BMJ Open 2017 ; 7:e014920. doi : 10.1136/bmjopen-2016-014920.
- Fortier-Brochu E, et al : Insomnia and daytime cognitive performance : a meta-analysis. Sleep Med Rev 2012 ; 16(1) : 83-94. doi : 10.1016/j.smrv.2011.03.008
- Born J, Plihal W : Formation de la mémoire pendant le sommeil : l’importance des stades de sommeil et de la libération de l’hormone de stress. Psychologische Rundschau 2000 ; 51198-51208.
- Stickgold R, James L, Hobson JA : L’apprentissage de la discrimination visuelle requiert du sommeil après l’entraînement. Nature Neuroscience 2000 ; 3(12) : 1237-1238.
- Plihal W, Born J : Effets du sommeil nocturne précoce et tardif sur la mémoire déclarative et procédurale. Journal of Cognitive Neuroscience 1997 ; 9(4) : 534-547.
- Gais S, et al : Le sommeil transforme la trace cérébrale des mémoires déclaratives. Proc Natl Acad Sci USA 2007 ; 104(47) : 18778-18783.
- Wagner U, Gais S, Born J : La formation de la mémoire émotionnelle est augmentée pendant les intervalles de sommeil avec des quantités élevées de sommeil à mouvements oculaires rapides. Learn Mem 2001 ; 8(2) : 112-119.
- Mölle M, Born J : Hippocampus whispering in deep sleep to prefrontal cortex–for good memories ? Neuron 2009 ; 61(4) : 496-498.
- Guzman-Marin R, et al : La privation de sommeil supprime la neurogénèse dans l’hippocampe adulte des rats. Eur J Neurosci 2005 ; 22(8) : 2111-2116.
- Schabus M, et al. : Les fuseaux de sommeil et leur signification pour la consolidation de la mémoire déclarative. Sleep 2004 ; 27(8) : 1479-1485.
- Lahl O, et al : Un épisode de sommeil ultra-court est suffisant pour promouvoir la performance de la mémoire déclarative. J Sleep Res 2008 ; 17(1) : 3-10.
- Nader R, Smith C : Un rôle pour le sommeil de stade 2 dans le traitement de la mémoire. Dans : Maquet P, Smith C, Stickgold R (éd.) : Sleep and Brain Plasticity ; 2003. New York : Oxford Press.
- Manoach DS, et al : La réduction de la consolidation de l’apprentissage procédural pendant la nuit dans la schizophrénie chronique sous traitement est liée à des stades spécifiques de sommeil. J Psychiatr Res 2010 ; 44(2) : 112-120.
- Marshall L, Born J : The contribution of sleep to hippocampus-dependent memory consolidation. Trends Cogn Sci 2007 ; 11(10) : 442-450.
- Backhaus J, Junghanns K : Les siestes de jour améliorent la mémoire motrice procédurale. Sleep Med 2006 ; 7(6) : 508-512.
- Korman M, et al : Daytime sleep condenses the time course of motor memory consolidation. Nat Neurosci 2007 ; 10(9) : 1206-1213.
- Tucker MA, et al : A daytime sleep containing only non-REM sleep enhances declarative but not procedural memory. Neurobiol Learn Mem 2006 ; 86(2) : 241-247.
- Cricco M, Simonsick EM, Foley DJ : The impact of insomnia on cognitive functioning in older adults. J Am Geriatr Soc 2001 ; 49(9) : 1185-1189.
- Della Monica C, et al : Rapid Eye Movement Sleep, Sleep Continuity and Slow Wave Sleep as Predictors of Cognition, Mood, and Subjective Sleep Quality in Healthy Men and Women, Aged 20-84 Years. Front Psychiatry 2018 ; 9 : 255.
- Backhaus J, et al : Le déclin à mi-vie dans la consolidation de la mémoire déclarative est corrélé avec un déclin dans le sommeil à ondes lentes. Learn Mem 2007 ; 14(5) : 336-341.
- Hemmeter UM : Gestion des troubles de la régulation du sommeil et de l’éveil dans les maladies liées à l’âge. Archives suisses de neurologie et de psychiatrie 2011 ; 162(3) : 108-118.
- Foley DJ, et al : Sleep complaints among elderly persons : an epidemiologic study of three communities. Sleep 1995 ; 18 : 425-432.
- Delini-Stula A, Bischof R, Holsboer-Trachsler E : Sleep behavior in the Swiss population : Prevalence and the day-time consequences of insomnia. Somnologie 2007 ; 11 : 193-201.
- Ancoli-Israel S, et al. : Periodic limb movements in sleep in community-dwelling elderly. Sleep 1991 ; 14 : 496-500.
- Ohayon MM, Roth T : Prévalence du syndrome des jambes sans repos et du trouble du mouvement périodique des membres dans la population générale. J Psychosom Res 2002 ; 53 : 547-554.
- Leng Y, McEvoy CT, Allen IE, Yaffe K : Association of Sleep-Disordered Breathing With Cognitive Function and Risk of Cognitive Impairment : A Systematic Review and Meta-analysis. JAMA Neurol 2017 ; 74(10) : 1237-1245.
- Hatzinger M, et al. : Recommandations pour le diagnostic et le traitement de la dépression chez les personnes âgées. Praxis (Berne 1994) 2018 ; 107(3) : 127-144.
- Riemann D, Berger M, Voderholzer U : Sleep and depression–results from psychobiological studies : an overview. Biol Psychol 2001 ; 57(1-3) : 67-103.
- Benca RM, Peterson MJ : Insomnie et dépression. Sleep Med 2008 Sep ; 9 Suppl 1 : S3-9.
- Reppermund S, Ising M, Lucae S, Zihl J : L’altération cognitive dans la dépression unipolaire est persistante et non spécifique : preuve supplémentaire de l’hypothèse finale du trouble de la voie commune. Psychol Med 2009 ; 39(4) : 603-614.
- Fossati P, Ergis AM, Allilaire JF : Fonctionnement exécutif dans la dépression unipolaire : une revue. Encéphale 2002 ; 28(2) : 97-107.
- Baglioni C, et al : Sleep and mental disorders : A meta-analysis of polysomnographic research. Psychol Bull 2016 ; 142(9) : 969-990.
- Dresler M, et al : Une double dissociation des troubles de la mémoire dans la dépression majeure. J Psychiatr Res 2011 ; 45(12) : 1593-1599.
- Bliwise DL : Troubles du sommeil dans la maladie d’Alzheimer et autres démences. Clin Cornerstone 2004 ; 6(Suppl 1A) : S16-28.
- Palmer K, et al : Sleep Disturbance in Mild Cognitive Impairment and Association With Cognitive Functioning. Une étude cas-témoins. Front Aging Neurosci 2018;10 : 360.
- Rauchs G, et al. : Y a-t-il un lien entre les changements de sommeil et la mémoire dans la maladie d’Alzheimer ? Neuroreport 2008 ; 19(11) : 1159-1162.
- Kundermann B, et al : Comparaison des variables polysomnographiques et de leur relation avec l’altération cognitive chez les patients atteints de la maladie d’Alzheimer et de démence frontotemporale. J Psychiatr Res 2011 ; 45(12) : 1585-1592.
- Ju YE, Lucey BP, Holtzman DM : Sleep and Alzheimer disease pathology-a bidirectional relationship. Nat Rev Neurol 2014 ; 10 : 115-119. doi : 10.1038/nrneurol.2013.269
- Lim AS, Kowgier M, Yu L, Buchman AS, Bennett DA : Fragmentation du sommeil et risque d’apparition de la maladie d’Alzheimer et de déclin cognitif chez les personnes âgées. Sleep 2013 ; 36 : 1027-1032. doi : 10.5665/sleep.2802
- Busche MA, Kekuš M, Förstl H : Comment le sommeil et la maladie d’Alzheimer sont liés. Neurologue 2017 ; 88(3) : 215-221.
- Xie L, et al : Le sommeil entraîne la clairance des métabolites dans le cerveau adulte. Science 2013 ; 342 : 373-377.
- Boeve BF : REM sleep behavior disorder : Updated review of the core features, the REM sleep behavior disorder-neurodegenerative disease association, evolving concepts, controverses, and future directions. Ann N Y Acad Sci 2010 ; 1184 : 15-54.
- Oertel WH, et al : REM sleep behavior disorder as a prodromal stage of α-synucleinopathies : symptoms, epidemiology, pathophysiology, diagnosis and therapy. Neurologist 2014 ; 85(1) : 19-25.
- Hemmeter UM : Trouble du sommeil REM dans la démence et la maladie de Parkinson. Leading Opinions Neurologie et Psychiatrie 2018 ; 4 : 15-17.
- De Cock VC, Vidailhet M, Arnulf I : Troubles du sommeil chez les patients atteints de parkinsonisme. Nat Clin Pract Neurol 2008 ; 4(5) : 254-266.
- Placidi F, et al : Sleep-wake cycle and effects of cabergoline monotherapy in de novo Parkinson’s disease patients. Une étude polysomnographique ambulatoire. J Neurol 2008 ; 255(7) : 1032-1037.
- Foltynie T, et al : The cognitive ability of an incident cohort of Parkinson’s patients in the UK. L’étude CamPaIGN. Brain 2004 ; 127(Pt 3) : 550-560.
- Balas M, Giladi N, Gurevich T : Cognition in multiple system atrophy : neuropsychological profile and interaction with mood. J Neural Transm 2010 ; 117(3) : 369-375.
- Hemmeter UM : Sommeil et cognition chez les personnes âgées. Psychiatrie & Neurologie 2012 ; 4 : 10-14.
InFo NEUROLOGIE & PSYCHIATRIE 2019 ; 17(1) : 10-15











